Мукополисахаридоз II типа у детей
Термины и определения
Ферментная заместительная терапия – лечение, заключающееся во введении препарата (рекомбинантного фермента) пациентам с наследственным нарушением метаболизма.
Лизосомные болезни накопления – группа наследственных моногенных заболеваний, связанных с нарушением функции лизосом.
Мукополисахаридозы (МПС) — группа наследственных болезней обмена веществ, связанных с нарушением метаболизма гликозаминогликанов (ГАГ), приводящее к поражению органов и тканей. Обусловлены данные заболевания мутациями генов, контролирующих процесс внутрилизосомного гидролиза макромолекул.
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
МПС II типа (болезнь Хантера) — наследственная лизосомная болезнь накопления, с Х- сцепленным рецессивным типом наследования, которая характеризуется снижением активности лизосомного фермента идуронат-2-сульфатазы (I2S), что связано с мутацией в гене IDS. Дефицит фермента приводит к накоплению гликозаминогликанов (ГАГ) в лизосомах, преимущественно гепарансульфата и дерматансульфата и проявляется прогрессирующими психоневрологическими нарушениями (при тяжелой форме), поражением паренхиматозных органов, сердечно- лёгочными расстройствами, костными деформациями [1-3].

Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
— 800 RUB / 5500 KZT / 27 BYN — 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
Классификация
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний)поМеждународнойстатическойкласификации болезней и проблем, связанных со здоровьем
Согласно МКБ10, заболевание относится к классу IV, болезням эндокринной системы, расстройству питания и нарушению обмена веществ, E 76.1 — Мукополисахаридоз II типа
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
В соответствии с дефицитом/отсутствием лизосомных ферментов, соответствующим генным дефектам и тяжести клинической симптоматики, выделяют 11 типов МПС (приложение А3.1). В настоящее время выделяют тяжелую и умеренно-тяжелую форму МПС II типа, в зависимости от скорости прогрессирования поражения различных органов и систем [1].
Этиология и патогенез
Причиной болезни является дефицит или отсутствие фермента идуронат-2- сульфатазы (I2S). Ген идуронат-2-сульфатазы IDS картирован на длинном плече Х- хромосомы, в локусе Xq27.1-q28. Тип наследования болезни Хантера – Х-сцепленный рецессивный. МПС II страдают, как правило, только мальчики, однако описано несколько случаев заболевания у девочек, как правило, связанных с хромосомой патологией [1-3].
Из-за снижения активности фермента происходит накопление различных типов ГАГ и развивается соматическая манифестация в виде лицевого дисморфизма, гепатоспленомегалии, поражения сердца, дыхательной системы, изменений скелета, неврологической симптоматики, гематологические и офтальмологические изменения. Вариабельность МПС определяется типом накапливаемого субстрата при недостаточной деградации ГАГ: при МПС II типа происходит накопление гепарансульфата и дерматансульфата.
Эпидемиология
МПС II типа встречается с частотой 1:140 000 — 1:156 000 живых новорожденных мальчиков [1,4].
Клиническая картина
Cимптомы, течение
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Клиническая картина болезни Хантера разнообразна.
Внешний вид пациента: прогрессирующее отставание в росте, макроцефалия, лицевой дисморфизм: плоская переносица, широко расставленные глаза, утолщенные губы, гипоплазированная нижняя челюсть, макроглоссия и гиперплазия десен, короткая шея, сгибательные контрактуры конечностей, гипертрихоз, характерны низкая линия роста волос на лбу, длинные густые ресницы и брови. Типично позднее прорезывание зубов, часто встречаются грыжи различной локализации
Кожные покровы: для данной формы МПС характерно узелково-папулёзное поражение кожи, преимущественно в области лопаток, наружных и боковых поверхностей плеч и бёдер (“морская галька” или «шагреневая кожа»). Эти изменения обусловлены отложением липидов и ГАГ в дерме [1,8].
Костная система: как правило, при тяжелой форме, уже на втором году жизни отмечается отставание в росте и формируется множественный дизостоз, с тугоподвижностью в суставах, из-за возникающих контрактур. Деформация костей черепа – скафоцефалия, макроцефалия. С ростом ребенка прогрессирует кифоз, сколиоз, формируется воронкообразная деформация грудной клетки. Возникает и прогрессирует ограничение движений в суставах, по этой причине часто кисть деформируется по типу «когтистой лапы». Иногда возникают вальгусные деформации голени и патология тазобедренного сустава.
Органы дыхания: характерны частые респираторные заболевания: риниты, синуситы; повторные отиты, которые часто приводят к прогрессирующей потере слуха; повторные бронхиты и обструктивные бронхиты, пневмонии, синдром обструктивного апноэ сна [1,5,6].
Органы зрения: пигментная дегенерация сетчатки, редко встречается умеренное помутнение роговицы, которое зачастую может быть выявлено только при исследовании прозрачности сред с помощью щелевой лампы. У пациентов с тяжелой формой МПС II часто выявляется дистрофия сетчатки, приводящая к нарушению периферического и снижению сумеречного зрения. Возможен отек диска зрительного нерва, обусловленный повышением внутричерепного давления. Редко встречается глаукома [5,7].
Центральная нервная система: при тяжелой форме заболевания задержка психомоторного и речевого развития выражена с 1,5-3 лет. К 8 годам развивается тяжелая умственная отсталость. Характерно наличие судорог (особенно при тяжелой форме).
Симптоматическая эпилепсия развивается, как правило, при тяжелом или среднетяжелом течении заболевания. У пациентов со слабо выраженными клиническими признаками она встречается крайне редко. Судороги характеризуются полиморфной клинической картиной с развитием разнообразных фокальных и вторично-генерализованных пароксизмов. Ранними клиническими проявлениями судорожного синдрома могут быть простые абсансы с кратковременным угнетением или потерей сознания и сопутствующими двигательными или вегетативными расстройствами. У пациентов со слабо выраженными клиническими признаками судорожный синдром встречается намного реже. Появление судорог требует проведения оценки неврологического статуса. При прогрессировании заболевания часто наблюдаются генерализованные тонико-клонические пароксизмы, которые обычно хорошо поддаются монотерапии противоэпилептическими препаратами. Противосудорожная терапия требует индивидуального подхода и иногда длительного подбора дозы препарата. Часто необходимо ведение пациента на более низких дозах противоэпилептических препаратов в связи с плохой переносимостью их высоких доз.
Нередко формируется сообщающаяся гидроцефалия, спастические пара- и тетрапарезы.
Признаки гидроцефалии зачастую появляются медленно и незаметно, и могут заключаться в изменении поведения, появлении головной боли, нарушении зрения.
Описаны также случаи сдавления спинного мозга, вызванного утолщением его оболочек или нестабильностью атлантоаксиального сустава. Краниовертебральный стеноз развивается у пациентов с МПС II вследствие гипоплазии зубовидного отростка С2 позвонка, атлантоаксиальной нестабильности, отложение ГАГ в твердой мозговой оболочке и задней продольной связке, что в дальнейшем приводит к компрессионной миелопатии на этом уровне, и как следствие, развитию бульбарных нарушений, центральной дыхательной недостаточности. Симптомы могут включать нарушение походки, мышечную слабость, неуклюжесть при сохранных моторных навыках и дисфункцию мочевого пузыря.
Карпальный тоннельный синдром – это частая нейропатия сдавления у пациентов в возрасте от 3 до 10 лет. В начальной стадии заболевания возникают онемение пораженной кисти, трудности выполнения тонких движений, снижение чувствительности пальцев кисти. Эти симптомы редко отмечаются ребенком и не расцениваются родителями как патологические. Позже появляются парестезии, чувство покалывания в кончиках пальцев кисти и со временем процесс может распространяться на предплечье и плечо. Пациенты часто не сообщают о болевых ощущениях, пока не происходит потеря функции.
Нарушения глотания: контрактуры в височно-нижнечелюстных суставах приводят к снижению подвижности нижней челюсти, что ограничивает способность открывать рот и жевать. Нарушения глотания отмечаются при среднетяжелом и тяжелом течении заболевания и связаны с функционированием стволовых отделов головного мозга. При нарушении их работы наблюдаются признаки псевдобульбарного или бульбарного параличей. Симптомы дебютируют с редких поперхиваний твердой пищей, гиперсаливации, развиваются постепенно и, в конечном итоге, приводят к грубому нарушению функции глотания или полному ее исчезновению. Отсутствие правильной регуляции акта глотания приводит к забросу пищи, слюны в трахею и бронхиальное дерево и развитию вторичной инфекции в виде рецидивирующих аспирационных бронхитов и пневмоний. Это усугубляет дыхательные нарушения, являющиеся следствием отложения ГАГ в верхних и нижних дыхательных путях.
Поведенческие нарушения — гиперактивность, расторможенность, агрессивность и упрямство, как правило, имеют место у взрослых пациентов со среднетяжелой и тяжелой формами МПС II. Проблемы с поведением значительно влияют на повседневную жизнь пациента и его социальную адаптацию. Появляясь на втором году жизни, они продолжаются вплоть до 8 — 12 лет. Регресс когнитивных функций наряду с тяжёлой потерей слуха, расстройством сна, особенно обусловленным обструктивным апноэ, оказывают существенное влияние на поведение ребенка и молодого взрослого. По мере нарастания когнитивного дефицита к гиперактивности и агрессивности присоединяются аутистические черты, отмечается постепенная потеря навыков экспрессивной и импрессивной речи. Медикаментозная терапия, направленная на контроль разрушительного поведения, часто бывает неэффективной. В дальнейшем прогрессирование нейродегенеративных изменений приводит к деменции, двигательным нарушениям, что нивелирует особенности поведения.
Сердечно-сосудистая система: вследствие отложения ГАГ с раннего возраста клапаны сердца утолщаются, возникает регургитация, либо стеноз. В ряде случаев возможно формирование гипертрофии мышечной ткани сердца, уменьшение ее эластичности, нарушение проводимости, поражение коронарных артерий.
Чаще встречается патология клапанов сердца (недостаточность и/или стеноз митрального, аортального, трикуспидального и легочного клапанов). Имеет место поражение коронарных сосудов. Магистральные сосуды у пациентов с МПС могут иметь утолщенные стенки, но при этом могут быть суженными или дилатированными. В связи с сужением артерий, у таких пациентов появляется клинически выраженная артериальная гипертензия. Встречается расширение восходящей части аорты, и значительное уменьшение эластичности стенок аорты. При кардиомиопатии (инфильтративной) выявляется гипертрофия миокарда или дилатация камер сердца. Пациенты могут иметь нарушение ритма и проводимости сердца. Течение сердечной недостаточности (СН) при МПС II имеет прогрессирующий характер. Трудности диагностики этого состояния связаны с неспецифичностью клинической симптоматики, отсутствием жалоб, характерных признаков нарушения кровообращения на ранних этапах ее развития.
вследствие ограничения объема движения нижней челюсти и затруднения разжевывания пищи, гипертрофии миндалин, макроглоссии развиваются нарушение акта глотания и слюнотечение, возможна диарея, связанная с накоплением ГАГ в нервных клетках пищеварительного тракта. С возрастом часто развиваются запоры. С ранних лет отмечается гепатоспленомегалия. Характерны пупочная и паховая грыжи [1,5].
Выраженность клинических проявлений в зависимости от возраста представлена в Приложении А3.2
Диагностика
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Диагноз МПС тип II устанавливается на основании совокупности анамнестических данных, клинических данных, результатов лабораторного исследования (биохимического и молекулярно-генетического анализа).
Дифференциальная диагностика проводится с другими типами МПС, альфа- маннозидозом, поздними формами ганглиозидозов, муколипидозом, неинфекционными полиартритами, эпифизарными дисплазиями [1,2,3,14,16].
Основными отличительными чертами МПС II типа являются: прозрачная роговица, наличие изменений кожного покрова по типу «морской гальки» [7,8].
Пациентам с установленным диагнозом МПС II проводится динамическое наблюдение (средняя частота проведения консультаций и обследования представлена в Приложении А3.3).
2.1 Жалобы и анамнез
При сборе анамнеза и жалоб рекомендовано обратить внимание на следующие жалобы и анамнестические события:
- отягощенный семейный анамнез (сходные симптомы у родных братьев и родственников по материнской линии);
- низкий рост;
- огрубление черт лица;
- частые респираторные заболевания;
- задержка психомоторного развития (только для тяжелой формы болезни);
- задержка/регресс психического развития (только для тяжелой формы болезни);
- снижение слуха;
- снижение зрения;
- множественный дизостоз (деформации черепа, грудной клетки, позвоночника, конечностей);
- нарушение осанки — кифоз, сколиоз;
- рецидивирующие грыжи (чаще двусторонние);
- ухудшение переносимости физических нагрузок;
- слабость в конечностях;
- тугоподвижность в суставах;
- трудности подъема из положения сидя и лёжа;
- изменение походки;
- неловкость мелкой моторики;
- нарушение контроля за функциями тазовых органов;
- апноэ во сне.
2.2 Физикальное обследование
При осмотре необходимо обратить внимание на основные клинические проявления МПС II:
- грубые черты лица;
- низкорослость;
- поведенческие нарушения (для тяжелой формы болезни);
- тугоподвижность суставов;
- помутнение роговицы;
- гепатомегалия;
- спленомегалия;
- пахово-мошоночные и пупочные грыжи (двусторонние);
- шумы в сердце
2.3 Лабораторные диагностические исследования
Основные лабораторные методы подтверждения диагноза МПС II включают определение активности фермента идуронат-2-сульфатазы, количественный и качественный анализ ГАГ мочи и молекулярно-генетические исследования гена IDS.
- Рекомендуется всем пациентам определение уровня гликозаминогликанов мочи (комплекс исследований для диагностики мукополисахаридоза тип II) с целью подтверждения диагноза и установления типа МПС и количественное определение ГАГ на фоне терапии каждые 6 месяцев [12,14,16].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3).
Комментарий: При количественном анализе выявляют повышение концентрации ГАГ с мочой, при проведении электрофореза ГАГ- повышенную экскрецию дерматансульфата и гепарансульфата с мочой. Эти изменения наблюдаются также при МПС I, VII типов. Уровень ГАГ является возраст-зависимым параметром. Также при легкой форме МПС II концентрация ГАГ в моче может быть лишь незначительно повышена.
- Рекомендуется всем пациентам для подтверждения диагноза определение активности идуронат-2-сульфатазы в пятнах крови, высушенных на фильтровальной бумаге (фильтр № 903), плазме крови (комплекс исследований для диагностики мукополисахаридоза тип II) [12,14,16].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: У пациентов с синдромом Хантера наблюдается снижение активности идуронат-2-сульфатазы в культуре фибробластов, плазме крови, либо в пятнах крови, высушенных на фильтровальной бумаге. Необходимо измерение активности других сульфатаз для исключения множественной сульфатазной недостаточности.
Забор биоматериала для диагностики в пятнах крови описан в Приложении А3.4
- Рекомендуется всем пациентам со сниженной активностью фермента идуронат-2- сульфатазы проведение молекулярно-генетического исследования: выявление мутаций в гене IDS, кодирующем идуронат-2-сульфатазу с целью подтверждения диагноза на молекулярно-генетическом уровне [1,12,14,16,17].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Выявление семейной мутации гена IDS делает возможным обследование родственников пробанда, выявление гетерозиготных носительниц МПС II, а также проведение пренатальной и преимплантационной диагностики. Большинство мутаций у пациентов с МПС II могут быть выявлены с помощью секвенирования по Сэнгеру всех экзонов и прилегающих к ним участков интронов гена, но в небольшом проценте случаев мутацию с применением стандартных методов обнаружить не удается. Примерно 20% всех мутаций составляют крупные перестройки гена, что может потребовать применения дополнительных, более сложных молекулярно-генетических тестов.
В соответствии с Приказом Минздрава России от 13 октября 2017 г № 804н «Об утверждении номенклатуры медицинских услуг» название услуги: Комплекс исследований для диагностики мукополисахаридоза тип II.
- Рекомендуется всем пациентам с МПС II проведение анализа крови биохимического общетерапевтического с целью определения функционального состояния печени (аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ), общий и прямой билирубин, холестерин [32].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: исследование холестерина включает в т.ч., исследование уровня холестерина липопротеинов высокой плотности в крови, исследование уровня холестерина липопротеинов низкой плотности, исследование уровня липопротеинов в крови, триглицериды. Исследование следует проводить в процессе динамического наблюдения, в среднем, 1 раз в 6 мес.
- Рекомендуется всем пациентам с МПС II проведение общего (клинического) анализа крови (Общий (клинический) анализ крови развернутый) для оценки основных параметров кроветворения и выявления возможных инфекционных процессов [32].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: в связи с высоким риском развития интеркуррентных инфекций, аспирационной пневмонии у пациентов с МПС рекомендуется проведение данного исследования, в среднем, 2 раза в год.
- Рекомендуется всем пациентам с МПС II проведение общего анализа мочи для оценки состояния мочевыводящих путей и почек [33].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: рекомендуется проведение данного исследования не реже 2 раз в год.
- Рекомендуется всем пациентам с МПС II проведение исследования коагулограммы (активированное частичное тромбопластиновое время, определение протромбинового (тромбопластинового) времени в крови, определение тромбинового времени в крови, исследование уровня фибриногена в крови, определение концентрации Д-димеров в крови) для оценки состояния системы коагуляции и своевременной профилактики развития тромбозов [34].
Уровень убедительности рекомендации C (уровень достоверности доказательств – 4).
Комментарии: частота исследования, в среднем, 1 раз в год, при необходимости – чаще (перед каждым оперативным вмешательством).
- Рекомендуется всем пациентам с МПС II проведение исследования уровня N- терминального фрагмента натрийуретического пропептида мозгового (NT-proBNP) в крови для своевременной диагностики сердечной недостаточности, дифференциальной диагностики с одышкой, вызванной респираторными проблемами, для решения вопросов о старте/коррекции кардиотропной терапии [34].
Уровень убедительности рекомендации C (уровень достоверности доказательств – 4).
Комментарий: кратность исследования: 1 раз в год.
- Рекомендуется всем пациентам с МПС II проведение УЗИ органов брюшной полости (Ультразвуковое исследование органов брюшной полости (комплексное), Ультразвуковое исследование печени, Ультразвуковое исследование селезенки) и/ или проведение магнитно-резонансной томографии органов брюшной полости и/ или компьютерной томографии органов брюшной полости с целью выявления увеличений размеров печени и селезенки [2,14,16,35].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: выявляются умеренная гепатомегалия или гепатоспленомегалия. На фоне терапии размеры печени и селезенки уменьшаются.
Выбор метода исследования – по индивидуальным показаниям исходя из возможностей пациента и клинической потребности. При необходимости применяется анестезиологическое пособие. Кратность исследования 1 раз в год, при необходимости — чаще.
- Рекомендуется проведение рентгенографии шейного и/или грудного и/или поясничного отдела позвоночника и/или тазобедренных суставов и/или рентгенографии верхних и/или нижних конечностей с целью выявления множественного дизостоза [2,14,16,21].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: выявляются множественные дизостозы, скафоцефалия, гипоплазия зубовидного отростка С2-позвонка, дорсолюмбальный кифоз в результате платиспондилии, поясничный гиперлордоз. Определяются широкие ребра, короткие изогнутые ключицы, гипоплазия головок плечевых костей и варусная деформация плечевых костей в проксимальных отделах, дистальные эпифизы костей предплечья скошены друг к другу. Задержка формирования ядер окостенения. Пястные кости кистей укорочены и сужены — «заострены» в проксимальных отделах, «скошенность» вертлужных впадин, деформированные, уплощенные головки бедренных костей и вальгусная деформация шеек бедренных костей. Исследования проводятся не реже 1 раза в год, при легких формах – обычно не реже 1 раза в 2 года.
- Рекомендуется пациентам с МПС II с наличием/риском сдавления срединного нерва проведение электрофизиологического исследования электронейромиографии (ЭНМГ) (Электронейромиография стимуляционная одного нерва, Электромиография стимуляционная срединного нерва, Электромиография игольчатая), что позволяет оценить функциональное состояние мышечных тканей, нервов и нервно-мышечной передачи (не реже 1 раза в 12 месяцев) [2,14,16].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: стимуляционная ЭНМГ позволяет определить сдавление срединного нерва даже до появления симптомов и должна проводиться, начиная с возраста 4-5 лет ежегодно.
- Рекомендуется всем пациентам с МПС II консультация врача-оториноларинголога с проведением осмотра верхних дыхательных путей (носоглотки и гортани), в том числе с помощью эндоскопии [2,36]
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: у пациентов с раннего возраста отмечаются гипертрофия аденоидов и миндалин.
При наличии показаний проводится эндоскопическая эндоназальная ревизия полости носа, носоглотки, эпифаринголарингоскопия, эпифарингоскопия видеоэндоскопическая (в среднем, 2 раза в год).
- Рекомендуется консультация врача-сурдолога-оториноларинголога и проведение аудиометрии всем пациентам с МПС II с целью выявления тугоухости. При подозрении на снижение слуха необходимо проведение отоакустической эмиссии (Тональная аудиометрия, Речевая аудиометрия, Игровая аудиометрия, Регистрация вызванных акустических ответов мозга на постоянные модулированные тоны (ASSR тест)) (при отсутствии экссудативного отита (не реже 1 раза в 12 месяцев) [1,2,5].
Уровень убедительности рекомендаций С (уровень достоверности доказательств –5).
Комментарии: тугоухость разной степени выраженности характерна для данного заболевания. Она может быть кондуктивной или нейросенсорной или носить смешанный характер. Раннее выявление тугоухости позволяет улучшить качество жизни пациентов, обеспечить возможность общения и обучения.
- Рекомендовано проведение исследования функции внешнего дыхания (ФВД) методом спирометрии всем пациентам с МПС II, способным выполнить требуемый дыхательный маневр для оценки эффективности проводимой терапии, контроля за состоянием бронхолегочной системы [2,14,16].
Комментарии: в соответствии с Приказом Минздрава России от 13 октября 2017 г № 804н «Об утверждении номенклатуры медицинских услуг»: Исследование неспровоцированных дыхательных объемов и потоков, Исследование дыхательных объемов с применением лекарственных препаратов. Исследование проводится не реже 1 раза в год.
- Рекомендовано проведение прицельной рентгенографии органов грудной клетки всем пациентам с МПС II с целью оценки деформации грудной клетки [2, 37].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Также при исследовании могут быть обнаружены изменения легочной ткани.
Следует рассмотреть проведение данного исследования и при наличии аускультативных изменений в легких в связи с возможностью развития пневмонии у пациентов с МПС II. Кратность исследования определяется индивидуально, в среднем, 1 раз в 2 года
- Рекомендовано проведение электроэнцефалографии (ЭЭГ) пациентам с МПС II, у которых были эпилептические приступы в анамнезе, с целью их диагностики и контроля [2,38].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: как наиболее информативную методику данного исследования следует выбирать электроэнцефалографию с видеомониторингом. Исследование следует проводить при первичной диагностике и далее ежегодно при отсутствии противопоказаний.
- Рекомендовано проведение полисомнографии/кардиореспираторного мониторинга всем пациентам с МПС II с обструктивным апноэ сна (не реже 1 раза в два года) [2,3,14,16].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: для диагностики и оценки степени обструктивного апноэ сна проводится полисомнография/кардиореспираторный мониторинг, которая позволяет определить характер дыхательных нарушений (исключить центральный генез, связь с гипертрофией аденоидов, сердечной недостаточностью или комплекс причин), патологию сердечно-сосудистой системы.
В соответствии с Приказом Минздрава России 13 октября 2017 г № 804н от «Об утверждении номенклатуры медицинских услуг» нет услуги «Полисомнография», в связи с чем возможно использование набора услуг: Электроэнцефалография с видеомониторингом, Суточное мониторирование артериального давления, Регистрация электрокардиограммы, Мониторирование электрокардиографических данных, Холтеровское мониторирование сердечного ритма, Расшифровка, описание и интерпретация электрокардиографических данных, Электромиография накожная (одна анатомическая зона), Электроокулография, Определение парциального давления кислорода в мягких тканях (оксиметрия)/Пульсоксиметрия).
- Рекомендовано проведение ЭКГ 1 раз в 6 месяцев, Эхо-КГ, холтеровского мониторирования ЭКГ и суточного мониторирования артериального давления всем пациентам с МПС II для оценки состояния сердца (1 раз в год, при необходимости чаще) [2,3,14,16].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: регулярное проведение ЭКГ, Эхо-КГ, холтеровского мониторирования ЭКГ, суточного мониторирования артериального давления необходимо пациентам с данной патологией, так как с раннего возраста у них отмечаются сердечно-сосудистые нарушения.
В соответствии с Приказом Минздрава России 13 октября 2017 г № 804н от «Об утверждении номенклатуры медицинских услуг»: Суточное мониторирование артериального давления, Регистрация электрокардиограммы, Мониторирование электрокардиографических данных, Холтеровское мониторирование сердечного ритма, Расшифровка, описание и интерпретация электрокардиографических данных,
- Рекомендовано всем пациентам с МПС II проведение компьютерной томографии и/или магнитно-резонансной томографии (МРТ) головного мозга и позвоночника с целью выявления компрессии спинного мозга и гидроцефалии [2, 22,39].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Нестабильность атлантоаксиального сочленения может быть выявлена при рентгенографии шейного отдела позвоночника с функциональными пробами, однако для подтверждения компрессии спинного мозга вследствие утолщения его оболочек и формирующихся аномалий позвонков требуется проведение МРТ и/или КТ.
Исследование(я) проводятся в том числе, при динамическом наблюдении пациента, частота определяется индивидуально (в среднем, 1 раз в два года).
При необходимости проводится наркоз.
В соответствии с Приказом Минздрава России от 13 октября 2017 г № 804н «Об утверждении номенклатуры медицинских услуг»: КТ (МРТ) шейного отдела позвоночника:
- Рекомендовано пациентам с МПС II консультация врача-офтальмолога и проведение исследования переднего сегмента глаза методом бокового освещения, измерение внутриглазного давления (Офтальмотонометрия) и оценка состояния глазного дна (Офтальмоскопия, Осмотр периферии глазного дна с использованием трехзеркальной линзы Гольдмана, Биомикрофотография глазного дна с использованием фундус-камеры) с целью выявления глаукомы, изменения прозрачности глазных сред и состояния сетчатки [2,3,14,16].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Кратность исследований, в среднем, 1 раз в год.
Для пациентов с МПС II не характерно помутнение роговицы. У некоторых пациентов развивается глаукома, пигментная дистрофия сетчатки. Редко — отек диска зрительного нерва.
- Рекомендовано всем пациентам с МПС II проведение 6 минутного теста ходьбы (6МТХ) при диагностике или с момента возможности пациента к выполнению теста с целью оценки физической выносливости пациентов, в том числе, на фоне ферментной заместительной терапии [2].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Тест 6-минутной ходьбы является одним из наиболее простых и доступных способов оценки выносливости и функциональных возможностей пациентов с МПС с кардиологической и легочной патологиями, см. Приложение А3.5.
Исследование проводится обычно с 5 летнего возраста (не реже 2 раз в 12 месяцев). Оценка переносимости физической нагрузки проводится по шкале Борга (Приложение Г1)
- Рекомендован пациентам с МПС II контроль минеральной плотности костей (рентгеноденситометрия) при первичной диагностике и в процессе динамического наблюдения [40,41].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 4).
Комментарии: доказательных данных по оптимальной частоте проведения исследования нет, проводится, в среднем,1 раз в 1-2 года.
- Рекомендуется участие в диагностике и ведении пациентов с МПС II мультидисциплинарной команды специалистов в виду того, что заболевание характеризуется поражением многих органов и систем, требует комплексной терапии, что диктует необходимость совместного ведения пациента специалистами разных профилей [2,5,14,19].
Лечение
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Лечение МПС тип II включает как патогенетическое лечение назначение ФЗТ, так и проведение симптоматической терапии. Ведение пациентов с МПС тип II предполагает мультидисциплинарный подход с участием врача-педиатра, врача- невролога, врача-оториноларинголога, врача-генетика, врача-детского кардиолога, врача-пульмонолога, врача-гастроэнтеролога, врача-стоматолога, врача-челюстно- лицевого хирурга, врача-нейрохирурга, врача-анестезиолога-реаниматолога, врача- физиотерапевта, врача лечебной физкультуры и, при необходимости, врачей других специальностей, имеющих опыт в лечении этого редкого заболевания, а также медицинских психологов.
3.1 Патогенетическое лечение
- Рекомендовано проведение ферментной заместительной терапии (ФЗТ) всем пациентам с МПС II типа после установления точного диагноза с целью замедления прогрессирования заболевания, уменьшения размеров печени и селезенки, улучшения функции сердца, снижения уровня экскретируемых ГАГ [12-15,18].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
Комментарии: Для проведения ФЗТ при МПС II типа применяют идурсульфазу** и идурсульфазу бета**.
Идурсульфаза** — очищенная рекомбинантная форма фермента идуронат-2-сульфатазы, производимая на клеточной линии человека, способная обеспечить профиль гликозилирования, аналогичный природному ферменту.
ФЗТ позволяет значительно улучшить состояние пациентов, добиться уменьшения размеров селезёнки и печени, увеличения показателей функции внешнего дыхания, снижения уровней ГАГ в моче. Препарат не проходит через гематоэнцефалический барьер (ГЭБ), поэтому не позволяет скорригировать неврологические нарушения.
Один из последних анализов международной базы по синдрому Хантера (HOS) убедительно продемонстрировал повышение продолжительности и качества жизни пациентов с МПС II на фоне ФЗТ.
ФЗТ назначается пожизненно, непрерывно в дозе 0,5 мг/кг один раз в неделю в виде внутривенной инфузии продолжительностью 3 ч с максимальной скоростью введения до 40 мл/ч амбулаторно, в условиях круглосуточного/дневного стационара. Весь объем препарата необходимо развести в 100 мл раствора натрия хлорида** 9 мг/мл (0,9%). Время введения можно постепенно уменьшить до 1 часа, если на фоне инфузии не развиваются нежелательные реакции.
Инфузия проводится через периферический или центральный венозный доступ и контролируется медицинским персоналом.
При возникновении аллергических реакций в ответ на инфузию, пациентам могут назначаться антигистаминные средства системного действия и/или низкие дозы кортикостероидов для системного применения, селективные бета2-адреномиметики (для ингаляционного применения) (при указании на аллергические реакции в анамнезе — также с превентивной целью непосредственно перед инфузией), для купирования лихорадки и головной боли -в жаропонижающая терапия (парацетамолом** или ибупрофеном** (препараты также могут назначаться превентивно непосредственно перед инфузией [42]). При возникновений нежелательной реакции инфузию нужно остановить, до разрешения симптомов и затем продолжить инфузию со скоростью на половину меньше той, с которой она проводилась. При развитии анафилактоидной/ анафилактической реакции инфузию следует немедленно прекратить, начать соответствующее лечение и наблюдение. Следует придерживаться современных стандартов неотложной терапии [29,30] и соответствующих клинических рекомендаций, см. Приложение А3.6 и Приложение А3.7
Резкое прекращение ФЗТ, перерывы в ФЗТ не желательны и могут привести к ухудшению состояния пациентов [20].
Тяжелые или опасные для жизни реакции гиперчувствительности в случаях, когда состояние пациентов не поддается контролю, являются противопоказанием для повторного применения препарата (данные из инструкции по медицинскому применению препарата идурсульфаза**, рег. номер ЛСР — 001413/08, одобрена 07.02.2018).
Идурсульфазу бета** получают из рекомбинантных клеток яичников китайского хомячка (CHO), в которые перенесена плазмида, кодирующая белок из 550 аминокислот человеческой идуронат-2-сульфатазы, включая сигнальную последовательность из 25 аминокислот. Этот препарат показан для пациентов старше 6 лет. В 2018 году это новое лекарственное средство было зарегистрировано на территории РФ. В настоящее время существует ограниченное число публикаций, посвященных сравнению эффективности двух препаратов для ФЗТ синдрома Хантера и применению препарата у разных пациентов.
Доказательная база эффективности и безопасности идурсульфазы бета** основана на данных 2-х клинических исследований, в которых приняли участие 37 пациентов с синдромом Хантера. Это исследование I/II фазы NCT01301898 (31 пациент) и исследование III фазы NCT01645189 (6 детей младше 6 лет) [10].
Препараты идурсульфаза** и идурсульфаза бета** производятся на разных линиях клеток, имеют разные МНН и не являются взаимозаменяемыми. Переключение с одного препарата на другой возможно только в случае возникновения неконтролируемых серьезных нежелательных явлений (НЯ), повторяющихся несмотря на адекватную премедикацию перед инфузией. Решение о переводе должно приниматься только по заключению врачебного консилиума Федерального центра.
Введение осуществляется через периферический венозный катетер (катетер периферический) или через порт-систему (порт инфузионный/инъекционный, имплантируемый***), которые устанавливаются согласно методическим руководствам «Венозный доступ, 2019 (https://msestra.ru/download/file.php?id=4763) с использованием необходимых лекарственных средств. Порт-системы устанавливаются согласно Распоряжению Правительства Российской Федерации от 31.12.2018 № 3053-р «Об утверждении перечня медицинских изделий, имплантируемых в организм человека при оказании медицинской помощи в рамках программы государственных гарантий бесплатного оказания гражданам медицинской помощи, а также перечня медицинских изделий, отпускаемых по рецептам на медицинские изделия при предоставлении набора социальных услуг».
Лечение проводится при отсутствии противопоказаний.
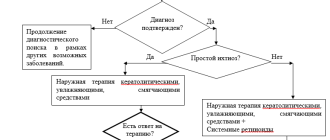
3.2 Симптоматическое лечение
- Рекомендовано проведение медикаментозной премедикации при появлении побочных аллергических реакций при инфузии. [11,12,16,24].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Комментарии: У пациентов с МПС, получающих ФЗТ, как и при в/в введении любого другого белкового препарата, могут развиться побочные реакции (лихорадка, озноб, рвота, крапивница, тяжелые реакций гиперчувствительности аллергического типа), происходящее или во время инфузии или в течение дня проведения инфузии. При появлении побочных реакций вовремя/после инфузии рекомендуется соответствующее лечение, при котором необходимо следовать современным стандартам оказания медицинской помощи (антигистаминными средствами системного действияи/или парацетамол** или ибупрофен** и/или кортикостероиды системного действия (преднизолон** или дексаметазон**)).
- Рекомендовано лечение хронических заболеваний (поведенческих нарушений, офтальмологических нарушений, ортопедической патологии, судорожного синдрома, артериальной гипертензии, сердечной недостаточности, рецидивирующих отитов, частых респираторных заболеваний и др.) у пациентов с МПС II проводить с учетом действующих клинических рекомендаций, принимая во внимание результаты комплексной оценки со стороны всех органов и систем и персонализированные цели пациента [2, 12, 14,16,43].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Лечение поведенческих нарушений проводится врачом-неврологом, обычно используются седативные средства, анксиолитики и другие. Выбор препарата, дозировка, длительность курса определяются индивидуально. Начинают прием данных препаратов под тщательным врачебным контролем в условиях круглосуточного/дневного стационара [2,12,14,16,43]. Противосудорожная терапия требует индивидуального подхода и иногда длительного подбора дозы препарата. Часто необходимо ведение пациента на более низких дозах противоэпилептических препаратов в связи с плохой переносимостью их высоких доз.
- Рекомендовано при офтальмологических нарушениях проводить лечение по показаниям, подбор терапии осуществляется на основании рекомендаций по лечению соответствующих нозологий [2,12,14,16].
- Рекомендуется в качестве ортопедической коррекции нарушения осанки, контрактур суставов с использованием нехирургических методов применять физиопроцедуры и лечебную физкультуру, использовать ортопедические устройства. По показаниям осуществлять хирургическое лечение синдрома карпального канала, проводить эндопротезирование тазобедренного или коленного сустава, корригирующие остеотомии для исправления оси конечностей [2,12,14,16].
- Рекомендовано при рецидивирующих отитах, частых респираторных заболеваниях верхних дыхательных путей проведение симптоматической, антибактериальной терапии по показаниям с терапевтической целью [32].
- Рекомендовано у пациентов с МПС при наличии эпилептических приступов рекомендовано использование препаратов и схем лечения, на основании рекомендаций по лечению эпилепсий [2,12,14,16].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендовано участие мультидисциплинарной команды в ведении сердечной недостаточности у пациентов с МПС II [2,12,14,16].
- Рекомендовано при лечении артериальной гипертензии у пациентов с МПС II назначение антигипертензивной терапии в соответствии с клиническими рекомендациями по артериальной гипертензии [2,12,14,16].
- Рекомендовано пациентам с МПС II c нарушениями моторики желудочно- кишечного тракта (запорами) использование диетических мероприятий, адекватной гидратации и слабительных средств [44].
- Рекомендовано при хронической нейропатической боли назначение препаратов, воздействующих на центральные механизмы формирования хронической боли: противоэпилептических препаратов (доза подбирается индивидуально), антидепрессантов (применяются вне инструкции по решению врачебной комиссии) [45].
3.3 Хирургическое лечение
Хирургическое лечение пациентов с МПС II следует проводить при участии мультидисциплинарной команды в соответствии с действующими клиническими рекомендациями.
- Рекомендована пациентам с нарушением функции кистей или с нарушением нервной проводимости по результатам ЭНМГ операция декомпрессии нервных стволов (Невролиз и декомпрессия нерва, Рассечение спаек и декомпрессия стволов нервных сплетений), которая приводит к быстрому стойкому улучшению функции [2,16,23,25].
Уровень убедительности рекомендации С (уровень достоверности доказательств — 4)
Комментарии: частота рецидивов карпального туннельного синдрома у пациентов с различными типами МПС неизвестна. Поскольку повторная компрессия медианного нерва вследствие рубцевания или отложения гликозаминогликанов возможна, необходимо продолжать наблюдение.
- Рекомендуется пациентам с МПС II типа при сообщающейся гидроцефалии с прогрессирующим увеличением желудочков по данным МРТ и/или, подтверждённым повышением давления церебро-спинальной жидкости более 250- 300 см водного столба вентрикуло-перитонеальное шунтирование [2, 12,14,16,19].
- Рекомендовано проведение хирургического вмешательства для пациентов с диагностированным стенозом шейного отдела — декомпрессии спинного мозга (Декомпрессия позвоночного канала микрохирургическая), что имеет решающее значение в устранении стеноза [2,12,14,16,19,20,25].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Комментарии: сдавление спинного мозга приводит к необратимым неврологическим нарушениям, операцию следует рассматривать даже у пациентов без неврологической симптоматики, если сагиттальный диаметр позвоночного канала сужен более чем на 50%. Хирургическое вмешательство должно выполняться раньше развития неврологических проявлений.
- Рекомендуется проведение хирургической замены тазобедренного или коленного сустава, корригирующие остеотомии костей конечностей при выраженном нарушении функции конечности обусловленной деформацией или артрозом, при отсутствии эффекта от консервативной терапии [2,12,14,16,20,22,23].
- Рекомендовано пациентам с МПС II типа рассмотреть, при наличии показаний, проведение Аденоидэктомии (Аденоидэктомии с использованием видеоэндоскопических технологий) и/или Тонзилэктомии (Тонзиллэктомии с использованием видеоэндоскопических технологий) с целью улучшения проходимости дыхательных путей [2,46,47].
- Рекомендовано пациентам с МПС II с экссудативными отитами рассмотреть постановку тимпаностомической трубки с целью предотвращения развития осложнений [51].
6. Организация оказания медицинской помощи
6.1 Показания для госпитализации в медицинскую организацию:
- проведение диагностики и лечения, требующих круглосуточного медицинского наблюдения;
- состояние, требующее активного лечения и круглосуточного медицинского наблюдения (грыжесечение, оперативное лечение поражения суставов, позвоночника, сколиоз, аденоэктомия, тонзиллэктомия, нейрохирургическая декомпрессия синдрома запястного канала, установка транстимпанического дренажа при среднем отите, хирургическая коррекция патологии ССС и другие);
- отсутствие возможности обеспечения ФЗТ в амбулаторных и стационарозамещающих условиях;
- необходимость проведения различных видов экспертиз или обследования в медицинской организации при невозможности проведения их в амбулаторных условиях, требующих динамического наблюдения (в том числе оформление заключения федерального консилиума);
- решение о замене препарата для проведения ферментозаместительной терапии (идурсульфаза** и идурсульфаза бета**).
- острые заболевания;
- обострения хронических болезней;
- отравления и травмы, состояния, требующие интенсивной терапии и перевода в реанимационные отделения или отделения интенсивной терапии (в том числе побочные реакции, происходящие в процессе инфузии или в течение дня проведения инфузии ФЗТ, цервикальный стеноз с компрессией спинного мозга и другие угрожающие жизни острые состояния), а также круглосуточного медицинского наблюдении и проведения специальных видов обследования и лечения.
- отсутствие угрозы жизни пациента;
- отсутствие угрозы развития осложнений, требующих неотложного лечения;
- стабилизация состояния и основных клинико-лабораторных показателей патологического процесса по основному заболеванию;
- отсутствие необходимости в постоянном врачебном и круглосуточном медицинском наблюдении по основному заболеванию;
- необходимости перевода пациента в другую больницу или учреждение социального обеспечения.
При проведении наркоза и интубации необходимо помнить о высоком риске компрессии спинного мозга вследствие нестабильности атлантоаксиального сустава. Короткая шея, ограничение подвижности нижней челюсти, увеличение языка, выраженная гипертрофия аденоидов и миндалин создают проблемы при проведении анестезиологического пособия, поэтому предпочтение следует отдавать местному или региональному обезболиванию. Пациент предварительно консультируется врачом- детским кардиологом, врачом-оториноларингологом, врачом-анестезиологом- реаниматологом, врачом-неврологом. Обязательно проведение полного кардиологического обследования, полисомнографии (для выявления степени дыхательных нарушений), при необходимости — эндоскопии носоглотки и компьютерной томографии легких. Оперативное вмешательство с анестезией необходимо проводить в крупных медицинских центрах, имеющих отделение реанимации и интенсивной терапии (ОРИТ), так как интубация и последующая экстубация у таких пациентов может вызвать затруднения [2,14,20].
Медицинская реабилитация
4. Медицинская реабилитация, медицинские показания и противопоказания к применению методов реабилитации
Специфической реабилитации пациентам с МПС II не требуется. В круг реабилитационных мероприятий пациентам с МПС II могут быть включены занятия с медицинским психологом, отдых в специализированных санаториях, а также социальная адаптация с участием специалистов и социальных работников, курсы массажа. Специфические методы реабилитации при наличии осложнений указаны в соответствующих разделах.
Профилактика
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
- Рекомендуется после установления диагноза пациенту или его официальным представителям прием (осмотр, консультация) врача-генетика с целью разъяснений генетического риска, обсуждения возможностей пренатальной и преимплантационной генетической диагностики эмбриона [2,16,20].
- у женщины-носительницы мутации риск рождения мальчика с МПС II составляет 50%, риск рождения девочки-носительницы мутации – 50%;
- у мужчины с МПС II риск рождения девочки-носительницы мутации – 100%.
- Рекомендуется в семьях, где есть пациент с установленной мутацией, вызвавшей болезнь, обсудить возможность проведения преимплантационной генетической диагностики эмбриона и пренатальной диагностики путем измерения активности идуронатсульфатазы в клетках ворсин хориона, а также методами прямой или косвенной ДНК-диагностики для семей с известным генотипом [1,2,16,20].
5.2 Диспансерное наблюдение детей с МПС II
Наблюдение пациентов по месту жительства (в амбулаторно-поликлинических условиях) должно осуществляться постоянно. Лабораторные и инструментальные обследования и рекомендуемая частота их проведения представлены в Приложении А3.3. Заболевание имеет мультисистемную природу и необратимые, прогрессирующие клинические проявления, что обусловливает необходимость наблюдения не только узкими специалистами (врачами-оториноларингологами, врачами-детскими хирургами/ врачами-травматологами-ортопедами, врачами-нейрохирургами, врачами-челюстно-лицевыми хирургами, врачами-анестезиологами- реаниматологами, врачами-офтальмологами, врачами-детскими кардиологами, врачами-пульмонологами, врачами-неврологами, врачами-стоматологами), но и врачами-физиотерапевтами, врачами по лечебной физкультуре, логопедами, медицинскими психологами и работниками паллиативных служб [2,14,20].
Пациенты с МПС II должны постоянно находиться под наблюдением, 1 раз в 6 месяцев проходить обследование в многопрофильных стационарах (длительность нахождения в круглосуточном/дневном стационаре 21-28 дней), необходимые осмотры врачей- специалистов, лабораторные и инструментальные обследования.
Информация
Источники и литература
- Клинические рекомендации Союза педиатров России
- 1. Neufeld E., Muenzer J. The mucopolysaccharidoses// In: Scriver CR, Beaudet AL, Sly WS, Valle D, Childs B, Kinzler KW, Vogelstein B, eds. The Metabolic and Molecular Basis of Inherited Disease. 8 ed. New York. NY: McGraw-Hill. 2001. P.3421-52. 2. Scarpa M., Almassy Z., Beck M. et al. Mucopolysaccharidosis type II: European recommendations for the diagnosis and multidisciplinary management of a rare disease// Orphanet J Rare Dis. 2011. V.6. P.72-7. 3. Muenzer J., Jones S.A., Tylki-Szymanska A. et al. Ten years of the Hunter Outcome Survey (HOS): insights, achievements, and lessons learned from a global patient registry// Orphanet J Rare Dis. 2017. V.12. №1. P.82. 4. Meikle P.J., Hopwood J.J., Clague A.E., Carey W.F. Prevalence of lysosomal storage disorders//JAMA. 1999. V.281. P.249–54. 5. Martin R., Beck M., Eng C., Giugliani R., Harmatz P., Mufioz V. et al. Recognition and diagnosis of mucopolysaccharidosis II (Hunter syndrome)// Pediatrics. 2008. V.121. P. 377– 86. 6. Simmons M.A., Bruce I.A., Penney S., Wraith E., Rothera M.P. Otorhinolaryngological manifestations of the mucopolysaccharidoses// Int. J. Pediatr. Otorhinolaryngol. 2005. V. 69. P. 589–95. 7. Biswas J., Nandi K., Sridharan S., Ranjan P. Ocular manifestation of storage diseases// Curr. Opin. Ophthalmol. 2008. V.19. P.507–11. 8. Thappa D. M., Singh A., Jaisankar T. J., Rao R., Ratnakar C. Pebbling of the Skin: A Marker of Hunter»s Syndrome// Pediatric Dermatology.1998. V.15. №5. P.370– 3. 9. Barbier A.J., Bielefeld B., Whiteman D.A. et al. The relationship between anti-idursulfase antibody status and safety and efficacy outcomes in attenuated mucopolysaccharidosis II patients aged 5 years and older treated with intravenous idursulfase// Mol Genet Metab. 2013. V.110. №3. P.303–10. 0. Kim C., Seo J., Chung Y., Ji H.J., Lee J., Sohn J. Comparative study of idursulfase beta and idursulfase in vitro and in vivo// J. Hum. Genet. 2017. V.62. P.167–74. 1. Miebach E. Management of infusion-related reactions to enzyme replacement therapy in a cohort of patients with mucopolysaccharidosis disorders// Int J Clin Pharmacol Ther. 2009. V.47. №1. P.100–6. 2. Wraith J.E., Scarpa M., Beck M. et al. Mucopolysaccharidosis type II (Hunter syndrome): a clinical review and recommendations for treatment in the era of enzyme replacement therapy// Eur J Pediatr. 2008. V.167. P.267-77. 3. Sampayo-Cordero M., Miguel-Huguet B., Pardo-Mateos A. Agreement between results of meta-analyses from case reports and clinical studies, regarding efficacy and safety of idursulfase therapy in patients with mucopolysaccharidosis type II (MPS-II). A new tool for evidence-based medicine in rare diseases// Orphanet J Rare Dis. 2019. V.14. №1. P.230. 4. Bradley L., Haddow H., Palomaki G. Treatment of mucopolysaccharidosis type II (Hunter syndrome): results from a systematic evidence review// Genet Med. 2017. V.19. P.1187– 1201. 5. Da Silva E. M. K. et al. Enzyme replacement therapy with idursulfase for mucopolysaccharidosis type II (Hunter syndrome) //Cochrane Database of Systematic Reviews. 2016. № 2. 6. Giugliani R., Federhen A., Rojas M.V. et al. Mucopolysaccharidosis I, II, and VI: Brief review and guidelines for treatment// Genet Mol Biol. 2010. V.33. №4. P.589–604. 7. Rezende M. M. et al. Brazilian reference values for MPS II screening in dried blood spots— A fluorimetric assay //Clinical biochemistry. 2014. V. 47. № 13-14. P. 1297-9. 8. Human Gene Mutations Database. Qiagen HGMD Professional 9. Okuyama T., Tanaka A., Suzuki Y. et al. Japan Elaprase Treatment (JET) study: idursulfase enzyme replacement therapy in adult patients with attenuated Hunter syndrome (mucopolysaccharidosis II, MPS II)// Mol Genet Metab. 2010. V.99. P.18–25. 0. Guffon N., Heron B., Chabrol B. Diagnosis, quality of life, and treatment of patients with Hunter syndrome in the French healthcare system: a retrospective observational study// Orphanet J Rare Dis. 2015. V.10. P.43. 1. Jurecka A., Zuberuber Z., Opoka-Winiarska V. et al. Effect of rapid cessation of enzyme replacement therapy: a report of 5 cases and a review of the literature// Mol Genet Metab. 2012. V.107. P.508–12. 2. Миронов С.П., Колесов С.В., Переверзев В.С., Колбовский Д.А., Кулешов А.А., Ветрилэ М.С., Казьмин А.И. Опыт хирургического лечения краниовертебрального стеноза у пациентов с мукополисахаридозом I, II, VI типов// Хирургия позвоночника. 2018. Т.15. №4. С.32-40. 3. Williams N., Challoumas D., Eastwood D. M. Does orthopaedic surgery improve quality of life and function in patients with mucopolysaccharidoses? // Journal of Children»s Orthopaedics. 2017. V.11. №4. P.289-97. 4. Miebach E. Management of infusion-related reactions to enzyme replacement therapy in a cohort of patients with mucopolysaccharidosis disorders //International journal of clinical pharmacology and therapeutics. 2009. V. 47. P. S100-6. 5. Mendelsohn N. J., Harmatz P., Bodamer O. et al. Importance of surgical history in diagnosing mucopolysaccharidosis type II (Hunter syndrome): Data from the Hunter Outcome Survey// Genetics in Medicine. 2010. V.12. №12. P.816–22. 6. Remondino R. G. et al. Clinical Manifestations and Surgical Management of Spinal Lesions in Patients With Mucopolysaccharidosis: A Report of 52 Cases //Spine deformity. 2019. V. 7. №. 2. P. 298-303. 7. Kwon JY, Ko K, Sohn YB, et al. High prevalence of carpal tunnel syndrome in children with mucopolysaccharidosis type II (Hunter syndrome). Am J Med Genet A. 2011;155A:1329– 1335 8. ATS statement: Guidelines for the Six-Minute Walk Test. American Journal of Respiratory and Critical Care Medicine. Vol. 166, No.1. Jul 01, 2002. 9. Demoly P, Adkinson NF, Brockow K, Castells M, Chiriac AM, Greenberger PA, Khan DA, Lang DM, Park HS, Pichler W, Sanchez-Borges M, Shiohara T, Thong BY. International Consensus on drug allergy. Allergy. 2014 Apr;69(4):420-37 0. Simons FE, Ebisawa M, Sanchez-Borges M, Thong BY, Worm M, Tanno LK, Lockey RF, El- Gamal YM, Brown SG, Park HS, Sheikh A. 2015 update of the evidence base: World Allergy Organization anaphylaxis guidelines. World Allergy Organ J. 2015 Oct 28;8(1):32. 1. Клинические рекомендации «Анафилактический шок» http://cr.rosminzdrav.ru 2. Bitencourt FH, Vieira TA, Steiner CE, Neto JC, Boy R, Schwartz IVD. Medical Costs Related to Enzyme Replacement Therapy for Mucopolysaccharidosis Types I, II, and VI in Brazil: A Multicenter Study. Value Health Reg Issues. 2015 Dec;8:99-106 3. https://emedicine.medscape.com/article/944723-followup 4. Вашакмадзе Н.Д. Мультидисциплинарные принципы ведения детей с мукополисахаридозами в повышении эффективности их диагностики и лечения : автореферат диссертации доктора медицинских наук: 14.01.08, Екатеринбург, 2019. — 47 с. 5. Franco JFDS, El Dib R, Agarwal A, Soares D, Milhan NVM, Albano LMJ, Kim CA. Mucopolysaccharidosis type I, II and VI and response to enzyme replacement therapy: Results from a single-center case series study. Intractable Rare Dis Res. 2017 Aug;6(3):183-190 6. Keilmann A, Bendel F, Nospes S, Lampe C, Läßig AK. Alterations of mucosa of the larynx and hypopharynx in patients with mucopolysaccharidoses. J Laryngol Otol. 2016 Feb;130(2):194-200 7. Berger KI, Fagondes SC, Giugliani R, Hardy KA, Lee KS, McArdle C, Scarpa M, Tobin MJ, Ward SA, Rapoport DM. Respiratory and sleep disorders in mucopolysaccharidosis. J Inherit Metab Dis. 2013 Mar;36(2):201-10 8. Scarpa M, Lourenço CM, Amartino H. Epilepsy in mucopolysaccharidosis disorders. Mol Genet Metab. 2017 Dec;122S:55-61 9. Taccone A, Tortori Donati P, Marzoli A, Dell»Acqua A, Gatti R, Leone D. Mucopolysaccharidosis: thickening of dura mater at the craniocervical junction and other CT/MRI findings. Pediatr Radiol. 1993;23(5):349-52, Sheridan M, Johnston I. Hydrocephalus and pseudotumour cerebri in the mucopolysaccharidoses. Childs Nerv Syst. 1994 Apr;10(3):148-50 0. Lin HY, Shih SC, Chuang CK, Chen MR, Niu DM, Lin SP. Assessment of bone mineral density by dual energy x-ray absorptiometry in patients with mucopolysaccharidoses. Orphanet J Rare Dis. 2013 May 11;8:71 1. Jiang Z, Byers S, Casal ML, Smith LJ. Failures of Endochondral Ossification in the Mucopolysaccharidoses. Curr Osteoporos Rep. 2020 Dec;18(6):759-773 2. Burton BK, Whiteman DA; HOS Investigators. Incidence and timing of infusion-related reactions in patients with mucopolysaccharidosis type II (Hunter syndrome) on idursulfase therapy in the real-world setting: a perspective from the Hunter Outcome Survey (HOS). Mol Genet Metab. 2011 Jun;103(2):113-20 3. Escolar ML, Jones SA, Shapiro EG, Horovitz DDG, Lampe C, Amartino H. Practical management of behavioral problems in mucopolysaccharidoses disorders. Mol Genet Metab. 2017 Dec;122S:35-40 4. Giugliani R, Villarreal ML, Valdez CA, Hawilou AM, Guelbert N, Garzón LN, Martins AM, Acosta A, Cabello JF, Lemes A, Santos ML, Amartino H. Guidelines for diagnosis and treatment of Hunter Syndrome for clinicians in Latin America. Genet Mol Biol. 2014 Jun;37(2):315-29 5. Congedi S, Orzalesi M, Di Pede C, Benini F. Pain in Mucopolysaccharidoses: Analysis of the Problem and Possible Treatments. Int J Mol Sci. 2018 Oct 8;19(10):3063 6. Venekamp RP, Hearne BJ, Chandrasekharan D, Blackshaw H, Lim J, Schilder AG. Tonsillectomy or adenotonsillectomy versus non-surgical management for obstructive sleep-disordered breathing in children. Cochrane Database Syst Rev. 2015 Oct 14; (10):CD011165 7. Bianchi PM, Gaini R, Vitale S. ENT and mucopolysaccharidoses. Ital J Pediatr. 2018 Nov 16;44(Suppl 2):127 8. Yang L, Shan Y, Wang S, Cai C, Zhang H. Endoscopic assisted adenoidectomy versus conventional curettage adenoidectomy: a meta-analysis of randomized controlled trials. Springerplus. 2016 Apr 11;5:426 9. Harrison R, Schaefer S, Warner L, Mercer J, Jones S, Bruce I. Transnasal adenoidectomy in mucopolysaccharidosis. Int J Pediatr Otorhinolaryngol. 2018 Aug;111:149-152 0. Mitchell RB, Archer SM, Ishman SL, Rosenfeld RM, Coles S, Finestone SA, Friedman NR, Giordano T, Hildrew DM, Kim TW, Lloyd RM, Parikh SR, Shulman ST, Walner DL, Walsh SA, Nnacheta LC. Clinical Practice Guideline: Tonsillectomy in Children (Update). Otolaryngol Head Neck Surg. 2019 Feb;160(1_suppl):S1-S42 1. Murgasova L, Jurovcik M, Jesina P, Malinova V, Bloomfield M, Zeman J, Magner M. Otorhinolaryngological manifestations in 61 patients with mucopolysaccharidosis. Int J Pediatr Otorhinolaryngol. 2020 Aug;135:110137
Информация
АЛТ – аланинаминотрансфераза;
АР – аллергическая реакция;
АСТ – аспартатаминотрансфераза;
ГАГ — гликозаминогликаны;
КТ — компьютерная томография;
МПС — мукополисахаридоз;
МРТ — магнитно-резонансная томография;
ССС — сердечно — сосудистая система;
ТГСК — трансплантация гемопоэтических стволовых клеток;
УЗИ — ультразвуковое исследование;
ФВД — функция внешнего дыхания;
ФЗТ — ферментная заместительная терапия;
ЭКГ — электрокардиография;
ЭНМГ — электронейромиография;
Эхо-КГ — эхокардиография;
ЭЭГ — электроэнцефалография.Критерии оценки качества медицинской помощи
- Баранов Александр Александрович— акад. РАН, профессор, д.м.н.; почетный президент Союза педиатров России, советник руководителя НИИ педиатрии и охраны здоровья детей ЦКБ РАН, главный внештатный специалист педиатр Минздрава России.
- КуцевСергей Иванович — чл.-корр. РАМН, д.м.н., директор ФГБНУ «Медико- генетический научный центр им. академика Н.П.Бочкова «, Президент Ассоциации медицинских генетиков (АМГ).
- Намазова-Баранова Лейла Сеймуровна— акад. РАН, профессор, д.м.н., президент Союза педиатров России; паст-президент EPA/UNEPSA; руководитель НИИ педиатрии и охраны здоровья детей ЦКБ РАН, заведующая кафедрой факультетской педиатрии педиатрического факультета ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России, главный внештатный детский специалист по профилактической медицине Минздрава России
- Байдакова Галина Викторовна— к.б.н., ведущий научный сотрудник лаборатории наследственных болезней обмена ФГБНУ «Медико-генетический научный центр им. академика Н.П.Бочкова».
- Вахлова Ирина Вениаминовна — д.м.н., профессор, заведующая кафедрой госпитальной педиатрии Педиатрического факультета ФГБОУ ВО Уральский Государственный медицинский университет
- Вашакмадзе Нато Джумберовна— д.м.н., доцент кафедры факультетской педиатрии ПФ ФГБОУ ВО РНИМУ имени Н.И. Пирогова МЗ РФ, Институт педиатрии и охраны здоровья детей ЦКБ РАН.
- Воскобоева Елена Юрьевна — к.м.н., в.н.с. лаборатории наследственных болезней обмена ФГБНУ «Медико-генетический научный центр».
- Захарова Екатерина Юрьевна -д.м.н., заведующая лабораторией наследственных болезней обмена ФГБНУ «Медико-генетический научный центр им. академика Н.П.Бочкова», член Российского общества медицинских генетиков, член европейского общества по изучению наследственных болезней обмена веществ (SSIEM).
- Кузенкова Людмила Михайловна— д.м.н., ФГАУ «НМИЦ здоровья детей» Минздрава России, профессор кафедры педиатрии и детской ревматологии ФГАОУ ВО Первый Московский государственный медицинский университет им. И.М. Сеченова Министерства здравоохранения Российской Федерации (Сеченовский Университет)
- Ларионова Валентина Ильинична— д.м.н., ФГБНУ «Институт экспериментальной медицины».
- Лобжанидзе Тина Викторовна— к.м.н., заведующая дневным стационаром и отделением паллиативной медицины ГБУЗ «ГКБ № 64 ДЗМ».
- Михайлова Людмила Константиновна — д.м.н., профессор, ученый секретарь ФГБУ «Национальный медицинский исследовательский центр травматологии и ортопедии имени Н.Н. Приорова» МЗ РФ.
- Михайлова Светлана Витальевна -д.м.н., заведующая отделением РДКБ ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России
- Моисеев Сергей Валентинович— д.м.н., заведующий кафедрой внутренних, профессиональных болезней и ревматологии ФГАОУ ВО Первый МГМУ им. И.М. Сеченова (Сеченовский университет) МЗ РФ.
- Назаренко Людмила Павловна- д.м.н., профессор Заслуженный врач РФ, руководитель лаборатории наследственной патологии НИИ медицинской генетики Томского НИМЦ РАН, член Российского общества медицинских генетиков, член ассоциации медицинских генетиков, член Европейского общества медицинских генетиков.
- Никитин Сергей Сергеевич — д.м.н., профессор, председатель «Общества специалистов по нервно-мышечным заболеваниям».
- Печатникова Наталья Леонидовна — руководитель Центра орфанных и других редких заболеваний ГБУЗ «Морозовская детская городская клиническая больница ДЗМ».
- Полякова Ольга Александровна— врач-травматолог-ортопед, травматолог ФГБУ «Национальный медицинский исследовательский центр травматологии и ортопедии имени Н.Н. Приорова» МЗ РФ.
- Семячкина Алла Николаевна— д.м.н., г.н.с. отделения клинической генетики ОСП НИКИ педиатрии им. академика Ю. Е. Вельтищева ФГАОУ ВО РНИМУ им. Н. И. Пирогова МЗ РФ, член Ассоциации медицинских генетиков (АМГ).
- Удалова Ольга Васильевна— к.м.н., ООО «Медико-генетический центр «Геном»», председатель Нижегородского отделения РОМГ, руководитель Центра медицинской генетики ФГБОУ ВО «ПИМУ» Минздрава России, г. Нижний Новгород.
Приложение А2. Методология разработки клинических рекомендаций
Настоящие рекомендации предназначены для применения медицинскими организациями и учреждениями федеральных, территориальных и муниципальных органов управления здравоохранением, систем обязательного и добровольного медицинского страхования, другими медицинскими организациями различных организационно-правовых форм деятельности, направленной на оказание медицинской помощи.
Мукополисахаридозы относятся к редким наследственным заболеваниям, что исключает возможность проведения больших когортных и рандомизированных контролированных исследований, для создания протоколов диагностики и терапии используются лишь тематические исследования экспертов, опубликованные в последние два десятилетия.
Оценка уровня достоверности доказательств и уровня убедительности рекомендаций применения медицинских технологий проводилась в соответствии с унифицированной шкалой, приведенной в таблицах 1-3.
Целевая аудитория данных клинических рекомендаций:
- Врачи общей практики (семейные врачи);
- Врачи-педиатры;
- Врачи-терапевты;
- Врачи-генетики;
- Врачи-лабораторные генетики;
- Врачи-кардиологи;
- Врачи-детские кардиологи;
- Врачи-неврологи;
- Врачи-травматологи-ортопеды
- Врачи-оториноларингологи
- Врачи-сурдологи-оториноларингологи
- Врачи-рентгенологи;
- Врачи-ревматологи
- Врачи-детские эндокринологи
- Врачи функциональной диагностики;
- Медицинские психологи;
- Врачи-психиатры
- Студенты медицинских ВУЗов;
- Обучающиеся в ординатуре, аспирантуре.
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД Расшифровка 1 Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа 2 Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа 3 Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования 4 Несравнительные исследования, описание клинического случая 5 Имеется лишь обоснование механизма действия или мнение экспертов Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
УДД Расшифровка 1 Систематический обзор РКИ с применением мета-анализа 2 Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа 3 Нерандомизированные сравнительные исследования, в т.ч. когортные исследования 4 Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай- контроль» 5 Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов Таблица 3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
УУР Расшифровка A Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) B Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) C Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) Экономический анализ:
Анализ стоимости не проводился и публикации по фармакоэкономике не анализировались.- Внешняя экспертная оценка;
- Внутренняя экспертная оценка.
Получены комментарии со стороны врачей первичного звена в отношении доходчивости изложения и оценки важности рекомендаций как рабочего инструмента повседневной практики.
Предварительная версия была также направлена рецензенту, не имеющему медицинского образования, для получения комментариев с точки зрения перспектив пациентов.
Комментарии, полученные от экспертов, тщательно систематизировались и обсуждались председателем и членами рабочей группы. Каждый пункт обсуждался, и вносимые в результате этого изменения в рекомендации регистрировались. Если же изменения не вносились, то регистрировались причины отказа от внесения изменений.
Консультация и экспертная оценка:
Проект рекомендаций был рецензирован независимыми экспертами, которых попросили прокомментировать, прежде всего, доходчивость и точность интерпретации доказательной базы, лежащей в основе рекомендаций.Рабочая группа:
Для окончательной редакции и контроля качества рекомендации были повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
- Приказ Министерства здравоохранения РФ «Об утверждении Порядка оказания медицинской помощи больным с врожденными и (или) наследственными заболеваниями» от 15 ноября 2012 г. N 917н).
- Приказ Министерства здравоохранения и социального развития РФ от 16 апреля 2012 г. № 366н «Об утверждении Порядка оказания педиатрической помощи».
- Приказ Минздрава России от 29.12.2018 № 951н Стандарт специализированной медицинской помощи детям при мукополисахаридозе II типа (диагностика и инициация ферментной заместительной терапии).
- Приказ Минздрава России от 29.12.2018 № 950н Стандарт специализированной медицинской помощи детям при мукополисахаридозе II типа (ферментная заместительная терапия).
- Приказ Минздрава России от 29.12.2018 № 952н Стандарт первичной медико- санитарной помощи детям при мукополисахаридозе II типа (ферментная заместительная терапия).
- Информация о лекарственных препаратах: Государственный реестр лекарственных средств: https://grls.rosminzdrav.ru.
- Федеральный закон от 21 ноября 2011 г. № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации» (Собрание законодательства Российской Федерации, 2011 г., № 48, ст. 6724).
- Международная классификация болезней, травм и состояний, влияющих на здоровье (МКБ – 10).
- Приказ МЗ РФ от 20 декабря 2012г. № 1183н «Об утверждении номенклатуры должностей медицинских работников и фармацевтических работников».
- Приказ МЗ РФ от 23 июля 2010 г. № 541н. Единый квалификационный справочник должностей руководителей, специалистов и служащих, раздел Квалификационные характеристики должностей работников в сфере здравоохранения.
- Федеральный закон от 25.12.2018 № 489 489-ФЗ «О внесении изменений в статью 40 Федерального закона «Об обязательном медицинском страховании в Российской Федерации» и Федеральный закон «Об основах охраны здоровья граждан в Российской Федерации» по вопросам клинических рекомендаций».
- Приказ Минздрава России № 103н от 28.02.2019 г. «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации».
- Приказ Минздрава России от 13.10.2017 N 804н «Об утверждении номенклатуры медицинских услуг».
- Приказ Министерства труда и социальной защиты РФ от 27 августа 2019 г. n 585н «О классификациях и критериях, используемых при осуществлении медико- социальной экспертизы граждан федеральными государственными учреждениями медико-социальной экспертизы» (вступает в силу с 1 января 2020 года).
- Приказ Министерства здравоохранения РФ от 14 января 2019 г. № 4н «Об утверждении порядка назначения лекарственных препаратов, форм рецептурных бланков на лекарственные препараты, порядка оформления указанных бланков, их учета и хранения».
- Приказ Министерство здравоохранения и социального развития Российской Федерации «О порядке применения лекарственных средств у больных по жизненным показаниям» от 9 августа 2005 г. № 494.
- Информационное письмо Минздрава России по возможности закупки лекарственного препарата по торговому наименованию (https://www.rosminzdrav.ru/news/2019/12/18/13043-minzdrav-podgotovil- informatsionnoe-pismo-po-vozmozhnosti-zakupki-lekarstvennogo-preparata-po- torgovomu-naimenovaniyu).
- Федеральный закон «О внесении изменений в Федеральный закон «Об основах охраны здоровья граждан в Российской Федерации» по вопросам оказания паллиативной медицинской помощи» от 06.03.2019 № 18-ФЗ.
- Приказ Минздрава России № 345н, Минтруда России от 31.05.2019 № 372н «Об утверждении положения об организации оказания паллиативной медицинской помощи, включая порядок взаимодействия медицинских организаций, организаций социального обслуживания и общественных объединений, иных некоммерческих организаций, осуществляющих свою деятельность в сфере охраны здоровья».
- Приказ Минздрава России № 348н от 31 мая 2019 года «Об утверждении перечня медицинских изделий, предназначенных для поддержания органов и систем организма человека, предоставляемых для использования на дому».
- Приказ Минздрава России № 505н от 10 июля 2019 года «Об утверждении Порядка передачи от медицинской организации пациенту (его законному представителю) медицинских изделий, предназначенных для поддержания функций органов и систем организма человека, для использования на дому при оказании паллиативной медицинской помощи».
- Приказ МЗ РФ № 831 от 3 октября 2019 года «Об утверждении ведомственной целевой программы «Развитие системы оказания паллиативной медицинской помощи».

Приложение А3.2 Выраженность клинических проявлений МПС II в разном возрасте


Приложение А3.3 Частота проведения обследования у пациентов с МПС II типа


— Для детей старше 5 лет; расстояние, пройденное за 6 минут (предпочтительным является тот же промежуток времени, что и в предыдущих тестах этого пациента); число ступеней, пройденных вверх за 3 минуты. Оцениваются показатели сатурации SpO2, ЧДД, ЧСС до и после нагрузки.
2 — DQ или Коэффициент умственного развития (КУР) — способ сравнения интеллектуального развития, свойственного данному возрасту (умственных способностей ребенка по отношению к его сверстникам), с хронологическим возрастом (фактическим возрастом ребенка).
КУР рассчитывается делением интеллектуального возраста на хронологический и умножением на 100 для получения целого числа. Средний коэффициент умственного развития для любого возраста считается равным 100.
Приложение А3.4 Забор биоматериала для диагностики в пятнах крови


- вымыть руки (гигиенический уровень), надеть перчатки;
- вымыть руки пациента (пятку ребенка, в случае, если кровь берется из пятки);
- протереть область прокалывания стерильной салфеткой, смоченной 70% спиртом, промокнуть сухой стерильной салфеткой; — проколоть стерильным одноразовым скарификатором;
- снять первую каплю крови стерильным сухим тампоном;
- мягко надавить для получения второй капли крови;
- приложить перпендикулярно тест-бланк к капле крови и пропитать его кровью насквозь;
- аналогичным образом нанести на тест-бланк 6-8 капель, вид пятен крови должен быть одинаковым с обеих сторон.
- высушить тест-бланк в горизонтальном положении на чистой обезжиренной поверхности не менее 4 ч без применения тепловой обработки и попадания прямых солнечных лучей;
- упаковать тест-бланки в чистый конверт таким образом, чтобы пятна крови не соприкасались.
Особенности при инфузионной терапии
Некоторые пациенты могут получать инфузионную терапию, переливание компонентов крови, что может оказать влияние на результаты тестов. Например, при переливании плазмы крови могут быть получены ложно-отрицательные результаты, так как определяемые ферменты находятся в плазме и в клетках крови. Рекомендуется осуществить забор крови для ферментной и ДНК-диагностики не ранее чем через 6-7 дней после переливания плазмы крови и через 7-10 дней после переливания компонентов крови.
- сразу после проведения пациенту инфузионной терапии;
- сразу после заменного переливания крови.
Хранение и транспортировка биоматериала
Образцы высушенных пятен крови можно хранить в обычной камере холодильника при +4 С до отправки. Срок хранения до момента отправки не должен превышать 7 дней. Если хранить дольше и при более высокой температуре, то активность фермента даже в норме может снижаться, что приведет к ложно-положительным результатам.
Приложение А3.5 Тест 6 минутной ходьбы (6МТХ)[28]
Следует помнить, что для теста 6-минутной ходьбы имеются следующие абсолютные противопоказания: острая боль в грудной клетке, декомпенсированная сердечная и дыхательная недостаточность, острые заболевания, лихорадка, заболевания опорно- двигательного аппарата, препятствующие выполнению пробы.
К относительным противопоказаниям можно отнести выраженную брадитахикардию, высокую артериальную гипертензию и возраст ребенка. Малышам трудно осознать и исполнить все правила теста, поэтому он рекомендован для детей от 5 лет и старше.
Если пациент находится на постоянной кислородной поддержке, скорость подачи кислорода при проведении теста должна сохраняться в соответствии с предписанием врача, назначившего и контролирующего терапию.
Проведение теста необходимо немедленно прекратить в случае возникновения боли в груди, сильной одышки, судорог в ногах, головокружения, потери устойчивости, нарастающей слабости и явной бледности.
6MТХ проводится в помещении, хорошо знакомом пациенту, имеющем достаточно длинный коридор с твердым покрытием. Длина проходимого пути должна составлять не менее 30 метров с разметкой каждые 5-10 метров, а также точками поворотов/ разворотов. На обоих концах пути нужно разметить кресла для подготовки и отдыха пациентов. Кроме того, необходимо позаботиться о наличии источника кислорода и дефибриллятора.
Также для теста вам понадобится тонометр, часы с секундной стрелкой, пульсоксиметр и телефон. Тест рекомендуется проводить в утренние часы после легкого завтрака. На пациенте должна быть удобная одежда и подходящая для прогулки обувь. Запрещены интенсивные физические нагрузки менее чем за два часа до испытания. Лечение пациента проходит в обычном режиме. Если в повседневной жизни ребёнок использует для ходьбы трость, костыли или ходунки, следует оставить их и для теста. Перед началом пробы пациенту необходимо измерить артериальное давление, частоту сердечных сокращений, частоту дыхания, провести пульсоксиметрию.
Тест 6-минутной ходьбы заключается в том, что ребёнок должен за 6 минут пройти максимально возможное для себя расстояние на треке в комфортном для себя темпе. Запрещается переходить на бег или прыжки, но можно замедлиться или остановиться, если возникает такая потребность.
Приложение А3.6 Основные мероприятия при оказании помощи пациентам с аллергической реакцией на препарат [29]
Аллергическая реакция (АР) Остановить инфузию Оценить степень аллергической реакции Легкая АР: лихорадка, покраснение, сыпь, легкая крапивница. Тяжелая АР: выраженная крапивница, отек лица, затрудненное дыхание, проявления сердечной недостаточности и др. ибупрофен или парацетамол**, антигистаминные средства системного действияв возрастной дозировке ибупрофен или парацетамол**, антигистаминные средства системного действия, кортикостероиды системного действия (1-2 мг/кг/сут по преднизолону**), если возникнет необходимость – эпинефрин**. 1 Наблюдение за пациентом Продолжается реакция на введение Нет реакции на введение Остановить инфузию и не возобновлять в этот день Продолжить инфузию на небольшой скорости Следующую инфузию проводить на небольшой скорости после премедикации (повторить предыдущую схему). 1 Основные мероприятия при оказании помощи пациентам с анафилактической реакцией см. Приложение А3.7
Приложение А3.7 Основные мероприятия при оказании помощи пациентам с анафилактической реакцией [30,31]
1 Прекратите внутривенное введение терапевтического лекарственного средства, которое вызывает анафилаксию или, если пациент начал отмечать изменения в общем самочувствии 2 Оцените кровообращение пациента (пульс), проходимость дыхательных путей (частоту дыхания), психическое состояние, уровень сознания, артериальное давление, наличие кожных проявлений, уточните массу тела 3 Введите эпинефрин** внутримышечно в передне-боковую поверхность бедра), 0,01 мг/кг (максимум 0,3 мг детям 6-12 лет; 0,15 мг детям до 6 лет). Запишите время, введенную дозу и, при необходимости, повторите через 5-15 мин. Большинству пациентов необходимо 1-2 дозы эпинефрина**.
Не рекомендуется введение в одно место 1 мл и более эпинефрина**, так как, обладая большим сосудосуживающим действием, он тормозит и собственное всасывание.4 Положите пациента на спину если имеется респираторный дистресс и/или рвота; поднимите нижние конечности (пациент не должен стоять, сидеть или двигаться, поскольку это может привести к внезапной смерти в случаях тяжелой анафилактоидной реакции). Запрокиньте и повернуть в сторону голову, выведите вперед и вверх нижнюю челюсть, приоткройте рот, зафиксируйте язык, удалите слизь из верхних дыхательных путей, если в этом появилась необходимость. 5 При показаниях дайте дополнительно кислород (6-8 л/мин) через маску или орофарингеальную трубку (Воздуховод орофарингеальный) ВАЖНО Бета — адреноблокаторы уменьшают терапевтический эффект эпинефрина**. Усиливают побочные эффекты эпинефрина** симпатомиметики, дигоксин**. Приложение А3.8 Расшифровка примечаний
** – препарат входит в перечень жизненно необходимых и важнейших лекарственных препаратов (Распоряжение Правительства РФ от 12.10.2019 № 2406-р) «Об утверждении перечня жизненно необходимых и важнейших лекарственных препаратов на 2020 год, а также перечней лекарственных препаратов для медицинского применения и минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи») (с изменениями, внесенными Распоряжением Правительства РФ от 23 ноября 2020 г. № 3073-р «О внесении изменений в распоряжение Правительства РФ от 12 октября 2019 г. № 2406-р.)
# — применение off-label – вне зарегистрированных в инструкции лекарственного средства показаний осуществляется по решению врачебной комиссии, с разрешения Локального этического комитета медицинской организации (при наличии), с условием подписанного информированного согласия родителей (законного представителя) и пациента в возрасте старше 15 лет;
*** — медицинское изделие, имплантируемое в организм человека при оказании медицинской помощи в рамках программы государственных гарантий бесплатного оказания гражданам медицинской помощи.
Приложение Б. Алгоритмы действий врача

Приложение В. Информация для пациента
Синдром Хантера
Синдром Хантера или мукополисахаридоз II (МПС II) — одна из самых частых форм мукополисахаридозов (МПС). Впервые заболевание было описано канадским врачом Чарльзом Хантером в 1917 году у двоих братьев. МПС II является очень многоликим заболеванием, включающим как очень тяжелые, так и более легкие формы болезни.
К сожалению, вылечить данное заболевание невозможно, но существует множество подходов поддерживающей терапии, позволяющих существенно улучшить качество жизни пациентов. С 2006 года получил применение препарат, который позволяет замедлить прогрессирование болезни, смягчить некоторые из его проявлений. Помимо препарата необходимо не забывать, о симптоматической терапии, физиотерапии, реабилитации и позитивном отношении к жизни членов семьи.
При всех мукополисахаридозах нарушается обмен (расщепление) гликозаминогликанов (ГАГ) – особых структурных компонентов соединительной ткани. ГАГ- это длинные цепочки молекул сахара, которые соединяются с белками и служат важным строительным материалом для костей, хрящей, кожи, сухожилий, клапанов сердца и многих других тканей. ГАГ содержатся в вязкой синовиальной жидкости, которая увлажняет суставы, входят в состав суставов и сухожилий, клапанов сердца. В норме происходит постоянный процесс образования «новых» ГАГ и расщепления «старых». Для процесса расщепления и переработки ГАГ необходима группа особых белков-ферментов. Для того чтобы расщепить ГАГ ферменты работают по очереди, друг за другом и расщепляют длинную молекулу ГАГ на части. У пациентов с МПС отсутствует фермент (особый для каждого типа МПС), который необходим для расщепления определенного ГАГ.
У пациентов с МПС II типа происходит нарушение работы особого фермента, называемого идуронат-2-сульфатаза, который необходим для расщепления двух ГАГ – дерматансульфата и гепарансульфата в особых структурах клеток — лизосомах. При МПС II фермент либо полностью отсутствует, либо снижена его активность.
Нерасщепленные дерматансульфат и гепарансульфат сами по себе не токсичны, но постепенно накапливаясь в клетках, вызывают нарушения их работы.
Тяжесть заболевания определяется степенью активности фермента идуронат- сульфатазы. Исследования показали, что при более легких формах болезни, активный фермент присутствует в организме в небольшом количестве. К сожалению в настоящее время нет способа спрогнозировать, тяжелой или легкой будет болезнь. Форма заболевания устанавливается клинически врачом по совокупности симптомов и скорости прогрессирования заболевания.
МПС II очень редкое заболевание. По оценкам специалистов его частота приблизительно 1:140 000 — 1:156 000 живых ворожденных.
Наследование синдрома Хантера
Синдром Хантера имеет рецессивный Х-сцепленный тип наследования. Это означает, что ген заболевания находится на Х-хромосоме. Чтобы понять, как заболевание наследуется, необходимо пояснить основные понятия генетики. У каждого человека имеется двойной набор генов, один из которых он получает от матери, другой — от отца. Х и Y хромосомы определяют пол человека. Мужчины имеют одну Х хромосому, полученную от матери и одну Y хромосому от отца. У женщин в наличии две Х хромосомы, унаследованные от матери и от отца. Таким образом, МПС II болеют только мальчики, а девочки за исключением редких казуистических случаев не имеют симптомы заболевания. Если женщина является носителем МПС II, то существует 50%- ный риск, что она передаст заболевание своему сыну вместе с геном МПС II, находящемся на Х-хромосоме. Однако, если ребенок получит «здоровую» Х-хромосому, заболевания не возникнет. Также существует 50 % вероятность, что дочь женщины- носительницы тоже будет носителем заболевания и в будущем сможет передать болезнь внуку. Носителями заболевания также могут быть и сестры матери, поэтому очень важно уточнить является ли мать ребенка носителем болезни и при необходимости — обследовать родственниц женского пола в семье матери.
В случае подтверждения носительства заболевания возможно проведение пренатальной диагностики – т.е. определение на ранних сроках беременности будет ребенок болен или здоров.
Следует также отметить, что мать ребенка с МПС II в ряде случаев может не являться носителем заболевания и риск повторного рождения в семье больного ребенка минимальный.
Для определения носительства МПС II используется ДНК-анализ. Определение активности фермента не всегда является достоверным методом.
Все семьи с МПС II должны обязательно пройти медико-генетическое консультирование и получить полную информацию от врача-генетика о риске повторного проявления данного заболевания в семье или обсудить другие вопросы, связанные с наследованием заболевания. В России медико-генетические консультации работают в каждом регионе.
Как устанавливают диагноз?
Врачи на основании клинических симптомов могут заподозрить болезнь. Затем проводятся лабораторные тесты и инструментальное исследование. Поскольку разные типы МПС очень похожи по своим клиническим проявлениям, необходимо подтвердить диагноз с помощью лабораторных методов. На первом этапе проводится определение уровня экскреции ГАГ в моче, который выше у пациентов с МПС, чем у здоровых людей. Вторым этапом проводится измерение активности фермента идуронат-сульфатазы в клетках крови, пятнах высушенной крови или культуре кожных фибробластов. В дальнейшем рекомендуется проведение ДНК диагностики (если активность фермента была снижена) у ребенка, а затем у матери, для уточнения является ли она носителем болезни.
Клинические проявления синдрома Хантера
Степень выраженности клинических проявлений при синдроме Хантера различна. Известны крайне тяжелые формы заболевания, которые проявляются уже в раннем детстве, и довольно легкие, мягкие формы болезни. В некоторых случаях наличие синдрома Хантера не влияет на продолжительность жизни пациента, но качество жизни, безусловно, страдает при всех формах болезни.
Основная задача врачей, близких и самого пациента сделать жизнь при синдроме Хантера максимально комфортной, снизить риск тяжелых осложнений, замедлить прогрессирование болезни, смягчить основные симптомы заболевания.
Далее описаны возможные проблемы, которые могут возникнуть у пациентов с синдромом Хантера. Однако с учетом большой вариабельности клинических проявлений, они могут встречаться далеко не у каждого пациента даже в одной семье.
Необходимо понимать, что синдром Хантера – прогрессирующее мультисистемное заболевание и проблемы пациентов не ограничиваются поражением скелета и суставов — страдает нервная система, орган зрения, слуха, сердечно-сосудистая и бронхо-легочная системы.
Раннее развитие, рост
Дети с тяжелыми формами синдромом Хантера как правило рождаются крупными и до 2 лет прибавляют в росте и весе быстрее, чем обычные дети. В более старшем возрасте прибавка весо-ростовых показателей приостанавливается, и пациенты с МПС II имеют более низкий по сравнению со здоровыми сверстниками рост. При более легких формах рост может быть в норме.
Умственное развитие
Умственное развитие детей с синдромом Хантера зависит от формы заболевания. При тяжелом течении болезни вследствие накопления гликозаминогликанов (ГАГов) в головном мозге в возрасте от 2 до 4 лет постепенно отмечается задержка психоречевого развития, а в последствии дети теряют ранее приобретенные навыки. Степень интеллектуального дефицита варьирует у различных пациентов: некоторые мальчики с синдромом Хантера способны произнести лишь несколько слов, другие могут говорить развернутыми предложениями, читать и рассказывать стихи. Многие родители отмечают, что очень важно заниматься с ребенком как можно больше, особенно в раннем возрасте, до того, как болезнь затронула интеллектуальные функции. Даже после утраты речи дети сохраняют способность к эмоциональным переживаниям, способны понимать своих близких, испытывать радость и огорчение.
У пациентов с легкой формой синдрома Хантера интеллект может быть в пределах нормы. Некоторые взрослые пациенты имеют высшее образование и высокий социальный статус.
Внешние особенности
Внешний вид пациентов с тяжелой формой синдрома Хантера необычен и они больше похожи друг на друга, чем на своих родителей и здоровых братьев и сестер. Изменения строения лица обозначают специальным термином лицевой дизморфизм, или огрубление черт лица. У пациентов крупная голова, короткая шея, круглое лицо, широкий нос с широкой переносицей. Это в большей степени характерно для тяжелой формы болезни. При легкой и промежуточной форме заболевания особенности внешнего вида столь незначительны, что могут быть видимы только врачам, а близкие и знакомые могут их совершенно не замечать.
При МПС II кожа толстая и жесткая, что затрудняет забор крови и использование внутривенных катетеров.
Скелет, опорно-двигательная и костно-суставная система
При МПС II типа, как и при всех других формах мукополисахаридозов, существуют проблемы с формированием и ростом костей. Поражение многих костей, с изменением их формы называют множественным дизостозом. При тяжелой форме синдрома Хантера изменяется строение позвонков. Один или два позвонка в середине спины иногда бывают уплощены больше, чем остальные, и слегка смещены. Такое смещение позвонков может быть причиной искривления позвоночника (кифоз, сколиоз). Обычно при данном заболевании искривление позвоночника небольшое и редко нуждается в хирургическом лечении. Если искривление позвоночника или сколиоз прогрессирует, то требуется оперативное лечение.
Самые серьезные, опасные и жизнеугрожающие проблемы связаны с деформацией и особенностями строения шейного отдела. Если спинной мозг будет сдавлен или поврежден (шейная миелопатия), нарушается иннервация всех частей тела, что приведет к слабости конечностей (парезы), нарушениям ходьбы, контроля над тазовыми функциями (мочеиспускание и дефекация), а иногда даже дыхания.
Тугоподвижность суставов характерна для всех форм мукополисахаридозов. С годами тугоподвижность суставов может прогрессировать и стать причиной болей. Из-за ограничения подвижности суставов и особенностей строения мелких костей кисти, пальцы рук становятся жесткими и искривляются, формируя так называемую «когтистую кисть». Из-за тугоподвижности крупных суставов и особенностей строения костей пациенты ходят со слегка согнутыми коленями и бедрами. У некоторых пациентов развивается Х-образное искривление нижних конечностей (вальгусная деформация). Большинство врачей считают, что данная деформация носит приспособительный характер, помогая пациенту распределять вес, поэтому оперативную коррекцию в раннем возрасте лучше не проводить. Кроме того, в связи со слабостью связочного аппарата и нарушением структуры костей, операция может быть неэффективной, и деформация через некоторое время вновь вернется.
В ряде случаев возникает поражение головок бедренных костей (асептический некроз), что может приводить к болевому синдрому и изменению походки по типу «утиной».
Органы дыхания
Нарушение дыхательной системы у пациентов с МПС связано как с особенностями строения скелета, хрящей трахеи и ребер, так и с накоплением ГАГ в мягких тканях (увеличиваются аденоиды, слизистые, выстилающие дыхательные пути становятся рыхлыми, гипертрофированными, в результате чего просвет дыхательных путей уменьшается).
Трахея у пациентов с МПС более гибкая и мягкая, из-за неправильного строения образующих ее хрящевых колец, кроме того, она сужается из-за скопления слизи. Процесс дыхания у пациентов с МПС нарушен. Важно понимать, что недостаточное снабжение тканей кислородом (гипоксия) влияет на функцию всех органов, поэтому улучшение дыхательной функции – одна из первоочередных задач.
Проблемы с дыханием усугубляет измененное строение грудной клетки: вследствие нарушения сочленения между ребрами и грудиной грудная клетка «жесткая» и не может двигаться свободно, не позволяя легким набрать большой объем воздуха. Проблема усугубляется еще и тем, что увеличенные печень и селезенка «поджимают» диафрагму и затрудняют нормальную экскурсию легких. Эти особенности приводят к тому, что пациенты хуже переносят инфекции верхних дыхательных путей и легких.
Первыми симптомами нарушений функции верхних дыхательных путей могут служить ночной храп, шумное дыхание, обструктивное ночное апное (кратковременные, до нескольких секунд задержки дыхания во время ночного сна). Такие проявления должны настораживать, так как в дальнейшем могут прогрессировать и приводить к развитию осложнений со стороны других органов (сердце, головной мозг).
Пациенты с МПС склонны к развитию отитов, ринитов и воспалению легких, поэтому антибактериальную терапию следует начинать уже на ранних стадиях заболевания. Несомненно, нужно консультироваться со специалистами, а не заниматься самолечением.
Несмотря на редкость и тяжесть заболевания, следует помнить, что вакцинация пациентам с МПС обязательна, так как помогает предотвратить развитие заболеваний, поражающих легкие, в том числе важно не пропустить вакцинацию против пневмококковой инфекции.
Ротовая полость и зубы
У пациентов с МПС II зубы покрыты хрупкой эмалью, что приводит к быстрому развитию кариеса. Очень важно тщательно ухаживать за зубами и регулярно их чистить.
Сердечно-сосудистая система
Практически у всех пациентов с МПС II наблюдаются изменения со стороны клапанного аппарата (уплотнение створок и хорд клапанов).
При осмотре пациентов с синдромом Хантера врач может обратить внимание на наличие «шумов» в сердце. Как правило, это связано с поражением клапанов: поврежденный клапан закрывается неплотно, при сокращении сердца небольшое количество крови двигается в обратном направлении, что и вызывает шум, который слышит врач. Чаще всего поражаются аортальный и митральный клапаны.
Поражение легких, о котором написано выше, также может стать причиной изменений со стороны сердца. «Прокачивание» крови через измененные легкие, приводит к перегрузке правых отделов сердца и развивается правосторонняя сердечная недостаточность.
При тяжелой форме синдрома Хантера вследствие накопления гликозаминогликанов непосредственно в сердечной мышце может развиться кардиомиопатия.
Брюшная полость
При синдроме Хантера печень и селезенка увеличены из-за накопления ГАГ (гепатоспленомегалия). Увеличение печени обычно не приводит к нарушению ее функции, но может влиять на переносимость той или иной пищи, а также усугублять дыхательные проблемы.
При мукополисахаридозах, как правило, живот увеличен в объеме за счет гепатоспленомегалии и слабости прямых мышц живота. Также часто возникают сочетанные или изолированные грыжи (пупочная, паховая, пахово-мошоночной и средней линии живота). Как правило, планового оперативного лечения требуют паховые грыжи, однако грыжи могут возникнуть вновь. Пупочные грыжи небольших размеров обычно не требуют оперативного лечения. Решение о необходимости операции должно приниматься совместно с лечащим врачом, показанием к срочной операции служит ущемление грыжевого выпячивания.
У пациентов с МПС II нередко наблюдается неустойчивый стул (запоры или диарея). Причина этого до конца непонятна. Возможно, нарушается функция вегетативной нервной системы, поскольку ГАГ накапливаются в нервных клетках кишечника. Диарея может исчезать с возрастом, но во время приема антибиотиков может появляться вновь. Если диарея возникла из-за приема антибиотиков, врачи могут назначить препараты для восстановления микрофлоры кишечника. Если пациент мало двигается, то могут развиться запоры. В этом случае эффективно увеличение в рационе количества грубой пищи (клетчатки).
Нервная система
Задержка и регресс психомоторного развития при МПС II связаны с непосредственным накоплением ГАГ в клетках мозга. Также свою лепту вносят неадекватная вентиляция и гипоксия головного мозга, повышение внутричерепного давления вследствие гидроцефалии, нарушение познавательных способностей вследствие снижения зрения и слуха. Грозным осложнением при тяжелых формах МПС II является нарушение циркуляции спинномозговой жидкости c развитием гидроцефалии. В этом случае пациенты жалуются на головные боли, у детей обращают на себя внимание беспокойство, рвота, задержка развития. Необходима консультация врача- нейрохирурга для решения вопроса о необходимости оперативного или медикаментозного лечении данного осложнения.
Если возникают подозрения на гидроцефалию, то необходимо провести компьютерную томографию или МРТ. Осмотра глазного дна окулистом недостаточно для постановки диагноза, т.к. гидроцефалия у детей с МПС II может протекать и без застойных изменений на глазном дне.
Оперативное лечение гидроцефалии заключается в том, что в желудочки головного мозга вводят тонкую трубку (шунт), которая откачивает лишнюю жидкость в брюшную полость. У такого шунта есть чувствительный к давлению клапан, который позволяет откачивать цереброспинальную жидкость, когда давление спинномозговой жидкости становится слишком высоким.
Не менее грозным осложнением МПС является сдавление спинного мозга в позвоночном канале из-за утолщения оболочек спинного мозга с нестабильностью позвонков, чаще в верхнешейном отделе. Сдавление приводит к тяжелым неврологическим осложнениям, часто необратимым – нарушение походки, ограничение движений конечностями, теряется контроль над мочеиспусканием и дефекацией, нарушается дыхание. Раннее хирургическое вмешательство имеет решающее значение в устранении стеноза.
Еще одним осложнением со стороны нервной системы может быть карпальный синдром (запястный синдром, туннельный синдром) – распространенная проблема у пациентов с МПС. Нервы проходят через запястье между запястными костями и связками. Утолщение связок за счет накопления ГАГ оказывает давление на нервы. Проявлением этого синдрома могут быть боль и онемение пальцев рук и трудности c захватом предметов.
Для диагностики измеряют скорость проведения нервного импульса в области кисти. Это простая процедура, позволяющая установить наличие или отсутствие повреждения нервов.
Некоторые нарушения нервной системы (двигательные расстройства) являются вторичными и в большей степени связаны с поражением скелета.
Орган зрения
Накопление ГАГ происходит во многих тканях, в том числе и в роговице, поэтому может наблюдаться ее помутнение. Одним из признаков изменения роговицы является непереносимость яркого света, так как помутнение вызывает неправильное преломление света. В этом случае могут помочь солнечные очки. Если помутнение роговицы тяжелое — ухудшается зрение, особенно при тусклом свете.
Отложение ГАГ в сетчатке может привести к потере периферического зрения и никталопии («куриной слепоте»). Ребенок может пугаться и отказываться ходить в темное время суток. Желательно оставлять ночник включенным в спальне и коридоре. Иногда могут возникать проблемы со зрением, вызванные изменениями в сетчатке глаза или глаукомой (повышенным внутриглазным давлением), поэтому регулярные осмотры врача-офтальмолога необходимы. С помощью специальных исследований врач-офтальмолог поможет определить, из-за чего происходит ухудшение зрения.
Орган слуха
При мукополисахаридозах тугоухость может быть нейросенсорная (связанная с нарушением чувствительных (волосковых) клеток в улитке), кондуктивная (связанная с нарушением звукопроводящих путей) или смешанная (комбинация двух типов). При синдроме Хантера тугоухость, чаще носит смешанный характер и прогрессирует с возрастом. Различают 3 степени тугоухости – легкую, умеренную и тяжелую. В зависимости от типа и тяжести поражения слуха применяют различные подходы к коррекции. Крайне важно, как можно раньше заметить признаки снижения слуха, так как без коррекции тугоухость мешает нормальному развитию и обучению пациентов. Фактором, усугубляющим нарушение слуха, являются частые инфекции среднего уха (отиты).
Лечение, наблюдение и плановые обследования
Врачами-экспертами из разных стран были созданы рекомендации по наблюдению, диагностике и лечению пациентов с МПС II типа. В данном разделе мы кратко расскажем о них.
Наблюдение, плановые обследования и тесты
Для того, чтобы оценивать состояние пациента, эффект проводимой ферментной терапии, физиотерапии существуют различные тесты и шкалы. Очень важно не отказываться от проведения этих исследований, потому что они помогают врачам объективно оценивать состояние пациента, обосновать лечение или ввести изменения в программы реабилитации и абилитации.
Самым известным является 6 минутный тест ходьбы. Суть этого теста очень простая — оценить выносливость пациента. Пациенту предлагают ходить по длинному коридору 6 минут. Тест оценивается количеством пройденных шагов за это время. Когда проводили первые клинические испытания препарата для лечения МПС разных типов, исследователи оценивали этот показатель до и после начала ферментной терапии и сравнивали с группой пациентов, получавших плацебо. Именно этот тест показал, что ферментная заместительная терапия улучшает выносливость пациентов и их двигательную активность.
Чтобы оценить степень ограничения дыхания, врач может провести легочные функциональные тесты. Легочные функциональные тесты определяют, какой максимальный объем воздуха может вдохнуть пациент, и насколько быстро происходит газообмен. Эти тесты могут выявить заболевания легких, определить степень поражения и оценить эффективность лечения. Тесты обычно выполняются с использованием специального оборудования. Во время исследования нужно по команде вдыхать, задерживать воздух, выдыхать. Исследование функции легких не представляет риска здоровью.
Выслушивание (аускультация) сердца должно быть обязательным и регулярным исследованием для пациентов с мукополисахаридозами. Важным методом изучения сердца является ультразвуковой – эхокардиография (Эхо-КГ), которая безопасна, безболезненна и высокоинформативна. Современные приборы позволяют получить одно-, двух- и трехмерное изображение сердца, определить скорость кровотока и давление в различных его отделах, определить направление и турбулентный характер кровотока. Эхо-КГ рекомендуют проводить по показаниям, но не реже 1 раза в год. Это исследование необходимо, чтобы обнаружить любые проблемы с сердцем (увеличение размеров, нарушение сократительной функции, поражение клапанов).
Необходимо регулярно (два раза в год) проводить проверку слуха, для того чтобы сразу же начать лечение и максимально сохранить возможность учиться и общаться.
Магнитная резонансная томография
МРТ позвоночника должна проводится ежегодно, с особенным фокусом на области, в которых может развиваться компрессия спинного мозга — шейный, грудной, грудопоясничный отделы. Пациенты с синдромом Хантера должны наблюдаться у врача-детского хирурга/врача-травматолога-ортопеда, чтобы контролировать состояние шейного отдела позвоночника. Важно оценивать результаты исследований в динамике, поэтому все снимки следует хранить и предоставлять при каждом следующем исследовании врачам. Компьютерную томографию позвоночника проводят, как правило перед планируемым оперативным лечением.
Рентген шейного и грудо-поясничного отделов позвоночника в двух проекциях следует проводить каждые 1-3 года. Это исследование провести технически бывает проще, чем МРТ, кроме того рентгенография дает больше информации о строении позвонков.
Симптоматическое лечение
Основная цель симптоматического лечения — скорректировать вызванные заболеванием изменения.
Скелет и опорно-двигательная система костно- суставная система
Важно найти баланс между возможностью жить максимально полной жизнью и не допускать осложнений заболевания, связанных с особенностями строения скелета. С одной стороны, не следует чрезмерно ограничивать и опекать пациента, но важно помнить, что некоторые виды физической активности, такие как кувыркание, стойка на голове и ныряние должны быть полностью исключены из-за нестабильности шейного отдела. Разрешаются легкие прыжки, но нельзя допускать самостоятельные прыжки на обе ноги, потому что система опоры и координации движений у пациентов не совсем развита. Родителям школьников нужно обязательно сообщить об этом учителю физкультуры.
Пациенты с синдромом Хантера должны вести подвижный образ жизни, для поддержания функционирования суставов и улучшения общего состояния здоровья. Физиотерапевт может посоветовать различные комбинации ежедневных упражнений.
Интенсивная терапия для улучшения подвижности суставов и позвоночника, а также для укрепления спинной и брюшной мускулатуры рекомендована для всех пациентов. Чтобы уменьшить последствия гиперлордоза, необходимо укреплять все группы грудной мускулатуры, при этом нужно проводить терапию, направленную и на развитие пояснично-крестцового отдела. Необходимо следить за тем, чтобы пациент не перенапрягался и не уставал чрезмерно, поэтому рекомендуется тщательно изучить его физическое состояние и соответственно проводить терапию.
Родителям рекомендуется проводить такие занятия дома, сочетая активные и пассивные упражнения. Комплекс занятий должен включать:
- упражнения на выработку осанки и чувства равновесия;
- упражнения на растяжение;
- водные процедуры и занятия спортом в воде, особенно для пожилых пациентов.
Отдельного внимания требуют деформированные ступни и кисти.
Чтобы поддерживать подвижность ступней необходимо проводить гимнастику, лучше всего дома или во время игр. Для снятия чрезмерного мышечного напряжения необходима ортопедическая обувь, стельки и вкладыши, которые выполняют поддерживающую функцию, в некоторых случаях также необходимы ортезы, ванночки, массаж ног.
Важно выполнять упражнения на растяжку мышц задней поверхности бедра и голени.
Для улучшения мелкой моторики кистей рук рекомендована интенсивная гимнастика для пальцев и ладошек, которую родители могут проводить дома. Лучше всего ввести ее в повседневные домашние ритуалы, например, во время еды за столом. Игры с участием ладоней и пальцев очень по душе детям, но во время упражнений на растяжение могут появиться жалобы на боль и неприятные симптомы. В данном случае хорошо помогают теплые ванночки для рук, подушечки с прогретыми зернами или мхом, торфом, которые пациент держит в руках во время игр.
После интенсивных занятий электротерапия, ручной массаж, водный массаж, терапия лечебной грязью, занятия на водных тренажерах снимают боль и приносят облегчение.
При проведении всех активных видов терапии следует обращать особое внимание на ритм дыхания и давать достаточное количество перерывов для отдыха и восстановления дыхания.
Существуют различные мнения о необходимости хирургического вмешательства. Но оперативное вмешательство несет определенные риски и проводить его следует в случаях острой необходимости. Одну из больших сложностей при МПС представляет проведение анестезии. Интубация у людей с МПС требует определенного навыка и должна выполняться опытным врачом. Нестабильность шейного отдела позвоночника у пациентов с МПС увеличивает риск травматического повреждения, в том числе шейного отдела спинного мозга, при ведении анестезии, так как многие анестезиологические пособия связаны с максимальным разгибанием шеи. В этом случае нужно принимать специальные меры предосторожности. Если пациент попал в критическом состоянии в больницу, необходимо сообщить врачу-анестезиологу- реаниматологу, что возможны проблемы с шеей и интубацией. Дыхательные пути, как правило, сужены, поэтому может потребоваться эндотрахеальная трубка меньшего диаметра. Сама установка такой трубки — очень трудный процесс, и, возможно, потребуется использование гибкого бронхоскопа, чтобы сделать это аккуратно.
Нестабильность шейного отдела позвоночника корректируется с помощью операции (шейный спондилодез). С помощью костных фрагментов или искусственных материалов формируется опора, объединяющая два верхних позвонка и основание черепа.
Нейросенсорная и кондуктивная тугоухость в большинстве случаев могут компенсироваться подбором слуховых аппаратов (Аппарат слуховой костной проводимости с костной фиксацией имплантируемый***, Аппарат слуховой костной проводимости с креплением на голове***, Система имплантации среднего уха полностью имплантируемая***, Аппарат слуховой костной проводимости с имплантируемым вибратором***).
Сердечно- сосудистая система
В некоторых случаях может потребоваться хирургическая операция для замены поврежденных клапанов.
Важно, чтобы осуществлялся хороший уход за зубами, так как разрушенные зубы причиняют сильный дискомфорт и являются очагами инфекции. Необходимо регулярно чистить зубы, использовать растворы для полоскания. Но даже при самой тщательной заботе о зубах, могут развиваться воспалительные процессы. Раздражительность, плач и беспокойство иногда могут быть единственными симптомами проблем с зубами. Перед оперативным лечением зубов пациентам, у которых уже диагностировано поражение клапанов сердца, необходим профилактический прием антибиотиков перед и после лечения. Это вызвано тем, что некоторые бактерии из ротовой полости могут проникнуть в кровоток и вызвать инфекционный процесс на пораженном клапане. Если необходимо удаление зуба под анестезией, это должно быть сделано в больнице, а не в стоматологической поликлинике, под наблюдением опытного врача-анестезиолога-реаниматолога и врача-стоматолога/врача-детского стоматолога.
Лечение ОРВИ у пациентов с МПС лучше также проводить под пристальным вниманием врача. Следует помнить об особенностях применения стандартных препаратов у этой группы пациентов. Например, такие лекарства как антигистаминные препараты могут сушить слизистую, делая ее толще, противоотечные или сосудосуживающие средства могут повысить кровяное давление и сузить кровеносные сосуды, что нежелательно при МПС.
Из-за особенностей строения позвоночника и грудной клетки, пациентам с синдромом Хантера сложнее справиться с инфекцией, если она затрагивает легкие, поэтому врачи даже при незначительной инфекции могут назначать антибиотики.
Чтобы нормализовать циркуляцию воздуха в легких, рекомендуется проводить игры с мыльными пузырями, ватой, соломинками для напитков, бумажными пакетами и другими предметами, требующими активизации работы дыхательной системы. Возможны игры с воздушными шарами или мячами. Для детей постарше или подростков можно разработать зарядку на растяжение мускулов грудной клетки, которую родители смогут проводить самостоятельно.
Пассивные упражнения для грудной клетки применяются для пациентов с острыми инфекциями дыхательных путей или для пациентов, которые не могут самостоятельно двигаться. Упражнения помогают более эффективному отделению слизи. К ним относятся потягивания, растяжения, потряхивания, массаж и вибрации.
Всем пациентам должна проводиться плановая вакцинация!
Специальная диета не сможет предотвратить накопление ГАГ, так как они синтезируются в клетках, а не поступают с пищей. Поэтому ограничения в диете у пациентов с МПС не нужны, они должны питаться обычно в соответствии с возрастными потребностями.
Где в России занимаются диагностикой и лечением
В каждом из регионов определены лечебные учреждения, в которых пациенты получают и патогенетическое лечение, и проходят все необходимые исследования.
Узнать больше
В мире есть много организаций, которые могут помочь вам найти ответы на любые вопросы, связанных с мукополисахаридозами:
Международная организация по мукополисахаридозам: www. mpssociety.org
Международный портал по редким болезням www.orpha.net
Европейская организация, объединяющая пациентов с разными редкими заболеваниями EURORDIS www.eurordis.org
Помните, что активная позиция самих пациентов – залог успешной и счастливой жизни!
Общественные организации и фонды России
МПС II типа входит в перечень орфанных заболеваний, лечение которых проводится за счёт средств государства. Помочь пациентам получить лечение, повысить информированность общества о редких болезнях, а также добиваться продвижения законодательных инициатив в области орфанных заболеваний могут общественные организации.
Помощь семьи
Конечно, многое зависит от врача, сколько он знает про ваше заболевание, как правильно он назначил лечение и как хорошо он объяснил вам принципы терапии. Не забывайте — от семьи зависит успех лечения не в меньшей степени. Нужно соблюдать рекомендации, ни при каких условиях не терять надежду и самому стать экспертом в своем заболевании. Читайте литературу, общайтесь с семьями, не стесняйтесь задавать вопросы. И даже если вы не победите болезнь полностью, изменить жизнь к лучшему, сделать родного вам человека счастливым в ваших силах!
Заботиться о пациенте с тяжелым заболеванием – очень трудная задача. Родители тоже нуждаются в полноценном отдыхе, а это не всегда получается. Если в семье растут и другие дети, они также требуют внимания родителей. Многие родители обращаются за помощью к волонтерам или социальным работникам. Если в вашем городе существуют такого рода поддержка, обязательно воспользуйтесь ей.
Пациенты с МПС II могут помочь своим родственникам, просто сообщив им о необходимости пройти диагностику. Если диагноз будет установлен рано – до начала необратимых изменений внутренних органов, лечение будет гораздо эффективнее. Тестирование также необходимо для выявления носительниц болезни, поскольку они имеют высокий риск передачи заболевания своим сыновьям и должны иметь эту информацию. Лечащий врач или врач-генетик не имеет права разглашать медицинскую информацию, поэтому судьба родных – целиком в руках самих пациентов.
Родные братья и сестры, все родственники по материнской линии – дяди, тети и двоюродные братья и сестры должны быть проинформированы о необходимости тестирования.
Проведение молекулярно-генетического анализа, направленного на выявление семейной мутации гена IDS показано следующим родственникам пациента:
- мать
- братья и сестры
- сводные братья и сестры по матери
- дети дочерей
- братья и сестры матери
- дети сестер
- дети племянниц
- двоюродные братья и сестры по материнской линии
- дочери внуков (правнучки) по линии дочерей
- дети внучек (правнуки и правнучки) по линии дочерей
Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Приложение Г1 Шкала субъективной оценки переносимости физической нагрузки (шкала Борга) (Borg scale)
Источник: [Borg GAV. Psycho-physical bases of perceived exertion. Med Sci Sports Exerc 1982;14:377–381, Borg, G. Borg»s Perceived Exertion and pain Scales. USA: Human Kinetics, 1998, p. 2, Grant S, Aitchison T, Henderson E, Christie J, Zare S, McMurray J, Dargie H. A comparison of the reproducibility and the sensitivity to change of visual analogue scales, Borg scales, and Likert scales in normal subjects during submaximal exercise. Chest. 1999 Nov;116(5):1208-17].
Тип: шкала оценки
Назначение: субъективной оценка переносимости физической нагрузки
Оценочный инструмент: шкала
Содержание и ключ:
Пациент получает инструкции по оценке одышки во время физической нагрузки: от 0 баллов — спокойное дыхание, нет ощущения одышки и далее – до 10 баллов, когда одышка максимальна. Оцените свои ощущения в настоящий момент.Синдром Хантера
Синдром Хантера — наследственное заболевание обмена веществ с Х-сцепленным рецессивным типом наследования, характеризующееся дефицитом лизосомального фермента идуронат-2-сульфатазы и накоплением мукополисахаридов в тканях. При синдроме Хантера отмечается задержка роста, макроцефалия, деформация костно-суставного аппарата, поражение кожи, сердечно-сосудистой и дыхательной системы, гепатоспленомегалия, нарушение слуха, умственная отсталость. С целью диагностики синдрома Хантера проводится консультация генетика, определение экскреции гликозаминогликанов, рентгенография костей и суставов. Пациентам с синдромом Хантера показана пожизненная ферментозамещающая терапия препаратом элапраза.

Общие сведения
Синдром Хантера (мукополисахаридоз II типа) — редкое генетическое заболевание, сцепленное с Х-хромосомой, при котором вследствие ферментной недостаточности происходит неполное разрушение и накопление кислых мукополисахаридов (гликозаминогликанов) в различных тканях. Частота рождения детей с синдромом Хантера составляет примерно 1:100000-150000 новорожденных. В настоящее время в мире насчитывается не более 2000 больных синдром Хантера; по России официальная статистика отсутствует. Синдром Хантера относится к группе орфанных заболеваний, лечение которых, согласно действующему законодательству, должно осуществляться за счет средств федерального и регионального бюджета.

Причины синдрома Хантера
Развитие синдрома Хантера связано с мутацией гена идуронатсульфатазы (IDS), кодирующего лизосомный фермент идуронат-2-сульфатазу. Ген IDS картирован в локусе Xq28 на длинном плече Х-хромосомы; в настоящее время известно более 150 различных его мутаций (точечные мутации, мелкие и крупные делеции, вставки, перестройки и пр.).
В силу сцепленности наследования с Х-хромосомой, синдромом Хантера, как правило, страдают исключительно мальчики (XY). Гетерозиготные женщины в подавляющем большинстве случаев являются носителями мукополисахаридоза II типа без клинических проявлений, однако описаны несколько случаев синдрома Хантера у девочек, связанных с новой мутацией или инактивацией второй, нормальной Х-хромосомы.
Мутации в гене IDS сопровождаются дефицитом или отсутствием фермента iduronate-2-sulfatase (I2S), неполным расщеплением и накоплением в лизосомах клеток практически всех тканей и органов гликозаминогликанов (ГАГ) — дерматансульфата и гепарансульфата.
Классификация синдрома Хантера
Степень выраженности клинических проявлений синдрома Хантера (среднетяжелая, тяжелая) зависит от типа мутации в гене IDS. Так, крупные делеции и сложные перестройки, как правило, обусловливают развитие тяжелых форм синдрома Хантера. Для тяжелой степени (мукополисахаридоза типа IIА) характерно ранее развитие клинических симптомов (преимущественно в возрасте 18-36 месяцев), быстро прогрессирующее течение, выраженная умственная отсталость, полиорганное поражение. Пациенты с тяжелой формой синдрома Хантера погибают на втором десятилетии жизни.
Среднетяжелая форма (мукополисахаридоз типа IIВ) составляет примерно 1/3 всех случаев патологии. Клинические проявления синдрома Хантера обычно возникают у детей в 3-8 (иногда 10-13) лет; интеллект обычно сохранен; продолжительность жизни при благоприятных условиях может достигать 50-60 лет. Пациенты с легкой формой синдрома Хантера могут успешно реализовать себя в профессиональной сфере и иметь здоровое потомство.
Симптомы синдрома Хантера
На момент рождения дети с синдромом Хантера выглядят клинически здоровыми. Основная симптоматика развивается в среднем в 2-4 года. До этого возраста проявления заболевания неспецифичны: у детей могут отмечаться повторные риниты, шумное дыхание, пупочные и паховые грыжи, гидроцеле.
Ранним характерным признаком синдрома Хантера служит постепенное изменение внешности ребенка: черты лица становятся грубыми (гаргоилизм); язык, губы и ноздри – большими; кожа – толстой. Облик больного с синдромом Хантера дополняется низкорослостью, увеличением размеров головы (макроцефалией), короткой шеей, аномалиями зубных рядов (редкими зубами). Дети с синдромом Хантера внешне очень похожи друг на друга и напоминают братьев.
Другие ранние признаки мукополисахаридоза II типа включают хриплый низкий голос, увеличение живота, гепатоспленомегалию. Дети с синдромом Хантера склонны к частой заболеваемости ОРВИ, отитами, ларингитом, трахеитом, пневмониями; нередко у них отмечается обструктивное апноэ сна, хроническая диарея. Следствием отложения гликозаминогликанов и липидов в дерме служит возникновение узелково-папулезных высыпаний на коже плеч, бедер, лопаток. Возможно появление «монгольских пятен» в пояснично-крестцовой области, гипертрихоза.
Уже в дошкольном возрасте у детей с синдромом Хантера появляются признаки поражения опорно-двигательного аппарата, выражающиеся в тугоподвижности суставов, развитии кифосколиоза, деформации кистей по типу «когтистой лапы». Движения становятся затруднительными, походка неуклюжей; к юношескому возрасту больные с синдромом Хантера нередко делаются беспомощными инвалидами, прикованными к постели.
Неврологические нарушения, возникающие при синдроме Хантера, включают синдром гипервозбудимости, судороги, сообщающуюся гидроцефалию, спастическую параплегию, задержку речевого развития, прогрессирующую тугоухость. Со стороны зрительной системы обнаруживается помутнение роговицы, атипичный пигментный ретинит. К наиболее поздним признакам мукополисахаридоза II типа относятся кардиологические нарушения: появление шумов в сердце, приобретенные пороки сердца (чаще митральная недостаточность), кардиомиопатия и др.
У ребенка могут наблюдаться изменения психики: обидчивость, агрессивность. В зависимости от типа синдрома Хантера интеллектуальный дефект может быть небольшим или значительно выраженным. Летальный исход у больных с синдромом Хантера обычно наступает от прогрессирующей сердечной или легочной недостаточности.
Диагностика синдрома Хантера
В практике педиатра синдром Хантера встречается исключительно редко. Тем не менее, мукополисахаридоз II типа может быть заподозрен на основании клинических признаков (внешних изменений, манифестации заболевания на 2-4 году жизни, прогредиентного течения и др.). Для подтверждения диагноза дети нуждаются в консультации генетика, анализе клинико-генеалогических данных, проведении молекулярно-генетических исследований.
Важным биохимическим маркером синдрома Хантера служит повышение экскреции мукополисахаридов (дерматансульфата, гепарансульфата) с мочой, дефицит фермента идуронат-2-сульфатазы. Рентгенологические исследования костей черепа, суставов, трубчатых костей, позвоночника демонстрируют дизостоз, остеоартрит, множественные изменения позвонков.
Для обнаружения морфофункциональных изменений со стороны внутренних органов и ЦНС проводится УЗИ органов брюшной полости, ЭКГ, ЭхоКГ, электроэнцефалография, МРТ головного мозга. Морфологическое исследование тканей, полученных в результате биопсии кожи, печени, миокарда и пр., выявляет однотипные изменения — клетки, заполненные гликолипидами.
В семьях с известным генотипом и высоким риском рождения ребенка с синдромом Хантера может проводиться инвазивная пренатальная диагностика – биопсия ворсин хориона, амниоцентез или кордоцентез с определением активности идуронат-2-сульфатазы в полученном материале.
Дифференциальную диагностику синдрома Хантера следует проводить с другими формами мукополисахаридозов (прежде всего, синдромом Гурлера), а также с другими лизосомными болезнями накопления.
Лечение синдрома Хантера
Детям с синдрома Хантера необходимо пожизненное проведение ферментозаместительной терапии. На сегодняшний день единственным препаратом, зарегистрированным в США, Европе и России для лечения больных с синдромом Хантера, является идурсульфаза. Пациенты с мукополисахаридозом II типа должны получать идурсульфазу еженедельно путем внутривенного капельного введения в дозе 0,5 мг/кг массы тела.
Кроме патогенетического лечения, детям с синдромом Хантера проводятся регулярные медикаментозные курсы симптоматической и корригирующей терапии гепатопротекторами, витаминами, антиоксидантами, цитопротекторами. В комплексную терапию синдрома Хантера целесообразно включать ЛФК, физиотерапию (электрофорез лидазы на суставы, парафиновые аппликации, магнитотерапию, лазеропунктуру), занятия с дефектологом и логопедом.
Прогноз и профилактика синдрома Хантера
Синдром Хантера типа В имеет более благоприятное течение и прогноз; при своевременном и регулярном лечении продолжительность жизни больных может достигать 50-60 лет. При тяжелых формах мукополисахаридоза II типа пациенты обычно погибают до 20 лет от сердечно-сосудистой недостаточности. На сегодняшний день серьезную проблему для больных с синдромом Хантера представляет своевременное получение жизненно необходимого препарата идурсульфазы из-за его высокой стоимости.
Дети с синдромом Хантера нуждаются в наблюдении различных специалистов: детского генетика, педиатра, детского кардиолога, детского невролога, эпилептолога, детского офтальмолога, детского отоларинголога, детского хирурга, детского ортопеда.
Основным методом профилактики синдрома Хантера является медико-генетическое консультирование супружеских пар, имеющих вероятность рождения больного ребенка, а также проведение дородовой диагностики. Следует знать, что у больных с синдромом Хантера рождаются здоровые сыновья, а дочери выступают облигантыми носителями мутантного гена.
Мукополисахаридоз — симптомы и лечение
Что такое мукополисахаридоз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Боровиковой Ольги Игоревны, генетика со стажем в 8 лет.
Над статьей доктора Боровиковой Ольги Игоревны работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина

Определение болезни. Причины заболевания
Мукополисахаридозы — это группа редких наследственных заболеваний соединительной ткани, связанных с нарушением обмена веществ. Они обусловлены нехваткой определённых ферментов, которые участвуют в переработке (расщеплении) гликозаминогликанов — сложных молекул сахара. В связи с чем эти молекулы скапливаются в организме человека в опасно большом количестве и приводят к различным изменениям [1] [14] .
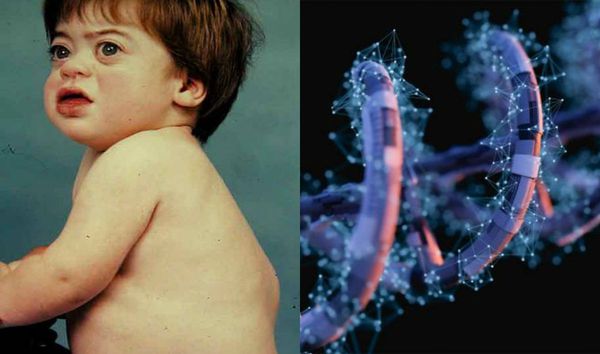
Самые явные проявления мукополисахаридозов — множественные деформации костей и суставов и нарушение физического развития (задержка и утеря ранее приобретённых навыков. При определённых типах заболевания (синдромах Шейе, Гурлер — Шейе, Хантера, Санфилиппо — I, II, III типах мукополисахаридозов) помимо прочего нарушается умственное развитие, начиная с лёгких когнитивных нарушений и заканчивая глубокой деменцией [13] .
Изменения при мукополисахаридозах возникают в результате дефекта ферментного расщепления углеводной части молекулы мукополисахаридов (гликозаминогликанов). При этом в фибробластах и мезенхимальных клетках, которые способны трансформироваться в хрящевые, костные либо жировые клетки, накапливается хондроитинсульфат — вещество, являющееся основой хрящей. Это ведёт к нарушению структуры соединительной, костной и хрящевой ткани [13] .
Мукополисахаридозы встречаются очень редко: примерно у одного ребёнка среди 56-325 тысяч новорождённых. Их причиной является мутация . Эти болезни довольно сложно диагностировать из-за малой осведомлённости врачей о них. Поэтому больным часто выставляют другие диагнозы и проводят неадекватное лечение.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы мукополисахаридоза
Мукополисахаридозы делятся на несколько типов. Они различаются первичным генным дефектом, патологическим ферментом, преимущественным поражением той или иной системы органов и тканей, возрастом начала заболевания и тяжестью его течения (см. классификацию ). В целом при этих генетических патологиях встречаются множественные нарушения: поражаются костная система, хрящи, печень, селезёнка, головной мозг, роговица глаза, органы лимфатической и дыхательной системы. Из-за особенностей строения дыхательных путей возникают частые инфекционные заболевания органов дыхания и слуха, что приводит к развитию тугоухости и респираторным расстройствам — бронхитам, пневмониям и др.
К самым частым проявлениям мукополисахаридозов относят низкорослость, волосатость и нарушения развития. Они дают о себе знать с раннего детства. Лицо ребёнка, как правило, приобретает грубые черты, становится «взрослым», а голова выглядит довольно большой из-за широкого лба и короткого носа. Губы и язык тоже становятся больше, чем у сверстников. Суставы пальцев плохо гнутся и двигаются. При отдельных типах заболевания нарушается слух и зрение, повреждаются сердечные клапаны и артерии [14] .
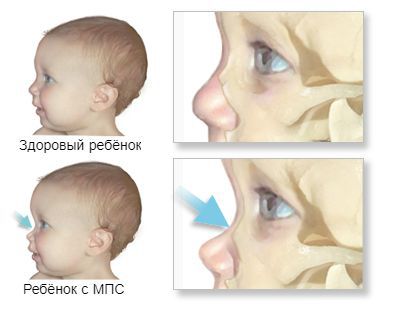
Патогенез мукополисахаридоза
Все формы мукополисахаридоза наследуются по аутосомно-рецессивному типу, т. е. мутировавший ген должен быть у обоих родителей. Исключением является мукополисахаридоз III типа: он наследуется по Х-сцепленному рецессивному типу.
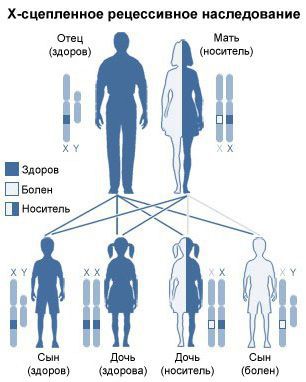
Каждая форма мукополисахаридоза отличается нарушением выработки различных ферментов, что приводит к изменению функции фермента, его нехватке или отсутствию. В результате этого нарушается ферментозависимый распад гликозаминогликанов: из-за нехватки определённых ферментов организм не в состоянии преобразовывать и сохранять эти полисахариды в тканях. Нерасщеплённые гликозаминогликаны через кровь распространяются по всему организму, что приводит к их избыточному накоплению в различных органах и системах [14] . Чаще всего эти вещества скапливаются в соединительной ткани, сердце, печени, селезёнке, нервной ткани и оболочках мозга:
- Отложение гликозаминогликанов в оболочках мозга способствует сужению субарахноидальных пространств, которые находятся под паутинной оболочкой головного мозга, и формированию гидроцефалии .
- Поражение нервных клеток приводит к задержке умственного развития, прогрессирующей деменции.
- Деформация метафизов (отделов трубчатых костей), утолщение межсуставных хрящей и суставных связок становятся причинами нарушения подвижности в суставах.
- В результате отложения гликозаминогликанов в миндалинах, трахее и голосовых связках возникает отёчность верхних дыхательных путей, нарушается дыхание, что приводит к нарушению вентиляции, частым респираторным заболеваниям, отитам, обструктивным состояниям (непроходимости дыхательных путей).
- Отложение гликозаминогликанов в тканях сердца сопровождается кардиомиопатиями и формированием клапанных пороков сердца.
- Повреждение канальцев почек может приводить к прогрессирующей артериальной гипертензии.
Классификация и стадии развития мукополисахаридоза
В зависимости от первичного генетического дефекта выделяют несколько типов мукополисахаридоза:
- МПС I типа включает в себя несколько подтипов: синдром Гурлер (H), Шейе (S) и Гурлер — Шейе (H/S) [6][7] . Мутация при данных фенотипах обнаруживается в гене IDUA, вызывает дефицит фермента альфа-L-идуронидазы [4] .
- МПС II типа — синдром Хантера [8] . Мутация при данном заболевании обнаруживается в гене IDS, вызывает дефицит либо отсутствие идуронат-2-сульфатазы, либо дефицит или отсутствие сульфоидуронат сульфатазы [5] .
- МПС III типа — синдром Санфилиппо — и меет несколько подтипов:
- МПС III А обусловлен мутацией в гене SGSH, приводит к нехватке гепаран-N-сульфатазы [9] ;
- МПС III В обусловлен мутацией в гене NAGLU, вызывает дефицит N-ацетил-α-D-глюкозаминидазы [10] ;
- МПС III С обусловлен мутацией в гене HGSNAT, вызывает дефицит гепаран-α-глюкозаминид-N-ацетилтрансферазы [11] ;
- МПС III D обусловлен мутацией в гене GNS, вызывает дефицит N-ацетилглюкозамин-6-сульфатазы [2][12] .
- МПС IV типа — синдром Моркио — делится на два подтипа:
- МПС IV А связан с мутацией в гене GALNS, вызывает дефицит галактозамин-6-сульфатазы;
- МПС IV В связан с мутацией в гене GLB1, вызывает недостаточность β-галактозидазы.
- МПС VI типа — синдром Марото — Лами — связан с мутацией гена ARSB, вызывает дефицит N-ацетилгалактозамин-4-сульфатазы [3] .
- МПС VII типа — синдром Слая — возникает вследствие мутации гена GUSB, приводит к дефициту β-глюкуронидазы.
- МПС IX типа является проявлением мутации гена HYAL1, приводит к недостаточности гиалуронидазы.
Остановимся подробнее на каждом типе мукополисахаридоза.
Мукополисахаридоз I H (синдром Гурлер). Основными симптомами заболевания являются: задержка психического и физического развития, умственная отсталость, грубые черты лица, пороки клапанов сердца, помутнение роговицы, низкорослость, тугоподвижность суставов. Первые признаки такого мукополисахаридоза появляются в течение первых 12 месяцев жизни младенца.
Иногда уже с самого рождения отмечается увеличение печени и селезёнки (гепатомегалия), пупочные или пахово-мошоночные грыжи. Ближе к 6-12 месяцам лицо приобретает грубые черты, напоминающие гаргулью: голова становится больше, выступают лобные бугры, появляются широкие скулы, уплощается и втягивается переносица, укорачиваются носовые ходы, изменяется форма носа, ноздри выворачиваются, рот постоянно полуоткрыт, увеличивается язык, губы становятся пухлыми. Низкорослость становится заметной ближе к 2-5 годам, рост обычно ниже 100 см. Пропорции тела нарушены, шея укорочена [3] .
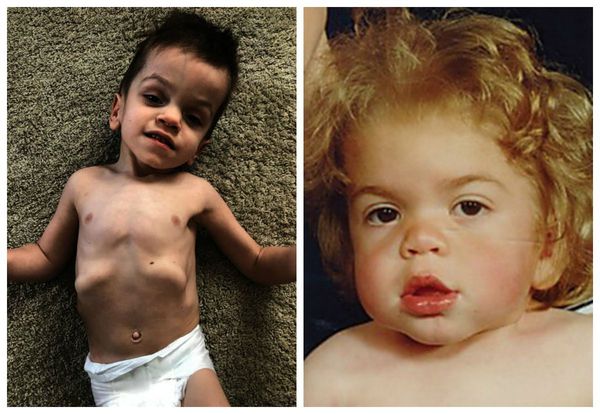
Очень часто у таких пациентов уменьшается подвижность крупных и мелких суставов, особенно пальцев, укорачиваются трубчатые кости, кисти рук деформируются и приобретают форму «лапы с когтями» [1] . Уменьшаются головки бедренных костей, из-за чего формируется дисплазия тазобедренных суставов. Подвздошные кости приобретают треугольную форму.
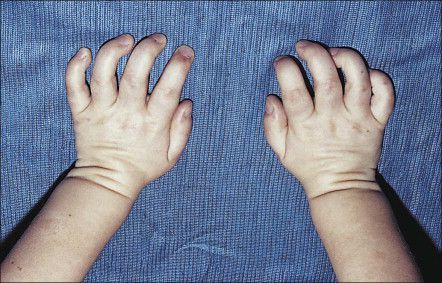
С развитием болезни к клинической картине присоединяются признаки поражения внутренних органов, сердца и сосудов, головного мозга, нервной системы.
Со стороны сердечно-сосудистой системы утолщаются клапаны, уменьшается диаметр артерий, нарушается сократимость сердечной мышцы, возникают кардиомиопатии, повышается артериальное давление. В итоге развивается сердечная недостаточность .
Основными проявлениями вовлечения нервной системы являются прогрессирующее снижение умственных способностей, задержка лингвистического (языкового) развития, гипотония мышц, снижение сухожильных рефлексов, патология черепно-мозговых нервов, снижение слуха [6] . Психическое и моторное развитие запаздывает, достигает максимального развития на уровне 2-4 лет, после чего останавливается и регрессирует, иногда переходя в полную деменцию. Ухудшает ситуацию прогрессирующая гидроцефалия [1] .
Поведение пациентов с синдромом Гурлер страдает из-за когнитивных нарушений, прогрессирующей тугоухости, бессонницы, связанной с ночной обструктивной задержкой дыхания . Со временем ребёнок становится всё активнее, развивается синдром дефицита внимания , агрессия, расстройства аутистического спектра.
При деформации позвоночника, утолщении оболочек спинного мозга изменяется походка, возникает мышечная гипотония, нарушается чувство равновесия, отмечается непроизвольное мочеиспускание и задержка мочи. При тяжёлом течении заболевания возможны судороги, требующие применения антиконвульсантов.
В возрасте 5-10 лет и старше часто развивается синдром запястного канала . Данное состояние требует обязательной коррекции, в противном случае развиваются контрактуры дистальных межфаланговых суставов, пальцы теряют чувствительность, наступает парез мышц большого пальца.
Скопление полисахаридов в глоточном лимфоидном кольце, надгортаннике и трахее является причиной сужения дыхательных путей, развития обструктивных состояний, рецидивирующих инфекций дыхательных путей и среднего уха.
Для больных мукополисахаридозом I типа также характерно поражение глаз в виде прогрессирующего помутнения роговицы, пигментной дегенерации и повышения внутриглазного давления [1] .
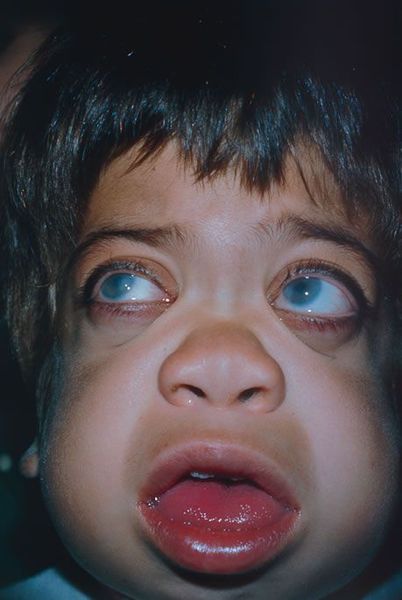
Средняя продолжительность жизни детей с синдромом Гурлер достигает 10 лет. Частой причиной смерти становятся обструктивные заболевания дыхательной системы, острые и хронические инфекционные процессы, патология сердечно-сосудистой системы.
Мукополисахаридоз I H/S (синдром Гурлер — Шейе) является среднетяжёлой формой заболевания. К самым частым симптомам относятся нарушение движения в суставах, снижение прозрачности роговицы и низкий рост [7] .
Первые признаки проявляются к 3-8 годам. Из-за преждевременного сращения черепных швов изменяется форма черепа и нарушается рост головного мозга. Переносица уплощается и западает, губы становятся пухлыми, верхняя челюсть становится меньше, повышается оволосение, кожа утолщается.
Как правило, в течение первых 12 месяцев жизни рост нормальный, но по мере взросления скорости роста снижается и развивается низкорослость. Пропорции тела нарушаются [1] . Суставы становятся тугоподвижными, нарушается форма костей, деформируется грудная клетка, возникает кифоз, сколиоз позвоночника.
С возрастом увеличиваются миндалины, рецидивируют респираторные заболевания, воспаления среднего уха, нарушается проходимость дыхательных путей. Со стороны глаз поражается роговица: происходит её помутнение из-за накопления гликозаминогликанов [7] . Нарушение мозга сопровождается задержкой психического, моторного, лингвистического развития, в исходе развивается деменция. Отмечается гидроцефалия, пахименингит в верхних отделах позвоночника, что приводит к компрессии спинного мозга, развитию патологии в нижележащих отделах [1] . Развивается синдром запястного канала, являющийся причиной контрактур суставов. Со стороны сердечно-сосудистой системы развиваются клапанные аномалии за счёт утолщения створок, нарушение сократимости сердечной мышцы. Увеличение печени и селезенки приводит к диспропорциональному увеличению живота. Патология передней брюшной стенки проявляется пахово-мошоночными грыжами, широким пупочным кольцом с образованием грыж [6] .
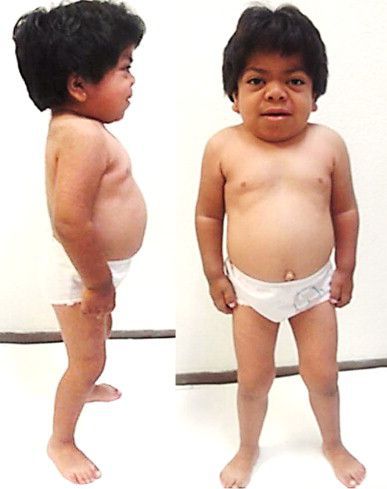
Мукополисахаридоз I S (синдром Шейе, или болезнь Гурлер с поздним началом) — лёгкая форма заболевания. Отличается стёртой клинической картиной. Грубые черты лица, напоминающие гаргулью, также присутствуют, но в более лёгкой степени, чем при синдроме Гурлер. Интеллект, психическое и моторное развитие, как правило, в пределах нормы. Иногда наблюдается незначительное запаздывание развития.
Основными клиническими проявлениями являются поражения суставов, сопровождающиеся нарушением их функции, и отставание в росте [1] . Поражение костей и суставов приводит к тугоподвижности конечностей, болевому синдрому, деформации кистей по типу «лапы с когтями», «пустой стопы», вальгусу в коленных суставах (Х-образным голеням), тоннельный синдром способствует развитию контрактур.
Характерны увеличение печени, селезёнки, образование пахово-мошоночных грыж, слабости пупочного кольца [1] , болезни органов слуха и рецидивирующие инфекционные заболевания органов дыхательной системы, которые приводят к приступам ночного апноэ. Зрение страдает из-за неравномерного помутнения роговицы, повышения внутриглазного давления, пигментной дегенерации сетчатки, что более характерно для больных старше 30 лет.
Часто формируется компрессия срединного нерва, что приводит к развитию карпального туннельного синдрома, связанного со сдавлением срединного нерва между костями, мышцами и связками запястья. Клапанные пороки сердца, расширения аорты могут быть причиной развития сердечной недостаточности.
Мукополисахаридоз II типа (синдром Хантера) бывает тяжёлой и умеренно тяжёлой формы. Такое разделение основано на степени поражения нервной системы и возрасте, в котором проявляются первые признаки болезни.
Синдром Хантера включает в себя множество различных признаков с поражением различных органов и систем [8] . Основу клинической картины составляют нарушения центральной нервной системы, проявляющиеся задержкой умственного развития, огрубление черт лица, низкорослость, нарушение подвижности суставов.
Большинство симптомов схожи с I типом болезни: грубые черты лица, напоминающие гаргулью, увеличенная мозговая часть черепа, выступающий лоб, уплощённая запавшая переносица, плоский нос с укороченными носовыми ходами, выворачивающиеся ноздри, приоткрытый рот, увеличенный язык, толстые губы, низкий рост, укороченная шея, тугоподвижность суставов, повышенное оволосение, пахово-мошоночные и пупочные грыжи. Отличается запоздалым прорезыванием зубов, длинными густыми ресницами, широкими густыми сросшимися бровями [8] . При прогрессировании заболевания волосы осветляются и выпрямляются, становятся сухими и жёсткими.
Для синдрома Хантера характерна сыпь в виде мелких узелков, группирующихся на спине, плечах и бёдрах. Её появление связано со скоплением мукополисахаридов в дерме.
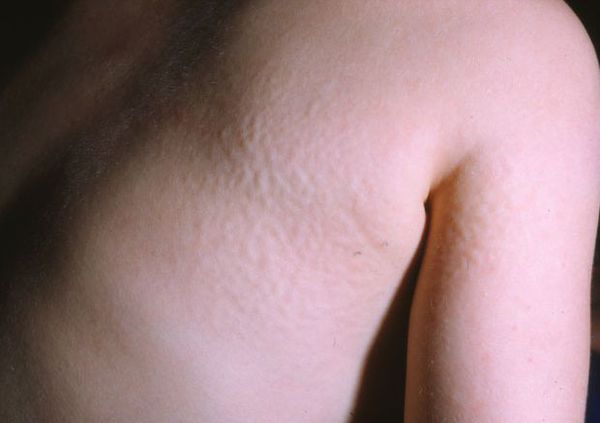
За счёт укорочения и расширения пястных костей, развития пястного тонельного синдрома кисть приобретает когтистую форму. По мере прогрессирования заболевания формируется кифосколиоз, деформируются тазобедренные суставы, возникают различные костные аномалии, увеличивается размер турецкого седла — углубления в клиновидной кости черепа.
Рецидивирующие инфекции органов дыхания и слуха, увеличение миндалин приводят к тугоухости, апноэ во сне. Поражение глаз проявляется помутнением роговицы (реже, чем при других типах болезни), пигментной дегенерацией сетчатки, а при тяжёлых формах происходит дистрофия сетчатки и отёк диска. При развитии внутричерепной гипертензии наблюдается отёк зрительного нерва.
Психическое развитие начинает отставать в возрасте 1,5-3 лет. При тяжёлых формах заболевания к 8-10 годам появляется тяжёлая умственная отсталость и эпилепсия, которая трудно поддаётся лечению. Иногда формируется сообщающаяся гидроцефалия, парезы, потеря чувствительности в конечностях. Известны случаи сдавления спинного мозга, связанные с увеличением толщины оболочек, нестабильностью атлантоаксиального сустава (между затылочной костью и первым шейным позвонком). Это приводит к мышечной слабости, недержанию мочи, задержке мочеиспускания и неуклюжести [6] . Из-за поражения ствола головного мозга нарушается глотание и подвижность нижней челюсти. Возможны псевдобульбарные и бульбарные параличи (связанные с поражением продолговатого мозга).
Большую трудность представляют поведенческие нарушения: гиперактивность, агрессия, упрямство. Часто ухудшают ситуацию проблемы со сном, нарушения слуха. Со временем присоединяются расстройства аутистического спектра. Эти состояния трудно поддаются коррекции. При тяжёлом течении заболевания развивается деменция.
Поражение сердечно-сосудистой системы проявляется клапанными пороками сердца, кардиомиопатией.
С раннего детского возраста отмечается увеличение печени и селезёнки, нарушение переваривания пищи и моторики кишечника. Увеличение языка и поражение височно-нижнечелюстного сустава приводят к нарушению глотания.
Мукополисахаридоз III типа (синдром Санфилиппо) отличается от других тем, что при нём гликозаминогликаны скапливаются по большей части в тканях мозга, а не в соединительной ткани. Самые яркие клинические признаки: задержка психического развития, маловыраженное поражение суставов, лёгкое огрубление черт лица [2] .
Первые проявления возникают на втором году жизни: низкорослость, умеренная тугоподвижность суставов, увеличение печени и селезёнки [9] . До 3 лет дети обычно развиваются в пределах нормы, а затем утрачиваются ранее приобретённые моторные и речевые навыки, нарушается психическое развитие. В дальнейшем возникает нарушение поведения, грубое нарушение психики, переходящее в деменцию. Речь, как правило, не формируется.
Характерны черепно-лицевые изменения: увеличенные лобные бугры, низкие надбровные дуги, широкая спинка носа, густые сросшиеся брови, густые ресницы, сухие и жёсткие волосы, повышенное оволосение [2] .
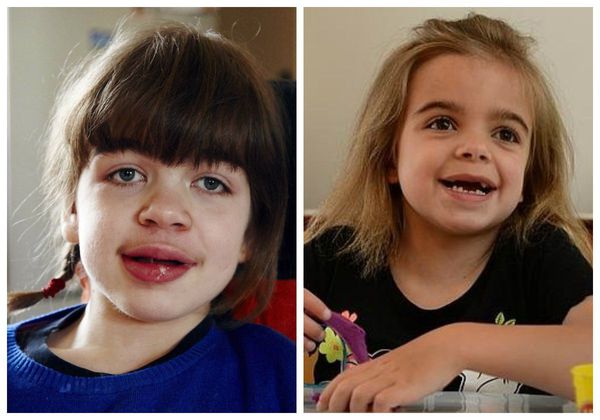
Мукополисахаридоз IV типа (синдром Моркио) сопровождается значительными деформациями костной системы, которые затрагивают в основном руки, ноги и грудную клетку.
В первые месяцы жизни ребёнка признаки заболевания отсутствуют, клиническая картина проявляется только в возрасте 1-3 лет. К 7-8 годам симптомы болезни становятся наиболее яркими. Характерна низкорослость, задержка физического развития. Кожа толстая, малоэластичная. Лицевые признаки: широкий рот, укороченный нос, редкие зубы, дисплазия эмали зубов.
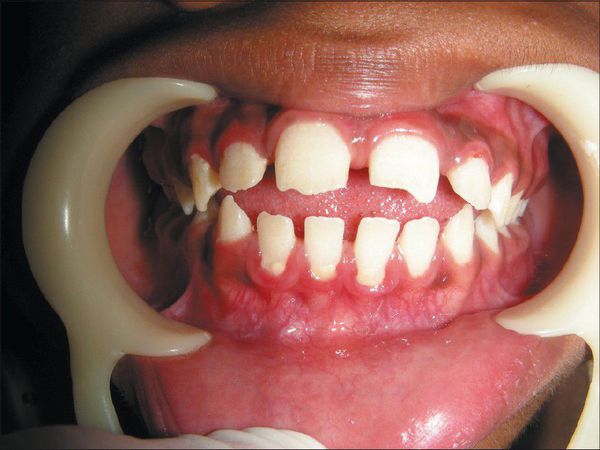
Мышцы гипотоничны, грудная клетка деформирована, отмечается кифосколиоз грудного и поясничного отделов позвоночника. Интеллект не страдает [3] . Суставы тугоподвижны, нередко развиваются контрактуры. Часто появляется шейная миелопатия — поражение волокон спинного мозга с нарушением проведения нервного импульса. Иногда развивается тугоухость. Отмечается слабость апоневроза передней брюшной стенки с образованием грыж [3] .
Мукополисахаридоз VI типа (синдром Марото — Лами) имеет разнообразные проявления, которые прогрессируют с разной скоростью. Характерна низкорослость, снижение зрения, грубые черты лица, тугоухость, снижение подвижности суставов, увеличение печени и селезёнки, поражение сердечно-сосудистой системы и органов дыхания. Интеллект, как правило, в пределах нормы.
Черты лица напоминают гаргулью. Нарушены пропорции тела, формируется карликовость. Суставы деформированы, множественные деформации костей приводят к инвалидизации. Отмечается нарушение развития тел грудных позвонков, их переломы при незначительной нагрузке. Часто возникает сдавление спинного мозга, связанное с нестабильностью шейного отдела позвоночника. Иногда развиваются клапанные пороки сердца, приводящие с сердечной недостаточности. Со стороны желудочно-кишечной системы наблюдается синдром раздражённого кишечника, увеличение печени и селезёнки.
Мукополисахаридоз VII типа (синдром Слая) проявляется увеличением печени и селезёнки, образованием пахово-мошоночных или пупочных грыж, низкорослостью, деформацией грудной клетки, кифосколиозом в поясничном и крестцовом отделах позвоночника, искривлением нижних конечностей, рецидивирующими респираторными заболеваниями, грубыми чертами лица с широко расставленными глазами, уплощённой переносицей и вывернутыми вперёд ноздрями. Иногда наблюдаются клапанные пороки сердца и кардиомиопатия.
Осложнения мукополисахаридоза
Основными осложнениями течения мукополисахаридозов различных типов являются тяжёлые рецидивирующие респираторные инфекции (риниты, синуситы, отиты, ОРЗ), приводящие к дыхательной недостаточности, патология сердечно-сосудистой системы и поражение головного мозга.
Сам мукополисахаридоз не приводит к смерти. Больные чаще всего умирают в результате сердечной и дыхательной недостаточности, которые развиваются на фоне заболевания [5] .
Диагностика мукополисахаридоза
Диагностика основана на определении характерных клинических (внешних) признаков и изучении активности гликозаминогликанов в крови. Последнее исследование проводится следующим образом: на специальные бланки с фильтровальной бумагой капается капиллярная кровь пациента, затем высушивается и отправляется в лабораторию, где проводится ферментный анализ. Возможно определение концентрации гликозаминогликанов в моче, но часто встречаются ложные результаты [4] [14] .
Также в рамках диагностики проводится генетическое исследование. Оно заключается в поиске мутаций в определённых генах, отвечающих за развитие мукополисахаридозов.
Дополнительная диагностика заключается в поиске поражений органов и систем с помощью различных исследований:
- УЗИ — выявляет увеличение печени и селезёнки, пороки развития сердца и увеличение его размеров;
- рентгенография — выявляет патологию костей и суставов;
- электрокардиография — выявляет кардиомиопатию, патологию сократимости и проводимости;
- электромиография — позволяет диагностировать нарушения в проведении возбуждения по нервным волокнам к мышцам;
- аудиометрия — помогает выявить проблемы со слухом [5][14] .
При проведении рентгенологических исследований в случае мукополисахаридоза I H типа выставляется диагноз «множественный дизостоз» — нарушения развития костей. Диафизы длинных трубчатых костей расширены, при рентгенологических исследованиях отмечается изменение структуры метафизов и эпифизов. Ключицы короткие и толстые, рёбра приобретают форму весла, части, расположенные ближе к позвоночнику, сужены, а передние — толстые и широкие [1] . Фаланговые кости рук и ног укорочены, имеют форму трапеции, диафизы широкие.
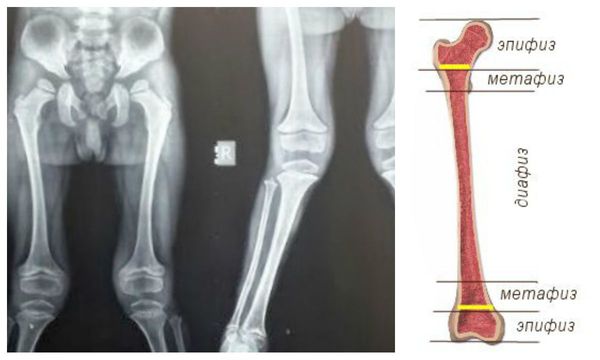
Формируются уплощение позвонков, сколиоз, кифосколиоз. Позвонки в поперечнике широкие, но они низкие. В деформированных участках отмечается недоразвитие поперечных отростков либо их «языкообразная» трансформация.
До рождения мукополисахаридоз и другие хромосомные нарушения можно обнаружить с помощью амниоцентеза (исследования околоплодной жидкости) или биопсии хориона (слоя плаценты). Также риск появления мукополисахаридоза у младенца можно определить ещё до зачатия. Для этого родителям нужно пройти генетический анализ [14] .
Лечение мукополисахаридоза
Симптоматическое лечение заключается в устранении грыжи, удалении миндалин и ортопедической хирургии. Проводится коррекция искривлений позвоночного столба при помощи транспедикулярной фиксации металлическими конструкциями, исправление деформаций костей и суставов, коррекция грудной клетки. Это позволяет облегчить болевой синдром, уменьшить риск сдавления спинного мозга. Также проводится шунтирование желудочков головного мозга при гидроцефалии.
Патогенетическое лечение, направленное на причину болезни, возможно при помощи трансплантации костного мозга и стволовых гемопоэтических клеток и заместительной ферментной терапии [5] . Трансплантация возможна от родственного донора либо из стволовых клеток пуповинной крови родственного донора после проведения химиотерапевтической или лучевой супрессии. Данный вид лечения не получил широкого распространения из-за высокого риска осложнений (инвалидизации или смерти). Заместительная ферментная терапия способна остановить прогрессирование заболевания, частично улучшить уже сформированные патологии. Применение такой терапии позволяет добиться регресса заболевания и существенно улучшить прогноз жизни.
В настоящее время ферментная терапия разработана только для некоторых типов мукополисахаридозов. При I типе используется альдуразим . Он представляет собой рекомбинантную человеческую альфа-L-идуронидазу. Препарат вводится внутривенно каждую неделю в течение 4-х часов [4] . Для мукополисахаридоха II типа показана элапраза [2] .
Мукополисахаридозы относятся к редким заболеваниям, поэтому препараты для их лечения выделяются на государственном уровне и предоставляются пациентам в рамках оказания бесплатной медицинской помощи [5] . В некоторых случаях заместительная терапия является пожизненной [14] .
Прогноз. Профилактика
При отсутствии должного лечения прогноз неблагоприятный, так как больные погибают от осложнений. Практически всегда заболевание приводит к инвалидизации. Однако всё зависит от типа заболевания. В некоторых случаях пациенты могут жить так же долго, как и здоровые люди [14] .
Профилактика заключается в генетическом консультировании пар, вступающих в брак, особенно при отягощённом семейном анамнезе.
Возможно проведение преимплантационной генетической диагностики в циклах ЭКО у пар с высоким риском рождения ребёнка с мукополисахаридозом либо генетическая диагностика на ранних сроках беременности с возможностью прерывания беременности при выявлении заболевания у плода.
Перспективным является создание генетических паспортов, выбор партнёра с отсутствием соответствующих мутаций.
Источник https://diseases.medelement.com/disease/%D0%BC%D1%83%D0%BA%D0%BE%D0%BF%D0%BE%D0%BB%D0%B8%D1%81%D0%B0%D1%85%D0%B0%D1%80%D0%B8%D0%B4%D0%BE%D0%B7-ii-%D1%82%D0%B8%D0%BF%D0%B0-%D1%83-%D0%B4%D0%B5%D1%82%D0%B5%D0%B9-%D0%BA%D0%BF-%D1%80%D1%84-2021/16885
Источник https://www.krasotaimedicina.ru/diseases/children/hunter-syndrome
Источник https://probolezny.ru/mukopolisaharidoz/