Лейкозы у детей: симптомы, диагностика, лечение
Лейкозы относятся к большой группе злокачественных новообразований системы крови под названием «гемобластозы». Лейкоз (от греческого слова «leukos» — белый) — злокачественная опухоль, возникающая из ранних незрелых кроветворных клеток костного мозга и метастазирующая из костного мозга в кровь, лимфатические узлы, печень, селезенку, головной мозг, спинной мозг и другие органы и ткани.
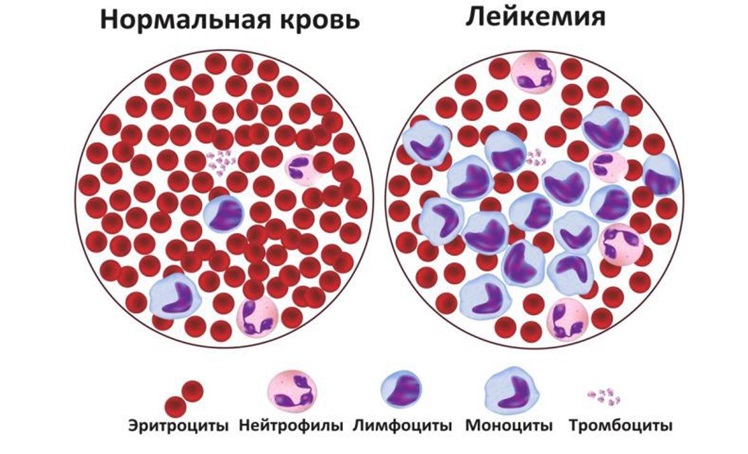
Все лейкозы можно разделить на острые лимфобластые, острые миелоидные лейкозы (ОМЛ) и хронический миелолейкоз.
Острый лимфобластный лейкоз
Более 80% всех лейкозов у детей составляет острый лимфобластный лейкоз (ОЛЛ). Причиной его развития является химерный ген TEL/AML, формирование которого происходит внутриутробно, возможно, в результате спонтанных ошибок в процессе репликации и репарации ДНК. Накопление генетических аномалий в опухолевом клоне ведет к блоку нормальной клеточной дифференцировки и нарушениям в процессе пролиферации и апоптоза.
В соответствии с франко-американо-британской (FAB) классификацией выделяют три морфологических варианта: L1, L2, L3.
Клинические симптомы ОЛЛ обусловлены степенью инфильтрации костного мозга лимфобластами, а также наличием экстрамедуллярного распространения процесса. Нередко отмечаются общие симптомы опухолевой интоксикации, а именно, повышение температуры тела, снижение аппетита, слабость, вялость. В течение процесса выделяют несколько периодов: начальный, развернутый, период ремиссии.
Развернутый период характеризуется бурным началом, многообразием клинических симптомов. К симптомам общей интоксикации присоединяются костные боли вследствие лейкозной инфильтрацией костной ткани (чаще поражаются диафизы длинных трубчатых костей), артралгии, вызванные лейкемической инфильтрацией суставов. Кожные покровы и слизистые становятся бледными. К сожалению, нередко на них появляются кровоизлияния, обусловленные геморрагическим синдромом, а также кровотечения (носовые, желудочно-кишечные, почечные). Увеличение периферических лимфатических узлов (шейно-надключичных, подмышечных, паховых) является одним из основных симптомов заболевания. Практически у всех пациентов отмечается обусловленное пролиферацией лейкозных клеток увеличение печени и селезенки. В некоторых случаях у пациентов поражение кожи и слизистых оболочек проявляется в виде лейкемидов, некроза, гингивита и стоматита.
Таким образом, можно выделить несколько симптомокомплексов, характерных для ОЛЛ:
- гиперпластический – лимфоаденопатия, боли в костях, тяжесть и боли в левом и правом подреберьях, гепатоспленомегалия;
- анемический – головокружение, мерцание мушек перед глазами, одышка при физической нагрузке, сердцебиение, шум в голове и ушах;
- геморрагический – кожные геморрагии, кровоточивость десен, носовые кровотечения;
- интоксикационный – повышение температуры тела, слабость, отсутствие аппетита, оссалгии;
- синдром инфекционных осложнений – присоединение тяжелых пневмоний.
При диагностике оцениваются морфологические особенности бластов костного мозга и периферической крови. Помимо обнаружения опухолевых клеток лимфоидной линии кроветворения при окраске по Романовскому – Гимзе, проводятся следующие методы исследования:
- цитохимические – позволяют отнести бласты к лимфоидному или миелоидному ростку (тест на миелопероксидазу, фосфолипиды, гликоген), отдельным клеточным линиям;
- иммунофенотипические – определяют иммунные маркеры клеток (CD);
- цитогенетические – определяют аномалии кариотипа и хромосомные аберрации (делеции, транслокации, инверсии и др.);
- молекулярно-биологические – позволяют установить количество клеток с определенной аберрацией во всей массе костного мозга.
Для подтверждения диагноза ОЛЛ необходимо комплексное обследование, в котором ведущая роль отводится морфологическому методу.
В настоящее время используются программы лечения BFM (БФМ: Берлин-Франкфурт-Мюнстер) и МВ (МБ: Москва-Берлин).
Все лечение можно разделить на базисное и сопроводительное. Базисная терапия представляет собой системную и локальную химиотерапию и, при необходимости, лучевую терапию. Сопроводительное лечение обязательно назначается для профилактики инфекционных осложнений и коррекции постцитостатических реакций. Выделяют следующие этапы в лечении злокачественных процессов: индукция ремиссии, консолидация ремиссии (как правило, несколько фаз), поддерживающее лечение.
Острый миелоидный лейкоз
Острый миелоидный лейкоз составляет 15% всех острых лейкозов у детей. Существующая FAB-классификация (Франко-Американо-Британская) позволяет разделить ОМЛ на следующие варианты:
- M0 (минимально дифференцированный ОМЛ), который характеризуется бластными клетками средних размеров с округлым ядром, отсутствием зернистости и палочек Ауэра в цитоплазме;
- М1 (ОМЛ без созревания), при котором менее 90% неэритроидных клеток представлены бластными клетками с преобладающей мезогенераций с округлыми ядрами и высоким ядерно-цитоплазматическим отношением;
- М2 (ОМЛ с созреванием), характеризующийся бластными клетками средних размеров с высоким и умеренным ядерно-цитоплазматическим отношением (20 – 90% всех неэритроидных клеток), в их цитоплазме выражено наличие азурофильной зернистости и палочек Ауэра;
- М2 баз (базально-клеточный), бластные клетки характеризуются наличием базофильной зернистости, составляет не более 0,5% острых нелимфобластных лейкозов;
- М3 (промиелоцитарный) вариант характеризуется бластными клетками крупных размеров с ядрами неправильной формы, отмечается крупная зернистость и палочки Ауэра в цитоплазме;
- М3v (гипогранулярный) с отсутствием зернистости;
- М4 (миеломонобластный): бластные клетки с ядрами округлой и неправильной формы, низким и умеренным ядерно-цитоплазматическим отношением, некоторые бластные клетки могут содержать зернистость, палочки Ауэра;
- М5а (монобластный без созревания), при котором монобласты составляют свыше 80% моноцитоидных клеток, бластные клетки крупных размеров с ядрами бобовидной или лопастной формы, в части из них просматривается зернистость, палочки Ауэра при этом не выявляются;
- М5b (монобластный с созреванием): монобласты составляют менее 80% моноцитоидных клеток, крупные с ядрами моноцитоидной формы, цитоплазмой без зернистости, палочки Ауэра не выявляются;
- М6 (эритромиелоз): более 50% бластом в костном мозге представлены эритробластами;
- М7 (мегакариобластный) лейкоз, при котором бластные клетки полиморфны, с отростчатой базофильной цитоплазмой, какие-либо специфические морфоцитохимические признаки отсутствуют.
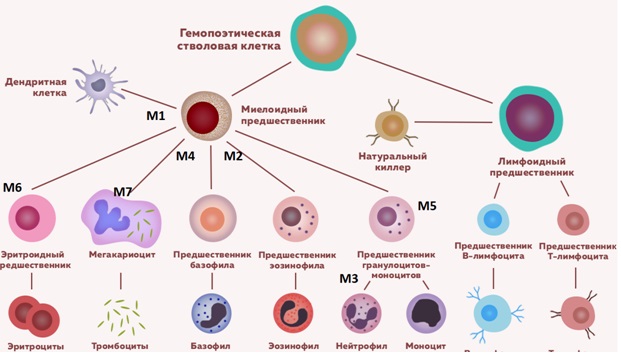
Схема гемопоэза с клетками предшественниками острого миелоидного лейкоза
Клиническая картина ОМЛ также складывается из анемического, геморрагического и токсического синдромов, которые являются следствием снижения продукции эритроцитов, тромбоцитов и гранулоцитов.
У 50% пациентов отмечается увеличение размеров печени (гепатомегалия) и селезенки (спленомегалия) вследствие инфильтрации органов опухолевыми клетками.
Внекостномозговые проявления заболевания связаны с лейкозной инфильтрацией центральной нервной системы и метастатическим поражением оболочек и вещества головного и спинного мозга (нейролейкемия). В этих ситуациях отмечается постоянная головная боль, возможна рвота, вялость, выявляется отек дисков зрительных нервов, могут быть нистагм, косоглазие, другие признаки поражения черепно-мозговых нервов, выявляются ригидность затылочных мышц, симптом Кернига.
Решающую роль в диагностике также имеет цитохимическое, иммунофенотипическое и морфологическое исследование бластов в костном мозге и периферической крови.
Ремиссию заболевания можно достичь посредством проведения высокодозной полихимиотерапии с последующей трансплантацией гемопоэтических стволовых клеток от HLA-геноидентичного родственного или альтернативного (неродственного, гаплоидентичного) донора у пациентов группы высокого риска рецидива. Благодаря адаптивным протоколам удается достичь ремиссии у 90% детей.
Хронические миелолейкоз
Хронический лейкоз – это вариант гемобластоза, субстратом которого являются созревающие клетки. У детей встречается только хронический миелолейкоз, который характеризуется пролиферацией гранулоцитарного ростка, гиперплазией миелоидной ткани, миелоидной метаплазией кроветворных органов, ассоциированной с хромосомной транслокацией t(9;22)(q34;q11), в результате которой образуется химерный онкоген BCR-ABL.
В течение хронического миелолейкоза выделяют три фазы:
- Хроническая фаза: выраженные симптомы отсутствуют.
- Фаза акселерации: повышение уровня лейкоцитов (>50 х 10 9 /л), бластов в периферической крови и костном мозге (> 10%); анемия и тромбоцитопения; персистирующий тромбоцитоз (> 1000 х 10 9 /л).
- Острая (бластная) фаза: миелобласты >30% в крови или в костном мозге; лимфобласты >30% в крови или в костном мозге; наличие бластных клеток в ликворе.
В дебюте заболевание трудно диагностировать, поскольку основные симптомы обусловлены общим опухолевым симптомокомплексом и носят преходящий характер. Наиболее частые симптомы, присоединяющиеся позднее – гепатомегалия и спленомегалия. Нарастающая интоксикация приводит к появлению слабости, утомляемости, повышению температуры тела, болям в костях.
В периферической крови отмечается гиперлейкоцитоз (до 200 – 300 х 10 9 /л и более) с увеличением содержания гранулоцитов до 95% и преобладанием незрелых клеток гранулоцитарного ряда: промиелоцитов, миелоцитов, метамиелоцитов, миелобластов, базофилов (до 10%) и эозинофилов (до 5%). Характерна анемия и повышение СОЭ. Уровень тромбоцитов преимущественно в норме, однако может отмечаться гипертромбоцитоз (до 600 х 10 9 /л и более).
В пунктате костного мозга отмечается увеличение числа миелокариоцитов за счет пролиферирующего пула клеток гранулоцитарного ряда с увеличением базофилов и эозинофилов. Позднее отмечается угнетение эритронормобластического и мегакариоцитарного ростков кроветворения.
Основным средством терапии и стандартом лечения хронического миелолейкоза в настоящее время является применение ингибиторов тирозинкиназы (ИТК). Данные препараты имеют механизм таргетного (целенаправленного) воздействия на BCR-ABL-положительные опухолевые клетки и должны назначаться всем пациентам после подтверждения диагноза. Для оценки эффективности и переносимости терапии ИТК рекомендуется регулярный мониторинг гематологических, цитогенетических и молекулярно-генетических и других показателей у пациента.
Список литературы
- Кузник Б. И. Клиническая гематология детского возраста: учеб. пособие / Б. И. Кузник, О. Г. Максимова. — М.: Вузовская книга, 2010. — 496 с.
- Румянцев А. Г. Практическое руководство по детским болезням. Т. 4. Гематология/онкология детского возраста / А. Г. Румянцев, Е. В. Самочатова. — М. : Медпрактика-М, 2004. — 792 c.
- Румянцев А.Г. Эволюция лечения острого лимфобластного лейкоза у детей. Педиатрия, 2016; 95(4): 11-22.
- Möricke A., Zimmermann M., Reiter A., et al. Long-term results of five consecutive trials in childhood acute lymphoblastic leukemia performed by the ALL-BFM study group from 1981 to 2000. Leukemia. 2010 Feb;24(2):265-84. doi: 10.1038/leu.2009.257.
- Creutzig U, van den Heuvel-Eibrink MM, Gibson B, et al. AML Committee of the International BFM Study Group. Diagnosis and management of acute myeloid leukemia in children and adolescents: recommendations from an international expert panel. Blood. 2012 Oct 18;120(16):3187-205. doi: 10.1182/blood-2012-03-362608.
- de la Fuente J, Baruchel A, Biondi A, de Bont E, Dresse MF, Suttorp M, Millot F; International BFM Group (iBFM) Study Group Chronic Myeloid Leukaemia Committee. Managing children with chronic myeloid leukaemia (CML): recommendations for the management of CML in children and young people up to the age of 18 years. Br J Haematol. 2014 Oct;167(1):33-47. doi: 10.1111/bjh.12977.

Авторская публикация:
Кулева С.А.
Заведующая отделением, врач-детский онколог, ведущий научный сотрудник, профессор НМИЦ онкологии им. Н.Н. Петрова

Иванова Светлана Вячеславовна
Врач-детский онколог, научный сотрудник, кандидат наук НМИЦ онкологии им Н.Н. Петрова
Что вам необходимо сделать
Если вы хотите узнать побольше о бесплатных возможностях ФБГУ НМИЦ онкологии им. Н.Н. Петрова Минздрава России, получить очную или заочную консультацию по диагностике и лечению, записаться на приём, ознакомьтесь с информацией на официальном сайте.
Если вы хотите общаться с нами через социальные сети, обратите внимание на аккаунты в ВКонтакте и Одноклассники.
Лейкоз у детей
Лейкоз у детей – злокачественное заболевание крови, характеризующееся опухолевой пролиферацией незрелых клеток-предшественников лейкоцитов. Клинические проявления лейкоза у детей могут включать увеличение лимфатических узлов, геморрагический синдром, боли в костях и суставах, гепатоспленомегалию, поражение ЦНС и др. Диагностике лейкоза у детей способствует развернутый общий анализ крови, проведение стернальной пункции с исследованием пунктата костного мозга. Лечение лейкоза у детей проводится в специализированных гематологических стационарах с помощью химиотерапии, иммунотерапии, заместительной терапии, трансплантации костного мозга.
Общие сведения
Лейкоз у детей (лейкемия) – системный гемобластоз, сопровождающийся нарушением костномозгового кроветворения и замещением нормальных клеток крови незрелыми бластными клетками лейкоцитарного ряда. В детской онкогематологии частота лейкозов составляет 4-5 случаев на 100 тыс. детей. Согласно статистике, острый лейкоз является самым частым онкологическим заболеванием детского возраста (примерно 30%); наиболее часто рак крови поражает детей в возрасте 2-5 лет. Актуальной проблемой педиатрии служит наблюдаемая в последние годы тенденция к росту заболеваемости лейкозами среди детей и сохраняющаяся высокая летальность.

Причины лейкоза у детей
Некоторые аспекты развития лейкоза у детей до настоящего времени остаются неясными. На современном этапе доказано этиологическое влияние радиационного излучения, онкогенных вирусных штаммов, химических факторов, наследственной предрасположенности, эндогенных нарушений (гормональных, иммунных) на частоту возникновения лейкоза у детей. Вторичный лейкоз может развиться у ребенка, перенесшего в анамнезе лучевую или химиотерапию по поводу другого онкологического заболевания.
На сегодняшней день механизмы развития лейкоза у детей принято рассматривать с точки зрения мутационной теории и клоновой концепции. Мутация ДНК кроветворной клетки сопровождается сбоем дифференцировки на стадии незрелой бластной клетки с последующей пролиферацией. Таким образом, лейкозные клетки – есть не что иное, как клоны мутировавшей клетки, неспособные к дифференцировке и созреванию и подавляющие нормальные ростки кроветворения. Попадая в кровь, бластные клетки разносятся по всему организму, способствуя лейкемической инфильтрации тканей и органов. Метастатическое проникновение бластных клеток через гематоэнцефалический барьер приводит к инфильтрации оболочек и вещества головного мозга и развитию нейролейкоза.
Отмечено, что у детей с болезнью Дауна лейкоз развивается в 15 раз чаще, чем у других детей. Повышенный риск развития лейкоза и других опухолей имеется у детей с синдромами Ли-Фраумени, Клайнфельтера, Вискотт-Олдрича, Блума, анемией Фанкони, первичными иммунодефицитами (Х-сцепленной агаммаглобулинемией, атаксией-телеангиэктазией Луи-Барр и др.), полицитемией и др.
Классификация лейкоза у детей
На основании продолжительности заболевания выделяют острую (до 2-х лет) и хроническую (более 2-х лет) формы лейкоза у детей. У детей в абсолютном большинстве случаев (97%) встречаются острые лейкозы. Особую форму острого лейкоза у детей представляет врожденный лейкоз.
С учетом данных морфологических характеристик опухолевых клеток острые лейкозы у детей делятся на лимфобластные и нелимфобластные. Лимфобластный лейкоз развивается при бесконтрольной пролиферации незрелых лимфоцитов — лимфобластов и может быть трех типов: L1 — с малыми лимфобластами; L2 – с большими полиморфными лимфобластами; L3 — с большими полиморфными лимфобластами с вакуолизацией цитоплазмы. По антигенным маркерам различают 0-клеточные (70-80%), Т-клеточные (15-25%) и В-клеточные (1-3%) острые лимфобластные лейкозы у детей. Среди острых лимфобластных лейкозов у детей чаще встречается лейкоз с клетками типа L1.
В ряду нелимфобластных лейкозов, в зависимости от преобладания тех или иных бластных клеток, различают миелобластный малодифференцированный (M1), миелобластный высокодифференцированный (М2), промиелоцитарный (М3), миеломонобластный (М4), монобластный (М5), эритромиелоз (М6), мегакариоцитарный (М7), эозинофильный (М8), недифференцированный (М0) лейкоз у детей.
В клиническом течении лейкоза у детей выделяют 3 стадии, с учетом которых выстраивается лечебная тактика.
- I – острая фаза лейкоза у детей; охватывает период от манифестации симптомов до улучшения клинико-гематологических показателей в результате проводимой терапии;
- II – неполная или полная ремиссия. При неполной ремиссии отмечается нормализация гемограммы и клинических показателей; количество бластных клеток в пунктате костного мозга составляет не более 20%. Полная ремиссия характеризуется наличием в миелограмме не более 5% бластных клеток;
- III — рецидив лейкоза у детей. На фоне гематологического благополучия появляются экстрамедуллярные очаги лейкозной инфильтрации в нервной системе, яичках, легких и др. органах.
Симптомы лейкоза у детей
В большинстве случаев клиника лейкоза развивается исподволь и характеризуется неспецифическими симптомами: утомляемостью ребенка, нарушением сна, снижением аппетита, оссалгиями и артралгиями, немотивированным повышением температуры тела. Иногда лейкоз у детей манифестирует внезапно с интоксикационного или геморрагического синдрома.
У детей, страдающих лейкозом, отмечается выраженная бледность кожных покровов и слизистых оболочек; иногда кожа приобретает желтушный или землистый оттенок. Вследствие лейкемической инфильтрации слизистых оболочек у детей нередко возникают гингивит, стоматит, тонзиллит. Лейкемическая гиперплазия лимфатических узлов проявляется лимфаденопатией; слюнных желез – сиаладенопатией; печени и селезенки – гепатоспленомегалией.
Для течения острого лейкоза у детей типичен геморрагический синдром, характеризующийся кровоизлияниями в кожу и слизистые, гематурией, носовыми, маточными, желудочно-кишечными, легочными кровотечениями, кровоизлияниями в полость суставов и др. Закономерным спутником острого лейкоза у детей является анемический синдром, обусловленный угнетением эритропоэза и кровотечениями. Выраженность анемии у детей зависит от степени пролиферации бластных клеток в костном мозге.
Кардиоваскулярные расстройства при лейкозах у детей могут выражаться развитием тахикардии, аритмии, расширением границ сердца (по данным рентгенографии органов грудной клетки), диффузными изменениями миокарда (по данным ЭКГ), снижением фракции выброса (по данным ЭхоКГ).
Интоксикационный синдром, сопровождающий течение лейкоза у детей, протекает со значительной слабостью, лихорадкой, потливостью, анорексией, тошнотой и рвотой, гипотрофией. Проявлениями иммунодефицитного синдрома при лейкозе у детей служит наслоение инфекционно-воспалительных процессов, которые могут принимать тяжелое, угрожающее течение. Гибель детей, страдающих лейкозом, нередко происходит вследствие тяжелой пневмонии или сепсиса.
Крайне опасным осложнением лейкоза у детей является лейкемическая инфильтрация головного мозга, мозговых оболочек и нервных стволов. Нейролейкоз сопровождается головокружением, головной болью, тошнотой, диплопией, ригидностью затылочных мышц. При инфильтрации вещества спинного мозга возможно развитие парапареза ног, нарушения чувствительности, тазовых расстройств.
Диагностика лейкоза у детей
Ведущая роль в первичном выявлении лейкозов у детей принадлежит педиатру; дальнейшее обследование и ведение ребенка осуществляется детским онкогематологом. Основу диагностики лейкозов у детей составляют лабораторные методы: исследование периферической крови и костного мозга.
При остром лейкозе у детей выявляются характерные изменения в общем анализе крови: анемия; тромбоцитопения, ретикулоцитопения, высокая СОЭ; лейкоцитоз различной степени или лейкопения (редко), бластемия, исчезновение базофилов и эозинофилов. Типичным признаком служит феномен «лейкемического провала» — отсутствие промежуточных форм (юных, палочкоядерных, сегментоядерных лейкоцитов) между зрелыми и бластными клетками.
Стернальная пункция и исследование миелограммы являются обязательными в диагностике лейкоза у детей. Решающим аргументом в пользу заболевания служит содержание бластных клеток от 30% и выше. При отсутствии четких данных за лейкоз у детей по результатам исследования костного мозга, прибегают к трепанобиопсии (пункции подвздошной кости). Для определения различных вариантов острого лейкоза у детей выполняются цитохимические, иммунологические и цитогенетические исследования. С целью подтверждения диагноза нейролейкоза проводится консультация детского невролога и детского офтальмолога, люмбальная пункция и исследование цереброспинальной жидкости, рентгенография черепа, офтальмоскопия.
Вспомогательное диагностическое значение имеют УЗИ лимфатических узлов, УЗИ слюнных желез, УЗИ печени и селезенки, УЗИ мошонки у мальчиков, рентгенография органов грудной клетки, КТ у детей (для выявления метастазов в различных анатомических регионах). Дифференциальную диагностику лейкозов у детей следует проводить с лейкозоподобной реакцией, наблюдаемой при тяжелых формах туберкулеза, коклюше, инфекционном мононуклеозе, цитомегаловирусной инфекции, сепсисе и имеющей обратимый транзиторный характер.
Лечение лейкоза у детей
Дети с лейкозами госпитализируются в специализированные учреждения онкогематологического профиля. В целях профилактики инфекционных осложнений ребенок помещается в отдельный бокс, условия в котором максимально приближенны к стерильным. Большое внимание уделяется питанию, которое должно быть полноценным и сбалансированным.
Основу лечения лейкозов у детей составляет полихимиотерапия, направленная на полную эрадикацию лейкозного клона. Протоколы лечения, используемые при острых лимфобластных и миелобластных лейкозах, различаются комбинацией химиопрепаратов, их дозами и способами введения. Поэтапное лечение острого лейкоза у детей предполагает достижение клинико-гематологической ремиссии, ее консолидацию (закрепление), поддерживающую терапию, профилактику или лечение осложнений.
В дополнение к химиотерапии может проводиться активная и пассивная иммунотерапия: введение лейкозных клеток, вакцины БЦЖ, противооспенной вакцины, интерферонов, иммунных лимфоцитов и др. Перспективными методами лечения лейкоза у детей служит трансплантация костного мозга, пуповинной крови, стволовых клеток.
Симптоматическая терапия при лейкозах у детей включает переливание эритроцитарной и тромбоцитарной массы, проведение гемостатической терапии, антибиотикотерапию инфекционных осложнений, дезинтоксикационные мероприятия (внутривенные инфузии, гемосорбцию, плазмосорбцию, плазмаферез).
Прогноз лейкоза у детей
Перспективы развития заболевания определяются многими факторами: возрастом возникновения лейкоза, цитоиммунологическим вариантом, стадией диагностирования и т. д. Худший прогноз следует ожидать у детей, заболевших острым лейкозом в возрасте до 2-х лет и старше 10-ти лет; имеющих лимфаденопатию и гепатоспленомегалию, а также нейролейкоз на момент установления диагноза; Т- и В-клеточные варианты лейкоза, бластный гиперлейкоцитоз. Прогностически благоприятными факторами служат острый лимфобластный лейкоз L1 типа, раннее начало лечения, быстрое достижение ремиссии, возраст детей от 2 до 10 лет. У девочек с острым лимфобластным лейкозом вероятность излечение несколько выше, чем у мальчиков.
Отсутствие специфического лечения лейкоза у детей сопровождается 100%-ной летальностью. На фоне современной химиотерапии пятилетнее безрецидивное течение лейкоза отмечается у 50-80% детей. О вероятном выздоровлении можно говорить после 6-7 лет отсутствия рецидива. Во избежание провокации рецидива детям не рекомендуется физиотерапевтическое лечение, изменение климатических условий. Вакцинопрофилактика проводится по индивидуальному календарю с учетом эпидемической ситуации.
Гемолитическая болезнь новорождённых что это за болезнь, каковы ее причины?
Гемолитическая болезнь новорождённых – это патологический процесс, который появляется при несовместимости белков крови женщины и плода по резус-фактору или системе АВ0. Данный патологический процесс ведёт к развитию анемии и желтухи новорождённых, но не является тяжёлой патологией при своевременном лечении. Дети, перенёсшие гемолитическую болезнь, могут иметь склонность к частым инфекционным заболеваниям, аллергическим реакциям.
Причины и факторы риска

Гемолитическая болезнь новорожденных проявляется желтушностью кожных покровов
Основным фактором развития гемолитической болезни новорождённых является резус-положительный плод и резус-отрицательная мать. Этого невозможно избежать при планировании беременности, поэтому тактику ее ведения надо выстраивать с учетом данного фактора.
Главный причинный фактор в патогенезе гемолитической болезни – это резус-конфликт в предыдущих родах.
Патогенез
Для гемолитической болезни новорождённых необходим пусковой механизм – это конфликт клеток крови мамы и ребёнка. Красные форменные элементы крови, то есть эритроциты плода, воспринимаются как чужие агенты иммунной системой мамы, из-за этого происходит интенсивная выработка антител для того, чтобы уничтожить чужие клетки.
Если у плода Rh-положительные красные клетки, а у матери Rh-отрицательные, то возникает резус-конфликт, так как её организм вырабатывает специальные антитела, способные проходить плацентарный барьер. Попадая в кровеносное русло ребёнка, антирезус-антитела связываются с белками рецепторов, которые расположены на эритроцитах и начинают уничтожать их. Из-за этого у плода уменьшается уровень гемоглобина и увеличивается уровень неконьюгированного билирубина, что приводит к формированию гемолитической желтухой новорождённых. Билирубин способен поражать клетки мозга и вызывать энцефалопатию, которая усугубляется нехваткой кислорода у плода. Помимо этого, неконьюгированный билирубин поражает печень, из-за чего в сыворотке крови увеличивается количество прямого билирубина, ведущего к застою желчи и воспалению печёночной ткани.
Из-за стремительного разрушения эритроцитов развивается гемолитическая анемия, что ведёт к нарушению функций кроветворения и газообмена тканей.
Клинические симптомы
Симптомы: изменение оттенка кожи, повышение температуры тела, осветление кала и потемнение мочи
Выделяют четыре основные формы течения гемолитической болезни новорождённых:
- Анемическая — развивается в 10-20% случаев, проявляется бледноватыми кожными покровами, изменением размеров печени и селезёнки, вялостью ребёнка, отсутствием аппетита, снижением физиологических рефлексов плода.
- Отёчный вариант является тяжёлой формой болезни, проявляется увеличением живота до больших размеров, выраженной отечностью тела, нарушением дыхания, анемией.
- Желтушное течение возникает в 90% случаев. При гемолитической желтухе появляется светлый кал и тёмная моча, кожа становится жёлтой с зеленоватым оттенком, из-за интоксикации повышается температура тела, общее состояние ребёнка ухудшается.
- Летальный исход внутриутробно.
Диагностика
Диагностика: контроль уровня билирубина в крови
Выделяют два вида диагностики данного заболевания: до и после родов.
- Правильно собранный акушерский и гинекологический анамнез – количество прерываний беременности, гемотрансфузии.
- Определение резус-фактора и группы крови обоих родителей.
- Пунктирование пузыря с дальнейшим исследованием состава околоплодной жидкости с определением плотности, уровня белка, минералов, эстрогенов, билирубина.
- Определение количества IgM с помощью иммунологического мониторинга.
- Ультразвуковое исследование плода. При резус-конфликте у ребёнка выявляется гепатоспленомегалия, асцит, специфическая поза Будды. При осмотре плаценты может наблюдаться ее утолщение.
Постнатальная диагностика проводится с первых часов жизни ребёнка:
- Наличие клинических симптомов: желтушность или побледнение кожных покровов, изменение цвета кала и мочи, ухудшение общего самочувствия ребёнка, неврологическая симптоматика, увеличение размеров селезёнки и печени.
- Определение группы крови по AB0 и Rh новорождённого.
- Уровень общего билирубина в динамике и почасовой прирост.
- Общий развёрнутый анализ крови: уменьшение уровня гемоглобина, эритроцитов и тромбоцитов, появление молодых ретикулоцитов и незначительное увеличение лейкоцитов.
- Реакция Кумбса позволяет выявить антирезусные антитела к белкам эритроцитов ребёнка.
- Иммунологический тест выявляет увеличение в крови IgM и IgA.
- Определение аллогемагглютинина в сыворотке крови и молоке мамы.
Лечение
Лечение: фототерапия для преобразования непрямого билирубина в водорастворимый
В зависимости от тяжести состояния новорождённого определяют метод медицинской помощи.
Консервативная терапия применяется при лёгком и среднем течении болезни:
- Дезинтоксикационная терапия необходима для выведения из организма ребёнка токсических веществ. Для этого внутривенно вводятся сорбенты, белковые препараты и глюкозо-солевые растворы.
- Для поддержания функции печени назначаются гепатопротекторы, витамины и антиоксиданты.
- Использование фототерапии с лампами зелёного, синего, белого, голубого цвета ведёт к превращению токсического билирубина в кожных покровах в водорастворимый билирубин, который выводится почками.
- Очистительные клизмы в первые минуты после рождения ребёнка. Это необходимо для удаления из кишечника мекония с высоким содержанием билирубина.
При средне-тяжёлом или тяжёлом течение гемолитической болезни срочно требуется:
- Переливание крови, которое позволяет постепенно удалить токсичный билирубин и антитела матери с помощью введения крови донора. Для данной процедуры используют эритроцитарную массу и свежезамороженную плазму.
- Плазмаферез — для удаления антител из плазмы крови.
- Гемосорбция при тяжёлом течении — производится фильтрация крови от токсинов через сорбенты.
Лечение проводится под контролем жизненно-важных показателей. В редких случаях могут возникнуть осложнения: портальная гипертензия, перфорация пупочной вены и кишечника, омфалит, анафилактический шок, тромбоэмболия, сердечная недостаточность, сепсис.
Прогноз
Невозможно предусмотреть последствия гемолитической болезни новорождённых, так как она может протекать как в лёгкой, так и в тяжёлой форме.
При лёгкой форме дети развиваются без особых отклонений. В старшем возрасте иногда наблюдается рахит, астеновегетативный синдром, аллергические реакции.
Тяжёлая форма опасна, может привести к гибели новорождённого или внутриутробной летальности на поздних сроках беременности. Осложнённая гемолитическая болезнь проявляется церебральным параличом, нарушением зрения, слуха, задержкой роста и развития ребёнка.
Дети, которые перенесли гемолитическую болезнь новорождённых, подлежат диспансерному наблюдению в течение 6 месяцев. Таким детям рекомендуется получить консультацию специалистов – невропатолога и иммунолога, а вакцинацию БЦЖ им проводят через 3 месяца.
Профилактика
К основным мерам профилактики относятся — устранение факторов риска и причин, которые могут спровоцировать тяжёлую патологию плода.
Так как главный причинный фактор в патогенезе гемолитической болезни – это резус-конфликт в предыдущих родах, то родившей женщине в течение 24 часов после появления на свет малыша нужно ввести иммуноглобулин анти –D. Благодаря этой сыворотке эритроциты плода выводятся из организма мамы, а новые антитела не образуются при следующей беременности.
Если выявлен резус-конфликт, то беременная женщина должна состоять на особом учёте у акушера-гинеколога. Для профилактики назначаются гормональные, антигистаминные, дезинтоксикационные и витаминные препараты. Также могут проводить специфическую гипосенсибилизацию по назначению врача.
Для того чтобы избежать тяжёлых последствий и осложнений, необходимо соблюдать все рекомендации гинеколога, своевременно проходить обследования.

* Представленная информация не может быть использована для самостоятельной постановки диагноза, определения лечения и не заменяет обращение к врачу!
Источник https://nii-onco.ru/rak-u-detej/lejkozy-u-detej-simptomy-diagnostika-lechenie/
Источник https://www.krasotaimedicina.ru/diseases/children/leucosis
Источник https://www.baby.ru/wiki/gemoliticeskaa-bolezn-novorozdennyh-cto-eto-za-bolezn-kakovy-ee-priciny/