Документы и приказы: Эозинофильный эзофагит: клинические рекомендации РГА
Ознакомить практикующих врачей с диагностикой и лечением эозинофильного эзофагита.
Основные положения.
Эозинофильный эзофагит (ЭоЭ) — это хроническое иммуноопосредованное заболевание пищевода, характеризующееся симптомами эзофагеальной дисфункции и выраженной эозинофильной инфильтрацией слизистой оболочки органа.
Диагностика ЭоЭ основывается на
- · данных клинической картины заболевания (дисфагия, эпизоды вклинения пищи в пищевод, боль в грудной клетке без связи с глотанием), а также
- · на совокупности эндоскопических и гистологических признаков.
Критерием установления диагноза служит эозинофильная инфильтрация слизистой оболочки пищевода с плотностью эозинофилов ≥ 15 в поле зрения микроскопа при большом увеличении (×400) по крайней мере в одном из биоптатов (около 60 эозинофилов в мм2).
Вспомогательное значение для диагноза имеют:
- · исследование общего IgE,
- · эозинофилия периферической крови,
- · результаты кожных аллергопроб
Для лечения ЭоЭ используется несколько подходов, включающих применение
- · ингибиторов протонной помпы (ИПП),
- · топических глюкокортикостероидов (ГКС), а также
- · элиминационные диеты.
Выбор терапии должен быть индивидуализированным, с обязательной оценкой эффективности инициального курса через 6–12 недель при эзофагогастродуоденоскопии с забором биоптатов.
Эндоскопическая дилатация должна рассматриваться у пациентов, страдающих выраженной дисфагией на фоне сужения пищевода.
Рост заболеваемости ЭоЭ в сочетании с преимущественным поражением детей и лиц молодого возраста, хроническое течение заболевания с необходимостью длительной поддерживающей терапии делают ЭоЭ значимой проблемой гастроэнтерологической практики.
Аннотация:
Введение:

Enter the password to open this PDF file:
Полный текст статьи:
Вам может быть интересно:
Список литературы:
Литература / References 1. Трухманов А.С., Ивашкина Н.Ю. Эозинофильный эзофагит. В кн. Ивашкин В.Т. (ред.) Рациональная фармакотерапия заболеваний органов пищеварения. 2-е изд. М.: Литерра, 2011. С. 267–9 [Trukhmanov A.S., Ivashkina N.Yu. Eosinophilic esophagitis. In: Ivashkin V.T. (ed.) Rational pharmacotherapy of digestive system diseases. 2nd ed. Moscow: Literra, 2011. P. 267–9 (In Rus.)]. 2. Ивашкин В.Т., Баранская Е.К., Кайбышева В.О., Иванова Е.В. и др. Эозинофильный эзофагит: обзор литературы и описание собственного наблюдения. Рос журн гастроэнт гепатол колопроктол. 2012;22(1):71–81 [Ivashkin V.T., Baranskaya E.K., Kaibysheva V.O., Ivanova E.V. et al. Eosinophilic esophagitis: A literature review and the description of the authors’ experience. Russian Journal of Gastroenterology, Hepatology, Coloproctology. 2012;22(1):71–81 (In Rus.)]. 3. Lucendo A.J., Molina-Infante J., Arias Á. et al. Guidelines on eosinophilic esophagitis: evidence-based statements and recommendations for diagnosis and management in children and adults. United European Gastroenterol J. 2017;5(3):335–58. DOI: 10.1177/2050640616689525 4. Dellon E.S., Gonsalves N., Hirano I. et al. ACG clinical guideline: evidenced based approach to the diagnosis and management of esophageal eosinophilia and eosinophilic esophagitis. Am J Gastroenterol. 2013;108:679–92. 5. Cianferoni A., Spergel J.M., Muir A. Recent advances in the pathological understanding of eosinophilic esophagitis. Expert Rev Gastroenterol Hepatol. 2015;9(12):1501–10. DOI: 10.1586/17474124.2015.1094372 6. Hill D.A., Spergel J.M. The Immunologic Mechanisms of Eosinophilic Esophagitis. Curr Allergy Asthma Rep. 2016;16(2):9. DOI: 10.1007/s11882-015-0592-3 7. Spergel J.M. New genetic links in eosinophilic esophagitis. Genome Med. 2010;2(9):60. 8. Dellon E.S., Hirano I. Epidemiology and Natural History of Eosinophilic Esophagitis. Gastroenterology. 2018;154(2):319–32.e3. DOI: 10.1053/j.gastro.2017.06.067 9. Параскевова А.В., Шелковникова И.И., Лапина Т.Л., Трухманов А.С. и др. Пациент 68 лет и пациентка 52 лет с эозинофильной инфильтрацией пищевода. Рос журн гастроэнт гепатол колопроктол 2017;27(4):62–74 [Paraskevova A.V., Shelkovnikova I.I., Lapina T.L., Trukhmanov A.S. et al. Two cases of eosinophilic infiltration of the esophagus: 68 year-old male and 52 year-old female patients. Ross z gastroenterol gepatol koloproktol. 2017;27(4):62–74 (In Rus.)]. DOI: 10.22416/1382-4376- 2017-27-4-62-74 10. Dellon E.S. Epidemiology of eosinophilic esophagitis. Gastroenterol Clin North Am. 2014;43:201–18. 11. Prasad G.A., Alexander J.A., Schleck C.D. et al. Epidemiology of eosinophilic esophagitis over three decades in Olmsted County, Minnesota. Clin Gastroenterol Hepatol. 2009;7:1055–61. 12. Kapel R.C., Miller J.K., Torres C. et al. Eosinophilic esophagitis: a prevalent disease in the United States that affects all age groups. Gastroenterology. 2008;134:1316–21. 13. Castro Jimenez A., Gomez Torrijos E., Garcia Rodriguez R. et al. Demographic, clinical and allergological characteristics of Eosinophilic Esophagitis in a Spanish central region. Allergol Immunopathol (Madr). 2014;42:407–14. 14. van Rhijn B.D., Verheij J., Smout A.J. et al. Rapidly increasing incidence of eosinophilic esophagitis in a large cohort. Neurogastroenterol Motil. 2013;25:47–52. 15. Arias A., Perez-Martinez I., Tenias J.M. et al. Systematic review with meta-analysis: the incidence and prevalence of eosinophilic oesophagitis in children and adults in population-based studies. Aliment Pharmacol Ther. 2016;43:3–15. 16. González-Cervera J., Arias Á., Redondo-González O. et al. Association between atopic manifestations and eosinophilic esophagitis: a systematic review and meta-analysis. Ann Allergy Asth Immunol. 2017;118(5):582–90.e2. DOI: 10.1016/j.anai.2017.02.006 17. Remedios M., Campbell C., Jones D.M. et al. Eosinophilic esophagitis in adults: clinical, endoscopic, histologic findings, and response to treatment with fluticasone propionate. Gastrointest Endosc. 2006;63:3–12. 18. Croese J., Fairley S.K., Masson J.W. et al. Clinical and endoscopic features of eosinophilic esophagitis in adults. Gastrointest Endosc. 2003;58:516–22. 19. Spergel J.M., Brown-Whitehorn T.F., Beausoleil J.L. et al. 14 years of eosinophilic esophagitis: clinical features and prognosis. J Pediatr Gastroenterol Nutr. 2009;48:30–6. 20. Dellon E.S., Speck O., Woodward K. et al. Distribution and variability of esophageal eosinophilia in patients undergoing upper endoscopy. Mod Pathol. 2015;28:383–90. 21. Fiocca R., Mastracci L., Engström C. et al. Long-term outcome of microscopic esophagitis in chronic GERD patients treated with esomeprazole or laparoscopic antireflux surgery in the LOTUS trial. Am J Gastroenterol. 2010;105:1015–23. 22. Dellon E.S., Liacouras C.A., Molina-Infante J., Furuta G.T. et al. Updated International Consensus Diagnostic Criteria for Eosinophilic Esophagitis: Proceedings of the AGREE Conference. Gastroenterology. 2018;155(4):1022– 33.e10. DOI: 10.1053/j.gastro.2018.07.009 23. Lucendo A.J., Arias A., Tenias J.M. Relation between eosinophilic esophagitis and oral immunotherapy for food allergy: a systematic review with meta-analysis. Ann Allergy Asthma Immunol. 2014;113(6):624–9. DOI: 10.1016/j.anai.2014.08.004 24. Schlag C., Miehlke S., Heiseke A., Brockow K. et al. Peripheral blood eosinophils and other non-invasive biomarkers can monitor treatment response in eosinophilic oesophagitis. Aliment Pharmacol Ther. 2015 Nov;42(9):1122–30. DOI: 10.1111/apt.13386 25. Hines B.T., Rank M.A., Wright B.L., Marks L.A. et al. Minimally invasive biomarker studies in eosinophilic esophagitis: A systematic review. Ann Allergy Asthma Immunol. 2018;121(2):218–28. DOI: 10.1016/j.anai.2018.05.005 26. Pelz B.J., Wechsler J.B, Amsden K., Johnson К. et al. IgE-associated food allergy alters the presentation of pediatric eosinophilic esophagitis. Clin Exp Allergy. 2016;46(11):1431–40. 27. Hirano I., Moy N., Heckman M.G. et al. Endoscopic assessment of the oesophageal features of eosinophilic oesophagitis: validation of a novel classification and grading system. Gut. 2013;62:489–95. 28. Kim H.P., Vance R.B., Shaheen N.J. et al. The prevalence and diagnostic utility of endoscopic features of eosinophilic esophagitis: a meta-analysis. Clin Gastroenterol Hepatol. 2012;10:988–96. 29. Hirano I. Role of advanced diagnostics for eosinophilic esophagitis. Dig Dis. 2014;32(1–2):78–83. 30. Liacouras C.A., Spergel J.M., Ruchelli E. et al. Eosinophilic esophagitis: A 10-year experience in 381 children. Clin Gastroenterol Hepatol. 2005;3:1198–206. 31. Saffari H., Peterson K.A., Fang J.C. et al. Patchy eosinophil distributions in an esophagectomy specimen from a patient with eosinophilic esophagitis: Implications for endoscopic biopsy. J Allergy Clin Immunol. 2012;130:798– 800. 32. Nielsen J.A., Lager D.J., Lewin M. et al. The optimal number of biopsy fragments to establish a morphologic diagnosis of eosinophilic esophagitis. Am J Gastroenterol. 2014;109:515–20. 33. Salek J., Clayton F., Vinson L. et al. Endoscopic appearance and location dictate diagnostic yield of biopsies in eosinophilic oesophagitis. Aliment Pharmacol Ther. 2015;41:1288–95. 34. Dellon E.S., Speck O., Woodward K. et al. Distribution and variability of esophageal eosinophilia in patients undergoing upper endoscopy. Mod Pathol. 2015;28:383–90. 35. Kim H.P., Dellon E.S. An Evolving Approach to the Diagnosis of Eosinophilic Esophagitis. Gastroenterol Hepatol (N Y). 2018 Jun;14(6):358–66. 36. Saffari H., Hoffman L.H., Peterson K.A. et al. Electron microscopy elucidates eosinophil degranulation patterns in patients with eosinophilic esophagitis. J Allergy Clin Immunol. 2014;133:1728–34. 37. Capocelli K.E., Fernando S.D., Menard-Katcher C. et al. Ultrastructural features of eosinophilic oesophagitis: impact of treatment on desmosomes. J Clin Pathol. 2015;68:51–6. 38. Collins M.H. Histopathologic features of eosinophilic esophagitis and eosinophilic gastrointestinal diseases. Gastroenterol Clin North Am. 2014;43:257–68. 39. Anyane-Yeboa A., Wang W., Kavitt R.T. The Role of Allergy Testing in Eosinophilic Esophagitis. Gastroenterol Hepatol (N Y). 2018 Aug;14(8):463–9. 40. Syed A., Maradey-Romero C., Fass R. The relationship between eosinophilic esophagitis and esophageal cancer. Dis Esophagus. 2017;30(7):1–5. DOI: 10.1093/dote/ dox050 41. Lucendo A.J., Arias A., Molina-Infante J. Efficacy of proton pump inhibitor drugs for inducing clinical and histologic remission in patients with symptomatic esophageal eosinophilia: a systematic review and meta-analysis. Clin Gastroenterol Hepatol. 2016;14:13–22. 42. Molina-Infante J., Ferrando-Lamana L., Ripoll C. et al. Esophageal eosinophilic infiltration responds to proton pump inhibition in most adults. Clin Gastroenterol Hepatol. 2011;9:110–7. 43. Liacouras C.A., Furuta G.T., Hirano I. et al. Eosinophilic esophagitis: updated consensus recommendations for children and adults. J Allergy Clin Immunol. 2011;128:3– 20. 44. Gómez-Torrijos E., García-Rodríguez R., CastroJiménez A. et al. The efficacy of step-down therapy in adult patients with proton pump inhibitor-responsiveoesophageal eosinophilia. Aliment Pharmacol Ther. 2016 Feb;43(4):534–40. DOI: 10.1111/apt.13496 45. Schaefer E.T., Fitzgerald J.F., Molleston J.P. et al. Comparison of oral prednisone and topical fluticasone in the treatment of eosinophilic esophagitis: a randomized trial in children. Clin Gastroenterol Hepatol. 2008;6:165–73. 46. Tan N. Di, Xiao Y.L., Chen M.H. Steroids therapy for eosinophilic esophagitis: Systematic review and meta-analysis. J Dig Dis. 2015;16:431–42. 47. Sawas T., Dhalla S., Sayyar M. et al. Systematic review with meta-analysis: pharmacological interventions for eosinophilic oesophagitis. Aliment Pharmacol Ther. 2015;41:797–806. 48. Murali A.R., Gupta A., Attar B.M. et al. Topical steroids in eosinophilic esophagitis: systematic review and metaanalysis of placebo controlled randomized clinical trials. J Gastroenterol Hepatol. 2015;31:1111–9. 49. Chuang M.-Y.A., Chinnaratha M.A., Hancock D.G. et al. Topical steroid therapy for the treatment of eosinophilic esophagitis (EoE): a systematic review and metaanalysis. Clin Transl Gastroenterol. 2015;6:e82. 50. Straumann A., Conus S., Degen L. et al. Long-term budesonide maintenance treatment is partially effective for patients with eosinophilic esophagitis. Clin Gastroenterol Hepatol. 2011;9:400–9. 51. Greuter T., Safroneeva E., Bussmann C. et al. Maintenance Treatment Of Eosinophilic Esophagitis With Swallowed Topical Steroids Alters Disease Course Over A 5-Year Follow-Up Period In Adult Patients. Clin Gastroenterol Hepatol. 2018:S1542-3565(18)30598-6. DOI: 10.1016/j.cgh.2018.05.045 52. Eluri S., Runge T.M., Hansen J. et al. Diminishing Effectiveness of Long-Term Maintenance Topical Steroid Therapy in PPI Non-Responsive Eosinophilic Esophagitis. Clin Transl Gastroenterol. 2017;8(6):e97. DOI: 10.1038/ctg.2017.27 53. Moawad F.J., Cheatham J.G., DeZee K.J. Meta-analysis: the safety and efficacy of dilation in eosinophilic oesophagitis. Aliment Pharmacol Ther. 2013;38:713–20. 54. Kagalwalla A.F., Sentongo T.A., Ritz S. et al. Effect of six-food elimination diet on clinical and histologic outcomes in eosinophilic esophagitis. Clin Gastroenterol Hepatol. 2006;4:1097–102. 55. Arias A., Gonzalez-Cervera J., Tenias J.M. et al. Efficacy of dietary interventions for inducing histologic remission in patients with eosinophilic esophagitis: a systematic review and meta-analysis. Gastroenterology. 2014;146:1639–48. 56. Molina-Infante J., Arias A., Barrio J. et al. Four-food group elimination diet for adult eosinophilic esophagitis: A prospective multicenter study. J Allergy Clin Immunol. 2014;134:1093–99. 57. Molina-Infante J., Modolell I., Alcedo J. et al. Step-up empiric elimination diet for pediatric and adult eosinophilic esophagitis: the 2–4–6 study. United Eur Gastroenterol J. 2016;(Suppl 5):A126. 58. Gonsalves N., Yang G.-Y., Doerfler B. et al. Elimination diet effectively treats eosinophilic esophagitis in adults; food reintroduction identifies causative factors. Gastroenterology. 2012;142:1451–5. 59. Lucendo A.J., Arias A., Gonzalez-Cervera J. et al. Empiric 6-food elimination diet induced and maintained prolonged remission in patients with adult eosinophilic esophagitis: a prospective study on the food cause of the disease. J Allergy Clin Immunol. 2013;131:797–804. 60. Kagalwalla A.F., Shah A., Li B.U.K. et al. Identification of specific foods responsible for inflammation in children with eosinophilic esophagitis successfully treated with empiric elimination diet. J Pediatr Gastroenterol Nutr. 2011;53:145–9. 61. Safroneeva E., Straumann A., Coslovsky M. et al. Symptoms have modest accuracy in detecting endoscopic and histologic remission in adults with eosinophilic esophagitis. Gastroenterology. 2016;150:581–90.
Эозинофильный эзофагит
Эозинофильный эзофагит — это хронический иммуноопосредованный воспалительный процесс, который характеризуется резко выраженной эозинофильной инфильтрацией слизистой оболочки пищевода. Патология проявляется затруднениями проглатывания твердой пищи, загрудинными болями, периодически возникающей рвотой. Для диагностики эзофагита используется эндоскопическое обследование с биопсией, гистологический анализ биоптатов. Для уточнения диагноза проводится исследование крови и мочи, иммунограмма. Лечение предполагает комбинацию индивидуально подобранной диеты с назначением топических стероидов и ингибиторов протонной помпы.
МКБ-10
Общие сведения
Эозинофильный эзофагит (ЭоЭ) — вторая по частоте выявления патология пищевода после ГЭРБ. Манифестирует в любом возрасте, но чаще встречается у школьников (средний возраст пациентов — 9 лет) и у людей среднего возраста (около 38-40 лет). В 75-82% ЭоЭ развивается у мужчин. Распространенность эозинофильного эзофагита на 10 тыс. населения у детей составляет 10,5 случаев, у взрослых — около 4,5 случаев. За последние 20 лет ученые отмечают рост заболеваемости в 70 раз, что обуславливает высокую медико-социальную значимость болезни.

Причины
Заболевание относится к иммунным антигенопосредованным поражениям слизистого слоя ЖКТ, но его этиологические факторы до конца не определены. Существует мнение, что патология выступает как проявление общей атопической реакции организма. В современной гастроэнтерологии принята концепция, согласно которой выделяют 3 группы причин эозинофильного эзофагита:
- Генетические особенности. Доказана ассоциация болезни с генами, которые кодируют синтез стромального лимфопоэтина и эотаксина-3. У больных эозинофильным эзофагитом количество эотаксина-3 в эзофагеальной слизистой в 50 раз превышает норму, что способствует повышенной миграции эозинофилов к пищеводу. Семейный характер патологии наблюдается у 14,5% пациентов.
- Поражение эзофагеальной слизистой. Началу аутоиммунного эзофагита способствуют длительно протекающие воспалительные процессы в пищеводе или аномалии строения эпителиальной оболочки. Эти причины обуславливают быстрое и глубокое проникновение чужеродных антигенов в толщу стенки пищевода.
- Сенсибилизация к аллергенам. Попадание специфических для конкретного индивидуума пищевых или пылевых антигенов — пусковой фактор эозинофильного воспаления. Аллергены запускают каскад биохимических реакций и активируют иммунное воспаление в эзофагеальной стенке.
Факторы риска
Вероятность развития эозинофильного эзофагита возрастает при наличии у человека других аллергических заболеваний:
- атопического дерматита;
- бронхиальной астмы;
- поллиноза.
Установлена повышенная заболеваемость среди пациентов с наследственными поражениями соединительной ткани (синдромы Элерса-Данлоса, Марфана). К независимым факторам риска относят потребление ГМО-продуктов, повсеместное и неоправданное использование антибиотиков. Вероятность появления эзофагита увеличивается при проживании в регионах с неблагоприятной экологической ситуацией.
Патогенез
Патофизиологической основой эозинофильного эзофагита является миграция вглубь пищеводной слизистой эозинофилов — клеток лейкоцитарного ряда, которые в норме там отсутствуют. Под действием аллергенов происходит активация Т-лимфоцитов, индукция синтеза специфических провоспалительных интерлейкинов 4, 5 и 13. Эти вещества влияют на эпителий и усиливают выработку эотаксина-3.
Как следствие усиливается хемотаксис эозинофилов из периферической крови в эзофагеальную слизистую, повышается их пролиферация в костном мозге. Эозинофилы выделяют биологически активные вещества — МВР, катионные белки, пероксидазу и нейротоксин. Следующим этапом эозинофильного воспалительного процесса становится выброс гистамина и цитокинов, которые оказывают прямое повреждающее действие на пищевод.
Симптомы эозинофильного эзофагита
У детей дошкольного возраста заболевание проявляется трудностями с кормлением. Периодически по окончании приема пищи появляются срыгивание или рвота. Дети отказываются от еды, становятся нервными и беспокойными. Из-за сложностей с проглатыванием ребенок предпочитает жидкую или полужидкую пищу, длительно пережевывает каждый кусочек. Наблюдается медленный набор веса, отставание в росте и физическом развитии.
Школьники и подростки, страдающие эозинофильным эзофагитом, жалуются на изжогу, умеренные боли за грудиной. Возникает необходимость запивать водой любую твердую пищу, что облегчает глотание. Ребенок ест очень медленно, обычно оставляет половину порции на тарелке. Некоторые подростки сообщают о чувстве «застревания» еды в пищеводе, дискомфорте в верхних отделах живота. При попытке быстрого поглощения пищи начинается рвота.
У взрослых людей клиническая картина схожа, но в связи с длительным течением эозинофильного эзофагита симптомы выражены сильнее. Больные предъявляют жалобы на мучительные давящие или распирающие боли по ходу пищевода, которые беспокоят после еды. Дисфагия наблюдается постоянно, возникают сложности с употреблением даже полужидкой пищи. Неприятные симптомы провоцируют повышенную нервозность и раздражительность.
Осложнения
Опасное последствие эозинофильного эзофагита — острый разрыв пищевода (синдром Бурхаве), обусловленный обтурацией органа большим пищевым комком. Это состояние сопровождается подкожной эмфиземой, болевым шоком. На фоне разрыва иногда начинаются профузные кровотечения в виде кровавой рвоты, которые опасны геморрагическим шоком и без оказания медицинской помощи имеют неблагоприятный исход.
При длительном существовании эозинофильного воспаления в стенке органа образуется соединительная ткань. Фиброз проявляется стриктурами и стенозом пищевода, что усугубляет клиническую картину заболевания. Персистирующие воспалительные процессы являются предпосылкой для метаплазии эпителиальных клеток, поэтому наличие эозинофильного эзофагита сопряжено с риском появления злокачественных опухолей.
Диагностика
При первичной консультации врач-гастроэнтеролог использует несколько опросников для оценки частоты и тяжести симптомов. При физикальном обследовании эозинофильный эзофагит ничем не отличается от ГЭРБ. В пользу первого заболевания говорит отягощенный аллергологический анамнез. Для верификации диагноза обязательно проводится комплекс лабораторно-инструментальных методов, включающий:
- Эзофагоскопия. При эндоскопическом осмотре органа обнаруживают отек и контактную кровоточивость слизистой, продольные линейные борозды. Зачастую видны эозинофильные микроабсцессы, имеющие вид островков беловатого экссудата. У взрослых также визуализируются фиброзные изменения — концентрические кольца, стриктуры.
- Гистологическое исследование. Микроскопия более 6 биоптатов из разных участков эзофагеальной слизистой — золотой стандарт диагностики. В эпителии и подслизистом слое наблюдаются скопления эозинофилов и микроабсцессы. Для эозинофильного эзофагита характерно расширение межклеточных промежутков и фиброз наружного слоя оболочки.
- Лабораторные анализы. В общем анализе крови наблюдается эозинофилия, степень которой соотносится с тяжестью клинических проявлений болезни. В иммунограмме характерно повышение уровня IgE, эотаксина-3 и отдельных фракций интерлейкинов. В анализе мочи выявляют биомаркер 3-бромтирозин, который отражает активность эозинофилов.
- Малоинвазивные методы. В некоторых клиниках проводится String Test, который предполагает заглатывание специальной капсулы с последующим ее извлечением и анализом адсорбированных эозинофильных ферментов. Для малотравматичного забора образцов слизистого слоя используется цитогубка.
Лечение эозинофильного эзофагита
Консервативная терапия
Первый этап лечения — подбор рациона питания. Элементная диета с приемом аминокислотных смесей назначается редко, поскольку зачастую плохо переносится больными. Чаще прибегают к таргетной диете, которая предполагает исключение из рациона индивидуальных пищевых аллергенов. До проведения специфических тестов показана эмпирическая элиминационная диета, предусматривающая ограничение наиболее распространенных аллергизирующих веществ.
Эффективность диетотерапии составляет около 53% у детей и около 40% у взрослых. Если клинические проявления не удается купировать немедикаментозными способами, используют лекарственные препараты. Для лечения эозинофильного эзофагита рекомендована длительная поддерживающая терапия, которая в несколько раз снижает вероятность обострения. Схема включает:
- Топические кортикостероиды. Гормоны в форме аэрозоля относятся к первой линии терапии. Они уменьшают выраженность симптоматики, продлевают гистологическую ремиссию при эзофагите.
- Ингибиторы протонной помпы. Эффективность ИПП обусловлена повышением барьерной функции слизистой оболочки, что затрудняет проникновение аллергенов. Клиническое улучшение после добавления препаратов в схему лечения испытывают 80% больных.
Хирургическое лечение
К эндоскопическим методам прибегают при сужении пищеводного просвета до 13 мм и менее. Хирургические вмешательства в основном рекомендуются взрослым. Для снижения явлений дисфагии показана эндоскопическая баллонная дилатация или бужирование пищевода. Вмешательство выполняется в плановом порядке после стихания активности процесса в результате проведения медикаментозной терапии.
Экспериментальное лечение
На сегодняшний день существует успешный опыт применения моноклональных антител к интерлейкинам для редукции симптоматики и уменьшения эозинофильной инфильтрации. В клинических испытаниях установлена высокая эффективность препаратов для купирования дисфагии. Хорошие результаты наблюдаются при назначении селективных антител к ИЛ-13, эффект которых продолжается дольше 6 месяцев.
Прогноз и профилактика
Благодаря разработке новых методов терапии эозинофильного эзофагита стойкой ремиссии удается добиться у 80-90% больных. Прогноз благоприятный: большинство пациентов, которым правильно подобрано лечение, отмечают улучшение качества жизни и возвращение к привычному ритму активности. Профилактика включает раннее выявление и лечение атопических патологий, устранение пищевых и экологических факторов риска.
1. Эозинофильный эзофагит: современный взгляд на проблему и собственные клинические наблюдения/ В.О. Кайбышева, С.В. Кашин, Л.М. Михалева, Н.С. Сидяева и др.// Доказательная гастроэнтерология. — 2019.
2. Эозинофильный эзофагит у детей/ Т.Н. Будкина, И.С. Садиков, С.Г. Макарова, М.М. Лохматов и др.// Вопросы современной педиатрии. — 2016.
3. Эозинофильный эзофагит: учебное пособие для врачей / В.Т. Ивашкин, Е.К. Баранская, А.С. Трухманов, В.О. Кайбышева. — 2013.
4. ACG Clinical Guideline: Evidenced Based Approach to the Diagnosis and Management of Esophageal Eosinophilia and Eosinophilic Esophagitis (EoE). — 2013.
Клинические рекомендации по диагностике и лечению эозинофильного эзофагита
Непрерывно меняющиеся условия существования современного человека, технологический прогресс, модернизация сельского хозяйства, нацеленная на увеличение производительности, появление генетически модифицированных продуктов, неблагоприятная экологическая ситуация, повсеместное применение антибактериальных препаратов оказывают неизбежное влияние на изменение структуры заболеваемости.
Все чаще врачи-клиницисты и ученые медики сталкиваются с некогда редкими или неизвестными нозологиями. Одним из таких заболеваний является эозинофильный эзофагит (ЭоЭ) — хроническое иммуновоспалительное заболевание пищевода с неизвестной этиологией и клинической картиной, во многом напоминающей гастроэзофагеальную рефлюксную болезнь (ГЭРБ) [1].
В ряде заболеваний пищевода в странах Европы и в США ЭоЭ уже несколько десятилетий занимает второе по распространенности место после ГЭРБ. ЭоЭ является главной причиной дисфагии и острых эпизодов вклинения пищи в пищевод у детей и лиц молодого возраста.
Первые описания эозинофилии пищевода были опубликованы в 70-х годах прошлого века (Р. Лэндерс), в начале 90-х годов ЭоЭ был выделен в отдельный клинико-морфологический синдром [2—4], характеризующийся дисфагией на фоне персистирующего эозинофильного воспаления (более 15 эозинофилов в поле зрения при увеличении ×400) в толще слизистой оболочки и подслизистого слоя пищевода.
С момента выделения ЭоЭ в отдельную нозологическую форму частота установления диагноза «эозинофильный эзофагит» стала нарастать в экспоненциальной прогрессии, что привело к лавинообразному увеличению числа научных публикаций и распространенности этого заболевания. В дальнейшем накопленные данные о клинических, эндоскопических и гистологических особенностях нового заболевания нашли свое отражение в нескольких экспертных документах и клинических рекомендациях европейских и американских научных обществ (2007, 2011, 2013, 2014 гг.) по диагностике и лечению ЭоЭ у детей и взрослых [5—8].
Определение
ЭоЭ — хроническое, медленно прогрессирующее иммуноопосредованное заболевание пищевода, характеризующееся выраженным эозинофильным воспалением слизистой оболочки пищевода, развитием подслизистого фиброза, клинически проявляющееся нарушением глотания (дисфагия, обтурация пищевода пищевым комком, рвота проглоченной пищей и др.) [1, 9, 10].
Этиология и патогенез
С патофизиологической точки зрения ЭоЭ — это хроническое Th2-ассоциированное заболевание пищевода, характеризующееся развитием выраженного эозинофильного воспаления (более 15 эозинофилов в поле зрения микроскопа высокого разрешения с увеличением ×400) в слизистой оболочке пищевода и подслизистого фиброза, клинически проявляющееся дисфункцией пищевода (затруднения при приеме пищи у детей (рвота, поперхивание, отказ от еды) и дисфагия у подростков и взрослых).
В формировании ЭоЭ имеет место патогенетическое влияние трех групп факторов [9,11]:
— генетическая предрасположенность к развитию иммунного ответа (при контакте с чужеродными антигенами) по пути активации Т-хелперов 2-го типа (Th2);
— нарушение барьерной функции слизистой оболочки пищевода (воспаление, расширение межклеточных пространств, нарушение синтеза белков плотных контактов), способствующее более глубокой пенетрации антигенов в толщу слизистой оболочки;
— сенсибилизация к воздушным и пищевым антигенам.
Клиническая картина
ЭоЭ является медленно прогрессирующим заболеванием, в связи с чем характер и выраженность жалоб значительно отличаются в зависимости от возраста больного и длительности анамнеза заболевания (табл. 1)

Таблица 1. Симптомы ЭоЭ у детей и взрослых [15] [12—14].
Симптомы у детей раннего возраста неспецифичны и включают срыгивания, тошноту и рвоту, возникающие во время еды, затруднения при проглатывании определенной пищи (морепродукты, яйца, орехи и др.), боли в животе, отставание в физическом развитии (редко).
Дети подросткового возраста предъявляют жалобы, более характерные для ГЭРБ: на изжогу, боли за грудиной, необходимость длительно пережевывать пищу и запивать ее водой («медленно едящие и много пьющие» пациенты).
Взрослые пациенты страдают от симптомов, свидетельствующих о прогрессирующем сужении просвета пищевода: дисфагия, загрудинные боли и эпизоды вклинения пищи в пищевод. Описаны также случаи спонтанного разрыва пищевода, возникшие у больных ЭоЭ на фоне обтурации пищевым комком (синдром Бурхаве, Boerhaave’s Syndrome) [15—19].
Дисфагия у больных ЭоЭ может возникать остро (при застревании пищевого комка твердой консистенции) или беспокоить пациентов постоянно, вынуждая изменять пищевое поведение.
У взрослых пациентов эпизоды острой дисфагии возникают чаще вследствие длительно текущего воспалительного процесса с развитием стенозов и стриктур пищевода, в связи с чем приступ острой обтурационной дисфагии, случившийся на фоне полного здоровья, должен насторожить врача в отношении возможного диагноза ЭоЭ. Необходимо помнить, что ЭоЭ является наиболее распространенной причиной острой обтурационной дисфагии у взрослых [9]!
Небольшая доля больных детского возраста, несмотря на отсутствие у них склеротических изменений пищевода, также может испытывать остро возникающие симптомы дисфагии, которые обусловлены функциональными изменениями, а именно преходящим эзофагоспазмом.
Хроническая персистирующая дисфагия у больных ЭоЭ, постепенно прогрессирующая с течением времени, вынуждает пациентов избирательно подходить к выбору продуктов питания, принимать пищу полужидкой или кашицеобразной консистенции, длительно пережевывать пищу и обильно запивать ее. Зачастую данные симптомы у детей остаются незамеченными либо воспринимаются как шалость, хотя при внимательном рассмотрении они являются основным ключом в постановке диагноза ЭоЭ [9].
Таким образом, дисфагия при ЭоЭ может иметь длительный анамнез, родом из детства, либо манифестировать остро. Этот тягостный симптом значительно влияет на самочувствие больных, снижает качество жизни, приводя к необходимости применения различных компенсаторных приемов при приеме пищи [9].
Опросники для оценки выраженности симптомов ЭоЭ
Разработано несколько опросников для оценки тяжести и активности симптомов, эффективности терапии ЭоЭ.
Индекс активности ЭоЭ: опросник, заполняемый пациентами самостоятельно на 1-й, 7-й, 30-й дни наблюдения. Опросник предназначен для взрослых пациентов, которые в обозначенные дни документируют частоту возникновения, интенсивность, продолжительность дисфагии, эпизоды острой обтурационной дисфагии, время, затрачиваемое на прием пищи, появление загрудинной боли, необходимость длительного пережевывания пищи, отмечают плохо переносимые продукты питания. Индекс активности ЭоЭ, полученный при оценке вышеперечисленных пунктов, показал достаточно высокую корреляцию с данными эндоскопического и гистологического исследований [15, 20, 21].
Опросник для оценки дисфагии клиники Мейо (Mayo Dysphagia Questionnaire): валидизированный опросник, оригинальная версия которого была разработана для оценки выраженности дисфагии у больных со стриктурами пищевода. Опросник содержит 28 пунктов и требует около 10 мин на заполнение. В исследованиях, посвященных сопоставлению результатов опросника с данными гистологического исследования, была выявлена значительная вариабельность результатов, что не позволяет использовать его для контроля за активностью заболевания [15, 22].
Педиатрическая шкала оценки симптомов (Pediatric Quality of Life Inventory; PedsQL): включает оценку симптомов, их возрастную вариабельность, качество жизни [23,24].
Несмотря на то что данные опросники широко используются в научных исследованиях, их применение в клинической практике затруднено. На сегодняшний день разработаны пациенто-ориентированные опросники, содержащие меньшее количество вопросов. Одним из таких опросников является Опросник по оценке дисфагии (The Dysphagia Symptom Questionnaire) [15, 25], содержащий всего 3 вопроса, ответы на которые пациенты дают ежедневно в течение 30 дней.
— Ели ли Вы сегодня твердую пищу?
— Наблюдали ли Вы сегодня, что пища при глотании продвигается слишком медленно или застревает в горле или грудной клетке?
— Приходилось ли Вам сегодня использовать какие- то дополнительные приемы, чтобы проглотить пищу?
Инструментальная диагностика эозинофильного эзофагита
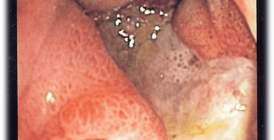
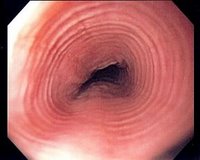
При проведении ЭГДС у больных с ЭоЭ обнаруживаются неспецифические признаки активного воспалительного процесса на всем протяжении пищевода: отек и контактная ранимость слизистой оболочки пищевода, белесый экссудат (эозинофильные микроабсцессы), линейные продольные борозды (рис. 1).

Рис. 1. Эндоскопические особенности ЭоЭ: a — отек, белый экссудат, белесые точки (эозинофильные микроабсцессы), узловатость (нодулярность); б — множественные концентрические кольца («трахеевидный» пищевод); в — продольные борозды. а — acute inflammatory with edema, white exudate; b — rings; c — furrows. У взрослых больных ЭоЭ в дополнение к вышеперечисленным признакам нередко обнаруживаются изменения, отражающие развитие подслизистого фиброза: множественные концентрические кольца («трахеевидный» или «кошачий» пищевод), стриктуры и сужения пищевода [26—28].
С целью повышения информативности ЭГДС в диагностике ЭоЭ, стандартизации методики оценки степени и характера поражения пищевода была разработана эндоскопическая шкала EREFS, описывающая 5 главных эндоскопических признаков ЭоЭ: Exudates — экссудат, Rings — кольца, Edema — отек, Furrows — борозды, Strictures — стриктуры (табл. 2)

Таблица 2. Эндоскопическая шкала EREFS при оценке ЭоЭ [26].
Диагностическая ценность шкалы EREFS была оценена в проспективном мультицентровом исследовании, показавшем высокую степень межисcледовательской согласованности получаемых данных [29, 30]. Однако корреляция результатов EREFS с гистологическими данными оказалась недостаточно высока. Связано это с тем, что вышеперечисленные эндоскопические признаки не являются специфичными только для ЭоЭ, поскольку встречаются и при других заболеваниях пищевода [28, 30—32].
Использование современного оборудования высокого разрешения значительно увеличивает диагностическую ценность эндоскопического исследования, позволяя устанавливать верный диагноз до 95% больных ЭоЭ. Тем не менее, согласно современным рекомендациям, всем больным с подозрением на ЭоЭ при проведении ЭГДС должна быть выполнена множественная биопсия из дистального и проксимального отделов пищевода для последующего гистологического исследования образцов ткани [10, 15, 26].
Гистологическое исследование включает осмотр биоптатов с использованием микроскопа высокого разрешения (×400), окраска гематоксилином и эозином. Для получения корректных гистологических результатов необходимо производить биопсию не менее чем в 6—8 участках из дистального и среднего/проксимального отделов пищевода. Биоптат должен включать эпителий на всю его глубину и собственную пластинку слизистой оболочки. Данные рекомендации обусловлены тем, что воспалительные изменения при ЭоЭ носят фокальный характер и захватывают в равной степени как дистальный, так и проксимальный участки пищевода [1, 15, 33].
Важно, что биопсию необходимо производить не только из макроскопически измененных участков слизистой оболочки пищевода, но и из нормальных участков, так как в них зачастую обнаруживаются значительные гистологические изменения. Для дифференциальной диагностики с другими заболеваниями, ассоциированными с эозинофилией пищевода, при первом эндоскопическом обследовании рекомендуется забор биоптатов из желудка и двенадцатиперстной кишки (табл. 3).

Таблица 3. Заболевания, ассоциированные с эозинофилией пищевода
Согласно современным международным рекомендациям [10], при гистологическом исследовании биоптатов из пищевода главным критерием установления диагноза ЭоЭ служит интраэпителиальная эозинофильная инфильтрация с количеством эозинофилов в поле зрения микроскопа высокого разрешения (×400) не менее 15 (рис. 2, 3,
Рис. 2. Морфологическое исследование биоптата из проксимального отдела пищевода. Окраска гематоксилином и эозином. а — скопления эозинофильных лейкоцитов (×200); б — скопления эозинофильных лейкоцитов более 60 в поле зрения; эозинофильное поверхностное наслоение («пластообразование») (×400); по степени эозинофильного воспаления степень поражения 3 балла, стадия поражения 3 балла; по степени эозинофильного «пластообразования» степень поражения 2 балла, стадия поражения 2 балла. Proximal part of esophagus. a — eosinophilic inflammation: intraepithelial eosinophils; b — eosinophilic inflammation: peak eosinophil count more that 60. Рис. 3. Морфологическое исследование биоптата из дистального отдела пищевода. Окраска гематоксилином и эозином. а — скопления эозинофильных лейкоцитов, ×200; б — скопления эозинофильных лейкоцитов более 60 в поле зрения, ×400. Степень поражения: 3 балла, стадия поражения: 3 балла. Distal part of esophagus. a — eosinophilic inflammation: intraepithelial eosinophils; b — eosinophilic inflammation: peak eosinophil count more that 60. б) [10, 13, 15].
Важно, что факт обнаружения большого количества эозинофилов в слизистой оболочке пищевода при гистологическом исследовании не может служить единственным критерием диагноза ЭоЭ. Существует большое разнообразие заболеваний, протекающих с эзофагеальной эозинофилией: ГЭРБ, эозинофильный гастроэнтерит, целиакия, болезнь Крона, лучевой и инфекционный эзофагит (грибковые и паразитарные инфекции), гиперэозинофильный синдром, лекарственный эзофагит, васкулиты, ахалазия кардии, системные заболевания соединительной ткани, злокачественные опухоли [1, 13]. Изолированная эозинофильная инфильтрация слизистой оболочки пищевода без ключевого симптома заболевания — дисфагии не может служить критерием ЭоЭ.
Таким образом, диагноз «эозинофильный эзофагит» может быть установлен только при совокупности клинических симптомов дисфункции пищевода и гистологического подтверждения эозинофильной инфильтрации пищевода, после обязательного исключения заболеваний, сопровождающихся эозинофилией пищевода (рис. 4).

Рис. 4. Диагностический алгоритм ЭоЭ [13].
Необходимо помнить, что у пациентов, получающих лечение антисекреторными препаратами или глюкокортикостероидами, число эозинофилов может быть повышено незначительно или вовсе не превышать норму (5 эозинофилов в поле зрения) [10]. Кроме того, в активной стадии заболевания происходит массивная дегрануляция эозинофилов в толще слизистой оболочки пищевода, что также может снижать число видимых эозинофилов. Немаловажную роль играют и технические особенности микроскопов (разные размеры участка ткани, осматриваемого при высоком увеличении), различной технологией окраски и фиксации биоптатов. Высокая вариабельность числа эозинофилов в слизистой оболочке пищевода в зависимости от вышеперечисленных факторов значительно затрудняет диагностику ЭоЭ. В связи с этим рассматривается вопрос о необходимости введения новых диагностических показателей, таких как плотность эозинофильной инфильтрации (число эозинофилов в 1 мм 2 ) и активность эозинофильных протеолитических ферментов (эозинофильная пероксидаза и нейротоксин) в единице участка ткани.
Дополнительными гистологическими критериями ЭоЭ являются эозинофильные микроабсцессы (рис. 5),
Рис. 5. Эозинофильные абсцессы. Степень поражения 3 балла. Стадия поражения 3 балла. Биоптат из проксимального отдела пищевода, окраска гематоксилином и эозином (а — ×400, б — ×200). Intraepithelial eosinophil group or aggregate (a — ×400, b — ×200). гиперплазия базального слоя эпителия, расширение межклеточных пространств (рис. 6), Рис. 6. Расширенные межклеточные пространства: округлые перицелюллярные пространства в плоском эпителии пищевода, в которых иногда определяются межклеточные мостики. Степень поражения 2 балла, стадия поражения 2 балла. Биоптат из проксимального отдела пищевода. Окраска гематоксилином и эозином. (×400). расположение эозинофилов в поверхностных слоях эпителия, мастоцитарная и лимфоцитарная инфильтрация, удлинение сосочков и фиброз собственной пластинки слизистой оболочки (рис. 7) Рис. 7. Фиброз собственной пластинки слизистой оболочки (ФСП). Гиперплазия базального слоя эпителия. Волокна собственной пластинки утолщены, их диаметр превышает диаметр ядер клеток базального слоя. По степени фиброза собственной пластинки слизистой — степень поражения 3 балла, стадия поражения 3 балла. По степени гиперплазии базального слоя эпителия степень поражения 2 балла, стадия поражения 3 балла. Биоптат из проксимального отдела пищевода, окраска по Маллори (×400). [10].
Для стандартизации гистологической оценки биоптатов была разработана система балльной оценки (тяжесть и распространенность оценивается в диапазоне от 0—3 баллов) восьми наиболее характерных гистологических изменений, обнаруживаемых у больных с ЭоЭ. Данная шкала, получившая условное название «Оценочная шкала ЭоЭ-специфичных гистологических показателей» (EoE-specific histologic scoring system — EoEHSS), включает оценку плотности эозинофильной инфильтрации, гиперплазии базального слоя эпителия, наличия эозинофильных абсцессов, поверхностного расположения эозинофилов в слизистой оболочке, расширения межклеточных пространств, повреждения поверхностных слоев эпителия, наличия дискератоза, фиброза собственной пластинки слизистой оболочки [15, 34].
Применение шкалы EoEHSS позволяет достичь согласованности в работе морфологов, а также верифицировать диагноз у пациентов, получающих противовоспалительную терапию на момент проведения биопсии (табл. 4).
Таблица 4. Система балльной оценки биоптатов при ЭоЭ (EoEHSS) Примечание. ПЭЧ — пиковое эозинофильное число при оценке участка с наиболее выраженными воспалительными изменениями; РМП — расширенные межклеточные пространства; ЭА — эозинофильные абсцессы; ПН — поверхностное наслоение; ППЭ — повреждение поверхностного эпителия; ФСП — фиброз собственной пластинки слизистой оболочки; 1 — в норме в биоптатах пищевода интраэпителиальные эозинофилы отсутствуют, поэтому наличие любого количества интраэпителиальных эозинофилов рассматривается как патологическое изменение; балльная шкала эозинофильного воспаления основана на количестве эозинофилов в одном поле зрения при большом увеличении (×400); 2 — базальный слой плоского эпителия пищевода состоит из тесно расположенных мелких клеток, в норме его толщина составляет менее 15% общей толщины эпителия; верхняя граница базального слоя определяется как уровень, на котором ядра базальных клеток отделены друг от друга расстоянием, равным или превышающим диаметр ядра базальной клетки; 3 — интраэпителиальные скопления или агрегаты эозинофилов, в которых клетки образуют солидные структуры; эпителиальная архитектоника нарушена таким образом, что соседние эозинофилы не разделены эпителиальной тканью; 4 — линейное распределение (расположение) как минимум трех эозинофилов в верхней трети многослойного эпителия слизистой оболочки пищевода параллельно поверхности; 5 — округлые перицеллюлярные пространства в плоском эпителии пищевода, в которых определяются межклеточные мостики; балльная шкала РМП основана на степени увеличения микроскопа, необходимой для обнаружения межклеточных мостиков; 6 — изменения тинкториальных свойств поверхностного эпителия, проявляющиеся усилением (более темный оттенок красного) окрашивания клеток поверхностного слоя эпителия при наличии или отсутствии эозинофильной инфильтрации; балльная шкала ППЭ основана на выраженности эозинофильной инфильтрации в поврежденном поверхностном эпителии; 7 — появление отдельных эпителиальных клеток с ярко-эозинофильной цитоплазмой и мелким округлым гиперхромным ядром; балльная шкала основана на количестве клеток с явлениями дискератоза; 8 — утолщение соединительнотканных волокон собственной пластинки слизистой оболочки; волокна собственной пластинки, расположенные поодиночке и имеющие диаметр менее размера ядер клеток базального слоя, рассматривались как нормальные; сцепленные друг с другом волокна обычного диаметра, а также волокна, имеющие диаметр, равный или превышающий размер ядер клеток базального слоя, рассматривались как патологичные; балльная шкала ФСП основана на степени утолщения волокон. Таблица 4 (окончание). Система балльной оценки биоптатов при ЭоЭ (EoEHSS) Примечание. ПЭЧ — пиковое эозинофильное число при оценке участка с наиболее выраженными воспалительными изменениями; РМП — расширенные межклеточные пространства; ЭА — эозинофильные абсцессы; ПН — поверхностное наслоение; ППЭ — повреждение поверхностного эпителия; ФСП — фиброз собственной пластинки слизистой оболочки; 1 — в норме в биоптатах пищевода интраэпителиальные эозинофилы отсутствуют, поэтому наличие любого количества интраэпителиальных эозинофилов рассматривается как патологическое изменение; балльная шкала эозинофильного воспаления основана на количестве эозинофилов в одном поле зрения при большом увеличении (×400); 2 — базальный слой плоского эпителия пищевода состоит из тесно расположенных мелких клеток, в норме его толщина составляет менее 15% общей толщины эпителия; верхняя граница базального слоя определяется как уровень, на котором ядра базальных клеток отделены друг от друга расстоянием, равным или превышающим диаметр ядра базальной клетки; 3 — интраэпителиальные скопления или агрегаты эозинофилов, в которых клетки образуют солидные структуры; эпителиальная архитектоника нарушена таким образом, что соседние эозинофилы не разделены эпителиальной тканью; 4 — линейное распределение (расположение) как минимум трех эозинофилов в верхней трети многослойного эпителия слизистой оболочки пищевода параллельно поверхности; 5 — округлые перицеллюлярные пространства в плоском эпителии пищевода, в которых определяются межклеточные мостики; балльная шкала РМП основана на степени увеличения микроскопа, необходимой для обнаружения межклеточных мостиков; 6 — изменения тинкториальных свойств поверхностного эпителия, проявляющиеся усилением (более темный оттенок красного) окрашивания клеток поверхностного слоя эпителия при наличии или отсутствии эозинофильной инфильтрации; балльная шкала ППЭ основана на выраженности эозинофильной инфильтрации в поврежденном поверхностном эпителии; 7 — появление отдельных эпителиальных клеток с ярко-эозинофильной цитоплазмой и мелким округлым гиперхромным ядром; балльная шкала основана на количестве клеток с явлениями дискератоза; 8 — утолщение соединительнотканных волокон собственной пластинки слизистой оболочки; волокна собственной пластинки, расположенные поодиночке и имеющие диаметр менее размера ядер клеток базального слоя, рассматривались как нормальные; сцепленные друг с другом волокна обычного диаметра, а также волокна, имеющие диаметр, равный или превышающий размер ядер клеток базального слоя, рассматривались как патологичные; балльная шкала ФСП основана на степени утолщения волокон.
ЭГДС с множественной биопсией при ЭоЭ является незаменимым методом, позволяющим установить диагноз, контролировать активность воспалительного и фибротического процессов с течением времени, эффективность лечения. Необходимость частых эндоскопических вмешательств значительно снижает качество жизни пациентов, увеличивает расходы. На сегодняшний день получены многообещающие результаты применения альтернативных методов диагностики ЭоЭ, основанных на оценке концентрации протеолитических ферментов эозинофилов, адсорбированных на специальной заглатываемой нити или губке [35, 36].
Другим методом малоинвазивной диагностики ЭоЭ является так называемая «диагностическая панель ЭоЭ», включающая анализ 96 генов в образцах ткани из пищевода. Специфичность и чувствительность генетического тестирования составляют 98 и 96% соответственно. Методика имеет важные преимущества перед ЭГДС: нет необходимости в проведении множественных биопсий, диагноз может быть установлен вне зависимости от степени эозинофильного воспаления слизистой оболочки, в том числе на фоне противовоспалительной терапии [37].
Рентгенологическое исследование пищевода с контрастированием
Рентгеноконтрастное исследование пищевода в диагностике ЭоЭ является дополнительным методом, позволяющим с высокой точностью выявить проксимальные и дистальные стриктуры пищевода, оценить их протяженность, диаметр пищевода в месте сужения, принять решение о необходимости дилатации или бужирования [38, 39].
Поскольку контроль за эффективностью терапии включает частые эндоскопические вмешательства с проведением множественных биопсий, перед учеными и клиницистами остро стоит вопрос поиска менее инвазивных методов диагностики ЭоЭ.
Импедансометрия и импедансопланиметрия пищевода
Активный воспалительный процесс в толще слизистой оболочки пищевода при ЭоЭ обусловливает наличие экссудата на поверхности эпителия. Известно, что жидкость, в том числе воспалительный экссудат, является хорошим проводником для переменного электрического тока, в связи с чем снижение базального уровня импеданса (сопротивления переменному электрическому току) на поверхности слизистой оболочки пищевода может отражать активность воспалительного процесса.
Еще одной инновационной методикой, с помощью которой возможно косвенно оценить выраженность склеротических изменений стенки пищевода, является метод EndoFLIP (functional lumen impedance planimetry).
Метод EndoFLIP основан на данных импедансоманометрии высокого разрешения, получаемых в период растяжения стенки пищевода внутрипищеводным баллоном. Снижение растяжимости стенки пищевода, обнаруженное при проведении планиметрии у больных ЭоЭ, коррелирует с выраженностью фибротических изменений и служит своеобразным маркером прогрессии заболевания.
Необходимость использования дополнительных методов для диагностики выраженности подслизистого фиброза продиктована тем, что ЭГДС в большинстве случаев оказывается несостоятельна в диагностике стриктур пищевода на ранних стадиях. Проведение множественных биопсий также далеко не всегда позволяет выявить фибротические изменения стенки пищевода в связи с их очаговым характером [41, 42].
Цитогубка
Обнадеживающие результаты были получены при использовании минимально инвазивных методик, таких как String Test и Cytosponge. String Test — заглатываемая пациентом капсула, из которой при растворении в желудке освобождается нить, длиной до 90 см, адсорбирующая протеолитические ферменты эозинофильных гранул с поверхности слизистой оболочки пищевода. Активность ферментов в дальнейшем оценивается лабораторными методами. Процедура не требует анестезии, хорошо переносится, извлечение нити происходит через 1—12 ч [35]. В исследовании, посвященном сравнению результатов теста у детей, страдающих ГЭРБ, активным ЭоЭ или ЭоЭ в стадии ремиссии, было показано наличие значимой корреляции между концентрацией адсорбированных на нить протеолитических ферментов эозинофилов (нг/мл) со степенью эозинофильной инфильтрации слизистой оболочки пищевода [35].
Cytosponge — желатиновая капсула с нитью, при растворении которой в желудке высвобождается губка диаметром до 3 см с выраженными абразивными свойствами. Губка в процессе вытягивания за нить позволяет получить микрообразцы ткани из пищевода, которые затем подвергаются иммуноцитохимическому анализу [36].
Показатели периферической крови в диагностике эозинофильного эзофагита
При проведении общего анализа крови эозинофилия наблюдается у 30—80% больных ЭоЭ, а абсолютное число эозинофилов в периферической крови статистически значимо коррелирует со степенью эозинофильной инфильтрации слизистой оболочки пищевода и заметно уменьшается при достижении гистологической ремиссии ЭоЭ на фоне лечения ИПП или топическими стероидами [42—48]. К сожалению, эозинофилия не является специфичной только для ЭоЭ, в связи с чем этот показатель необходимо оценивать с учетом возраста пациента, наличия аллергических заболеваний, времени года (цветение трав и деревьев) и других факторов, способных повлиять на изменение числа эозинофилов в крови.
Методики, связанные с оценкой сывороточной концентрации других потенциальных биомаркеров ЭоЭ (сывороточный IgE, провоспалительные цитокины (ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-9, ИЛ-13), ферменты эозинофильных гранул, эотаксин-3, тимический стромальный лимфопоэтин, факторы роста опухолей и др.) также оказались непригодны для диагностики ЭоЭ и контроля за активностью воспалительного процесса. Несмотря на то что данные биологически активные вещества принимают непосредственное участие в патогенезе ЭоЭ, их уровень в сыворотке крови слабо коррелирует со степенью эозинофильного воспаления в слизистой оболочке пищевода [15, 43—49].
Исследование мочи в диагностике эозинофильного эзофагита
3-Бромтирозин является биомаркером, отражающим активность эозинофилов. Уровень 3-бромтирозина в моче больных ЭоЭ в 93 раза выше, чем у здоровых добровольцев, и в 13 раз выше, чем у больных с атопическими заболеваниями. Необходимы дальнейшие исследования, подтверждающие диагностическую ценность 3-бромтирозина при ЭоЭ [50].
Нерешенные вопросы в диагностике эозинофильного эзофагита
На сегодняшний день диагноз и оценка эффективности терапии ЭоЭ базируются на данных, полученных при проведении ЭГДС и анализе биоптатов из пищевода. Однако, так ли важна роль эозинофилов (крайне специфичной и малочисленной популяции лейкоцитов) в патогенезе заболевания или их появление в толще слизистой оболочки пищевода отражает лишь верхушку айсберга?
Интересна серия клинических наблюдений, которая описывает случаи персистирующей дисфагии среди членов семей больных ЭоЭ, у которых при морфологическом исследовании биоптатов слизистой оболочки пищевода выявлялась мастоцитарная и лимфоцитарная инфильтрация, повышение экспрессии генов, входящих в транскриптом ЭоЭ, однако (несмотря на характерные симптомы) число эозинофилов было в пределах нормы или повышено незначительно [51].
С разработкой современных лекарственных препаратов, регулирующих пролиферацию, созревание эозинофилов, снижающих активность эозинофильного воспаления, ученые столкнулись с проблемой их низкой клинической эффективности, что также породило сомнения в роли эозинофилов в патогенезе ЭоЭ. Так, например, препараты меполизумаб и резлизумаб, являющиеся моноклональными антителами к ИЛ-5 и на 90% снижающие эозинофильную инфильтрацию слизистой оболочки пищевода, оказались малоэффективны в отношении купирования симптомов у больных ЭоЭ. Более того, на фоне лечения данными препаратами воспалительная инфильтрация слизистой оболочки пищевода Т-лимфоцитами и мастоцитами сохранялась [52—54].
Требуются дальнейшие исследования, посвященные роли других (кроме эозинофилов) клеточных популяций в патогенезе ЭоЭ [15].
Лечение эозинофильного эзофагита
Целями терапии ЭоЭ являются достижение клинической (купирование дисфагии) и гистологической ремиссии заболевания, предотвращение развития осложнений (стриктуры пищевода). Под гистологической ремиссией ЭоЭ подразумевают разрешение эозинофильного воспаления (менее 15 эозинофилов в поле зрения микроскопа высокого разрешения).
Современная концепция лечения больных ЭоЭ включает медикаментозную терапию, диетические ограничения и при необходимости — проведение эндоскопической дилатации пищевода.
Медикаментозная терапия эозинофильного эзофагита
Медикаментозная терапия ЭоЭ базируется на назначении топических кортикостероидов или/и ИПП.
Впервые системные кортикостероиды для лечения детей с ЭоЭ были применены в 1998 г. [55]. Несколько месяцев спустя были опубликованы данные об успешном применении топических кортикостероидов у 4 детей с ЭоЭ [56].
На сегодняшний день опубликовано 11 рандомизированных исследований, несколько систематических обзоров и метаанализов, большинство из которых свидетельствуют о высокой эффективности топических стероидов в индукции гистологической ремиссии у больных ЭоЭ, независимо от их возраста [57—71]. На основании накопленных данных современные рекомендации указывают на предпочтительные к использованию препараты, их дозировку (табл. 5)

Таблица 5. Дозы топических кортикостероидов для индукции и поддержания ремиссии у больных ЭоЭ [10] [10] и способ применения.
Так, при использовании аэрозоля флутиказона необходимо сделать впрыск и глоток, задерживая дыхание. Перед применением будесонида рекомендуется приготовить густую суспензию (смешать 1—2 мг будесонида с 5 мг сукралозы). Доза будесонида у детей должна корректироваться с учетом веса и возраста. В течение 30—60 мин после применения топических стероидов важно воздержаться от приема пищи и жидкостей во избежание удаления лекарственного препарата со слизистой оболочки пищевода.
Особую важность в повышении эффективности лечения играет лекарственная форма препарата, обеспечивающая наиболее продолжительный контакт слизистой оболочки пищевода с действующим веществом. В исследовании E. Dellon и соавт. [62] при лечении будесонидом в дозе 1 мг в течение 8 нед удалось достигнуть гистологической ремиссии у 64% больных, использовавших лекарственный препарат в виде густого сиропа, и лишь у 27% больных, применявших небулайзер. Объясняется это более длительной аппликацией сиропа (по сравнению с аэрозолем) будесонида на слизистой оболочке дистального отдела пищевода (что было доказано с помощью сцинтиграфии). Системные кортикостероиды в лечении ЭоЭ в настоящее время не используются [10].
В связи с тем что ЭоЭ — хроническое, персистирующее заболевание, большинству больных ЭоЭ для поддержания ремиссии необходима длительная поддерживающая терапия.
Источник https://endoexpert.ru/dokumenty-i-prikazy/eozinofilnyy-ezofagit-klinicheskie-rekomendatsii-rga-/
Источник https://www.krasotaimedicina.ru/diseases/zabolevanija_gastroenterologia/eosinophilic-esophagitis
Источник https://www.mediasphera.ru/issues/dokazatelnaya-gastroenterologiya/2019/1/1230522602019011058