Генерализованный и неуточненный атеросклероз (I70.9)
По определению Всемирной организации здравоохранения: «Атеросклероз — это вариабельная комбинация изменений внутренней оболочки (интимы) артерий, включающая накопление липидов, сложных углеводов, фиброзной ткани, компонентов крови, кальцификацию и сопутствующие изменения средней оболочки (медии)».
При атеросклерозе происходит поражение артерий среднего и крупного калибра, эластического (крупные артерии, аорта) и мышечно-эластического (смешанного: сонные, артерии головного мозга и сердца) типов. Поэтому атеросклероз является наиболее частой причиной инфаркта миокарда, ИБС, мозгового инсульта, нарушений кровообращения нижних конечностей, брюшной аорты, мезентериальных и почечных артерий.
Несмотря на то что клиницисты часто используют термин генерализованный атеросклероз, поражение сосудов происходит, как правило, неравномерно: у людей разного возраста в патологический процесс вовлекаются разные сосуды и поражение имеет не одинаковую степень выраженности. На ранних этапах заболевания поражается аорта, в частности ее брюшной отдел — брюшная аорта. Атеросклероз этой локализации протекает наиболее тяжело. Выявление атеросклеротического повреждения аорты служит первым звонком о том, что вскоре процесс затронет и другие отделы сосудистого русла. Помимо брюшной аорты, наиболее тяжело атеросклероз протекает при поражении участков отхождения от аорты ее ветвей (в частности, места отхождения венечных и межреберных артерий), дуги аорты, а также и участка ее бифуркации подвздошной артерии. Нижние конечности поражаются в большей степени, чем верхние. Частота поражения сосудов нижних конечностей уменьшается по мере удаления к периферии: в сосудах мышечно-эластического типа атеросклероз выражен больше, чем в крупных артериях мышечного типа; менее всего эти процессы выражены в еще более мелких сосудах, таких как подошвенная или пальцевые артерии. Бляшки и тромбы чаще всего локализуются в бедренной артерии, в гунтеровском канале, а в подколенной артерии — непосредственно выше коленного сустава. Передняя и задняя большеберцовые артерии нередко поражаются одновременно, но на разных уровнях: поражение задней- большеберцовой артерии локализуется в той ее части, которая огибает внутреннюю лодыжку, а передней большеберцовой артерии — на участке ее поверхностного прохождения, где она переходит в тыльную артерию стопы. Малоберцовая артерия, окруженная мышцами, часто остается непораженной в то время как другие сосуды уже вовлечены в атеросклеротический процесс. При этом она может являться основным источником кровоснабжения нижней конечности («малоберцовая нога»). Атеросклероз брюшных ветвей аорты, за исключением почечных и мезентериальных сосудов, вызывает меньше клинических проблем, чем атеросклероз венечных и церебральных артерий. Среди венечных артерий сердца чаще всего серьезно поражаются основные стволы кровоснабжения миокарда; бляшки, как правило, располагаются вблизи от устьев артерий. Признаки атеросклероза практически всегда можно обнаружить в эпикардиальных (экстрамуральных) отделах сосудов, в то время как интрамуральные венечные артерии остаются интактными. Коронарный атеросклероз носит диффузный характер. Степень сужения просвета сосуда может быть различна, но если процесс начался, то обычно он захватывает внутреннюю оболочку всех сосудов экстрамуральных отделов. Окклюзия в целом нормального сосуда единичной тонкой бляшкой встречается редко. Селективное поражение венечных артерий сердца может быть обусловлено какими-то конкретными гемодинамическими факторами, отличающимися от гемодинамических сил, возникающих в крупных артериях в большей степени в диастолу, чем в систолу. Значение интенсивности кровотока для атерогенеза в настоящее время не установлено. Типичные атероматозные фиброзные бляшки также возникают в венозных трансплантатах, использованных для создания обходного аорто-коронарного сосудистого шунта. Распределение атеросклеротических поражений в артериях шеи и головного мозга имеет такой же неравномерный характер, как и в других отделах. Прежде всего они появляются в области основания мозга в сонных, базилярных и позвоночных артериях. Излюбленным местом локализации атеросклеротических бляшек в области шеи является проксимальная часть внутренней сонной артерии. Скопление бляшек можно обнаружить и в месте ее бифуркации. Атеросклероз легочных артерий не идет ни в какое сравнение па тяжести с поражением аорты или других системных артерий. Некоторые признаки атеросклеротического поражения легочных артерий можно обнаружить приблизительно у 50 % взрослых людей в возрасте старше 50 лет, у которых нет других видимых причин для появления легочной гипертензии. Однако сама по себе легочная гипертензия сопровождается гипертрофией средней оболочки артерии, утолщением внутренней оболочки и значительным ускорением образования атером.

Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
— 800 RUB / 5500 KZT / 27 BYN — 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
Классификация
Атеросклеротические бляшки могут быть стабильными и нестабильными.Стабильность бляшки зависит от ее строения, размеров и конфигурации. Стабильные бляшки статичны или характеризуются медленным ростом в течение многих лет. Стабильные бляшки богаты коллагеном; нестабильные — липидами.
В зависимости от преимущественной локализации процесса различают соответствующие клинико-морфологические формы:
1) атеросклероз аорты;
2) атеросклероз венечных артерий сердца (сердечная форма, ИБС);
3) атеросклероз артерий головного мозга (мозговая форма, цереброваскулярные заболевания);
4) атеросклероз артерий почек (почечная форма);
5) атеросклероз артерий кишечника (кишечная форма);
6) атеросклероз артерий нижних конечностей.
В зависимости от этиологических, патогенетических и морфологических признаков различают виды артериосклероза:
1) атеросклероз (метаболический артериосклероз);
2) артериосклероз, или гиалиноз (например, при гипертонической болезни);
3) воспалительный артериолосклероз (например, сифилитический, туберкулезный);
4) аллергический артериосклероз (например, при узелковом периартериите);
5) токсический артериосклероз (например, адреналиновый);
6) первичный кальциноз средней оболочки артерий (медиакальциноз Менкеберга);
7) возрастной (старческий) артериосклероз.
Этиология и патогенез
В основе обменных нарушений при атеросклероз лежит дислипопротеидемия с преобладанием ЛПОНП и ЛПНП, что ведет к нерегулируемому клеточному обмену холестерина (рецепторная теория атеросклероза Гольдштейна и Брауна), появлению так называемых «пенистых» клеток в интиме артерий, с которыми связано образование атеросклеротических бляшек.
Значение гормональных факторов в развитии атеросклероза несомненно. Так, сахарный диабет и гипотиреоз способствуют, а гипертиреоз и эстрогены препятствуют развитию атеросклероза. Имеется прямая связь между ожирением и атеросклерозом. Несомненна и роль гемодинамического фактора (артериальная гипертензия, повышение сосудистой проницаемости) в атерогенезе. Независимо от характера гипертонии при ней отмечается усиление атеросклеротического процесса. При гипертонии атеросклероз развивается даже в венах (в легочных венах — при гипертензии малого круга, в воротной вене—при портальной гипертензии).
Исключительная роль в этиологии атеросклероза отводится нервному фактору — стрессовым и конфликтным ситуациям, с которыми связано психо-эмоциональное перенапряжение, ведущее к нарушению нейроэндокринной регуляции жиробелкового обмена и вазомоторным расстройствам (нервно-метаболическая теория атеросклероза А. Л. Мясникова). Поэтому атеросклероз рассматривается как болезнь сапиентации.
Сосудистый фактор, т. е. состояние сосудистой стенки, в значительной мере определяет развитие атеросклероза. Имеют значение заболевания (инфекции, интоксикации, артериальная гипертония), ведущие к поражению стенки артерий (артериит, плазматическое пропитывание, тромбоз, склероз), что «облегчает» возникновение атеросклеротических изменений. Избирательное значение при этом имеют пристеночные и интрамуральные тромбы, на которых «строится» атеросклеротическая бляшка (тромбогенная теория Рокитанского — Дьюгеда).
Некоторые исследователи придают основное значение в развитии атеросклероза возрастным изменениям артериальной стенки и рассматривают атеросклероз как «проблему возраста», как «геронтологическую проблему» (Давыдовский И. В., 1966). Эта концепция не разделяется большинством патологов.
Роль наследственных факторов в атеросклерозе доказана (например, атеросклероз у молодых людей при семейной гиперлипопротеидемии, отсутствии апорецепторов). Имеются данные о роли этнических факторов в его развитии.
Таким образом, атеросклероз следует считать полиэтиологическим заболеванием, возникновение и развитие которого связано с влиянием экзогенных и эндогенных факторов.
Патогенез атеросклероза
Патогенез атеросклероза сложен. По современным представлениям в основе возникновения атеросклероза лежит взаимодействие многих патогенетических факторов, ведущее в конечном счете к образованию фиброзной бляшки (неосложненной и осложненной).
Различают три основные стадии формирования атеросклеротической бляшки (атерогенез):
- Образование липидных пятен и полосок (стадия липоидоза).
- Образование фиброзной бляшки (стадия липосклероза).
- Формирование осложненной атеросклеротической бляшки.
Начальная стадия характеризуется появлением в интиме артерий пятен и полосок, содержащих липиды.
Образование липидных пятен и полосок
Липидные пятна представляют собой небольших размеров (до 1,0-1,5 мм) участки на поверхности аорты и крупных артерий, которые имеют желтоватый цвет. Липидные пятна состоят, главным образом, из пенистых клеток, содержащих большое количество липидов и Т-лимфоцитов. В меньшем количестве в них присутствуют также макрофаги и гладкомышечные клетки. Со временем липидные пятна увеличиваются в размерах, сливаются друг с другом и образуют так называемые липидные полоски, слегка возвышающиеся надо поверхностью эндотелия. Они также состоят из макрофагов, лимфоцитов, гладкомышечных и пенистых клеток, содержащих липиды. На этой стадии развития атеросклероза холестерин расположен преимущественно внутриклеточно и лишь небольшое его количество находится вне клеток.Липидные пятна и полоски образуются в результате отложения липидов в интиме артерий. Первым звеном этого процесса является повреждение эндотелия и возникновение эндотелиальной дисфункции, сопровождающееся повышением проницаемости этого барьера.
Причинами первоначального повреждения эндотелия могут служить несколько факторов:
- Механическое воздействие на эндотелий турбулентного потока крови, особенно в местах разветвления артерий.
- Артериальная гипертензия, увеличивающая напряжение сдвига.
- Увеличение в крови атерогенных фракций ЛПНП и липопротеина (а) , особенно их модифицированных форм, образующихся в результате перекисного окисления липидов или их гликозилирования (при сахарном диабете) и обладающие выраженным цитотоксическим действием.
- Повышение активности симпато-адреналовой и ренин-ангиотензиновой систем, сопровождающееся цитотоксическим действием катехоламинов и ангиотензина II на сосудистый эндотелий.
- Хроническая гипоксия и гипоксемия любого происхождения.
- Курение.
- Повышение у в крови содержания гомоцистеина , например, при дефиците витамина В 6 , В 12 и фолиевой кислоты .
- Вирусная и хламидийная инфекция, сопровождающаяся развитием хронического воспаления в стенке артерии.
В результате повреждения эндотелия формируется эндотелиальная дисфункция, проявляющаяся снижением продукции вазодилатирующих факторов (простациклин, окись азота и др.) и увеличением образования вазоконстрикторных веществ (эндотелинов, АII, тромбоксана А2 и др.), еще больше повреждающих эндотелий и повышающих его проницаемость. Модифицированные ЛПНП и липопротеин (а) и некоторые клеточные элементы крови (моноциты, лимфоциты) проникают в интиму артерий и подвергаются окислению или гликозилированию (модификации), что способствует еще большему повреждению эндотелия и облегчает миграцию из кровотока в интиму артерий этих клеточных элементов.
Со временем пенистые клетки подвергаются апоптозу. В результате липиды попадают во внеклеточное пространство. Липидные пятна появляются в артериях с раннего детства. В возрасте 10 лет липидные пятна занимают около 10% поверхности аорты, а к 25 годам — от 30 до 50% поверхности. В венечных артериях сердца липоидоз встречается с 10-15 лет, а в артериях мозга — к 35-45 годам.
Образование фиброзных бляшек
По мере прогрессирования патологического процесса в участках отложения липидов разрастается молодая соединительная ткань, что ведет к образованию фиброзных бляшек, в центре которых формируется так называемое липидное ядро.
Одновременно происходит васкуляризация очага атеросклеротического поражения. Вновь образующиеся сосуды отличаются повышенной проницаемостью и склонностью к образованию микротромбов и разрывам сосудистой стенки. По мере созревания соединительной ткани количество клеточных элементов уменьшается, а коллагеновые волокна утолщаются, формируя соединительнотканный каркас атеросклеротической бляшки, который отделяет липидное ядро от просвета сосуда («покрышка»). Формируется типичная фиброзная бляшка, выступающая в просвет сосуда и нарушающая кровоток в нем.
Клиническое и прогностическое значение сформировавшейся атеросклеротической бляшки во многом зависит именно от структуры ее фиброзной покрышки и размеров липидного ядра. В некоторых случаях (в том числе на относительно ранних стадиях формирования бляшки) ее липидное ядро хорошо выражено, а соединительнотканная капсула сравнительно тонкая и может легко повреждаться под действием высокого артериального давления, ускорения кровотока в артерии и других факторов. Такие мягкие и эластичные бляшки иногда называют «желтыми бляшками». Они, как правило, мало суживают просвет сосуда, но ассоциируются с высоким риском возникновения повреждений и разрывов фиброзной капсулы, то есть с формированием так называемой «осложненной» атеросклеротической бляшки.
В других случаях (обычно на более поздних стадиях) фиброзная покрышка хорошо выражена, плотная и меньше подвержена повреждению и разрывам. Такие бляшки называют «белыми». Они нередко значительно выступают в просвет артерии и вызывают гемодинамически значимое ее сужение, которое в некоторых случаях может осложняться возникновением пристеночного тромба.
Первые две стадии атерогенеза завершаются образованием неосложненной атеросклеротической бляшки. Прогрессирование атероматозного процесса приводит к формированию «осложненной» атеросклеротической бляшки, вследствие чего образуется пристеночный тромб, который может приводить к внезапному и резкому ограничению кровотока в артерии.
Формирование «осложненной» бляшки
Прогрессирование атероматозного процесса приводит к формированию «осложненной» атеросклеротической бляшки. Эта стадия атероматоза характеризуется значительным увеличением липидного ядра (до 30% и более от общего объема бляшки), возникновением кровоизлияний в бляшку, истончением ее фиброзной капсулы и разрушением покрышки с образованием трещин, разрывов и атероматозных язв. Выпадающий при этом в просвет сосудов детрит может стать источником эмболии, а сама атероматозная язва служить основой для образования тромбов. Завершающей стадией атеросклероза является атерокальциноз, отложение солей кальция в атероматозных массы, межуточное вещество и фиброзную ткань.Главным следствием формирования «осложненной» атеросклеротической бляшки является образование пристеночного тромба, который внезапно и резко ограничивает кровоток в артерии. В большинстве случаев именно в этот период возникают клинические проявления обострения заболевания, соответствующие локализации атеросклеротической бляшки (нестабильная стенокардия, инфаркт миокарда, ишемический инсульт и т.п.).
Эпидемиология
Соотношение полов(м/ж): 3
С наибольшей частотой атеросклероз поражает мужчин старше 45-50 лет (в 3-4 раза чаще, чем женщин), но встречается у пациентов более молодого возраста.
Факторы и группы риска
Факторы риска развития атеросклероза
- Возраст
- Пол (мужчины болеют атеросклерозом чаще)
- Генетическая предрасположенность — положительный семейный анамнез преждевременного развития атеросклероза
- Табакокурение
- Артериальная гипертензия
- Ожирение
- Гиперлипидемия — гиперхолестеринемия и/или гипертриглицеридемия
- Гипергликемия и сахарный диабет
- Низкие уровни липопротеидов высокой плотности
Определение группы риска у пациентов без клинических проявлений атеросклероза. Определить индивидуальную степень риска для пациентов позволяет шкала SCORE (системная оценка коронарного риска), с помощью которой можно оценить вероятность фатальных сердечно — сосудистых событий (инфаркт миокарда, инсульт) в течение 10 лет. Низкий риск — 8%.

Клиническая картина
Клинические критерии диагностики
Cимптомы, течение
Клинические признаки атеросклероза появляются при прогрессирующем сужении просвета артерии в результате разрастания стабильной атеросклеротической бляшки, когда дефициту кровотока составляет 50-70%.
В зависимости от локализации в сосудистой системе, атеросклероз является основой таких заболеваний:
1. Ишемическая болезнь сердца (стенокардия, инфаркт миокарда, внезапная сердечная смерть, аритмии, сердечная недостаточность).
2. Цереброваскулярные заболевания (транзиторная ишемическая атака, ишемический инсульт).
3. Атеросклероз артерий нижних конечностей (перемежающая хромота, гангрена стоп и голеней).
4. Атеросклероз аорты.
5. Атеросклероз почечных артерий.
6. Атеросклероз мезентериальных артерий (инфаркт кишечника).
Атеросклероз коронарных артерий имеет множество симптомов, в зависимости от выраженности атеросклероза, проявляясь стенокардией или острой коронарной недостаточностью, характеризуясь развитием инфаркта миокарда, сердечной недостаточностью. Все формы ишемической болезни сердца протекают на фоне атеросклероза. На кардиальные проявления атеросклероза приходится примерно половина всех атеросклеротических поражений.
Атеросклероз аорты часто проявляется после 60 лет. При атеросклерозе грудного отдела аорты появляются интенсивные жгучие боли за грудиной, отдающие в шею, спину, верхнюю часть живота. При физической нагрузке и на фоне стресса боль усиливается. В отличие от стенокардии боль продолжается сутками, периодически усиливаясь и ослабевая. Могут появиться нарушения глотания, охриплость голоса, головокружения, обморочные состояния. Для атеросклероза брюшного отдела аорты характерны боли в животе, вздутие живота, запоры. При атеросклеротическом поражении бифуркации аорты (место разделения аорты на ветви) развивается синдром Лериша с такими проявлениями как: перемежающаяся хромота, похолодание нижних конечностей, импотенция, язвы пальцев стоп. Грозным осложнением атеросклероза аорты является аневризма (расслоение) и разрыв аорты.
Атеросклероз мезентериальных сосудов проявляется резкими, жгучими, режущими болями в животе во время приема пищи, продолжающаяся 2-3 часа, вздутием живота, нарушением стула.
Для атеросклероза почечных артерий характерно стойкое повышение артериального давления, изменениями в анализе мочи.
Атеросклероз периферических артерий проявляется слабостью и повышенной утомляемостью мышц ног, ощущением зябкости в конечностях, перемежающейся хромотой (боль в конечностях появляется во время ходьбы, вынуждает больного остановиться).
Диагностика
В клинической и научной практике наиболее востребованы методы определения толщины комплекса интима-медиа сонных артерии (ТИМ), выявления атеросклеротических бляшек (АСБ) в сонных артериях и определения лодыжечного индекса давления (ЛИД), определение параметров ваззорегулярующего аспекта дисфункции эндотелия и ригидности артериальной стенки.
— Дисфункция эндотелия
Основным анализируемым параметром является относительное изменение диаметра плечевой артерии (в %) — поток-зависимая вазодилатация плечевой артерии( ПЗВДПА). ПЗВД у больных с гиперхолестеринемией значительно снижена и колеблется от 2,2% до 4,9%, тогда как у здоровых лиц этот параметр превышает 8-10%. Предсказательная ценность ПЗВД в отношении коронарного атеросклероза оценивается разными авторами неоднозначно. Z. Jambrik с коллегами (2004 г.) определили, что ПЗВД < 8,8% с чувствительностью 90% и специфичностью 37% выявляет наличие коронарного атеросклероза. Патогенетическая терапия, в частности коррекция нарушений липидного обмена, приводит к улучшению вазорегулирующей функции эндотелия в сроки от 4 недель до 3 месяцев
Ультразвуковой метод оценки функции эндотелия это инструмент научных исследований, позволяющий выделять группы риска, мониторировать состояние сосудистой стенки при модификации факторов риска.
— Утолщение комплекса интима-медиа
При ультразвуковом исследовании у здорового человека комплекс интима-медиа представляет собой двухслойную структуру с прилежащим к просвету гиперэхогенным слоем и подлежащим гипоэхогенным. Измерение отдельно слоев интимы и медии с помощью современных инструментальных технологий невозможно. При утолщении комплекса интима-медиа в его изображении исчезает дифференциация слоев, появляется гетерогенность, шероховатость поверхности. Для получения достоверных результатов измерения ТИМ необходимо соблюдение ряда положений. Опубликованы рекомендации американского общества эхокардиографии (2008 г.) по исследованию ТИМ, в которых перечислены необходимые требования к аппаратуре, персоналу, методике проведения и интерпретации результатов исследования. В многочисленных исследованиях показано увеличение ТИМ с возрастом. У здоровых лиц до 30 лет ТИМ составляет 0,52±0,04 мм, от 30 до 40 лет – 0,56±0,02 мм, от 40 до 50 лет – 0,60±0,04 мм, старше 50 лет – 0,67±0,03 мм. У женщин до наступления менопаузы ТИМ меньше, чем у мужчин; после прекращения защитного действия эстрогенов на сосудистую стенку величина ТИМ у женщин и мужчин постепенно сравнивается. Измерение ТИМ используется не только для выявления атеросклеротического поражения, но и для оценки эффективности проводимого патогенетического лечения.
— Атеросклеротическая бляшка
Важная роль выявления атеросклеротических бляшек в сонных артериях обусловлена тем, что их наличие связано с более высоким сердечно-сосудистым риском по сравнению с диффузным увеличением ТИМ в сонных артериях. При исследовании сонных артерий структуру, выступающую в просвет артерии, описывают как атеросклеротическую бляшку, если ее высота на 0,5 мм или на 50% превышает ТИМ прилежащих сегментов артерии или больше 1,3 мм. Количественная оценка – определение процента стеноза и планиметрических параметров (площадь, длина и объем) позволяет определить степень выраженности патологии. Качественная оценка атеросклеротических изменений – структура АСБ, состояние её поверхности, наличие осложнений – важный параметр при стратификации риска ССО. Оптимальным является комплексный подход к описанию АСБ, включающий такие параметры, как структура, плотность, состояние поверхности, форма атеромы, подвижность АСБ. К клинически значимым изменениям относят изъязвление поверхности, кровоизлияние в бляшку и гипоэхогенные («мягкие») АСБ. Такие типы атером чаще ассоциируются с симптомами сосудисто-мозговой недостаточности. Наличие гипоэхогенных АСБ в сонных артериях у пациентов со стабильной стенокардией, независимо от других факторов риска сердечно-сосудистых осложнений, предсказывают развитие коронарных событий . Успехи патогенетической терапии (гиполипидемической, гипотензивной) могут приводить к замедлению развития АСБ. Прогрессирование каротидного атеросклероза, несмотря на адекватную терапию, соответствует удвоению кардиоваскулярного риска.
— Лодыжечно-плечевой индекс давления
Одним из методов диагностики и оценки степени выраженности атеросклероза артерий нижних конечностей является измерение регионального артериального давления в артериях нижних конечностей с оценкой ЛПИД, который рассчитывается как соотношение давления на лодыжке и давления на плече, определяемых с помощью ультразвукового исследования. У здорового человека ЛПИД колеблется от 0,9 до 1,3. При снижении этого параметра менее 0,9 следует предположить наличие гемодинамически значимой патологии артерий нижних конечностей.
Рекомендуемая схема ультразвукового исследования артериального русла у пациентов с нарушениями липидного обмена
Всем лицам при первичном выявлении дислипидемии показано проведение дуплексного сканирования экстракраниального отдела брахиоцефальных артерий. При выявлении АСБ в сонных или бедренных артериях у взрослых повторное исследование рекомендуется провести через 0,5 года, при отсутствии изменения структуры и размеров АСБ за этот период, динамическое наблюдение показано 1 раз в год. Пациентам старше 40 лет следует измерить ЛПИД. Ежегодное обследование должно включать измерение лодыжечно-плечевого индекса в случае выявления его низких значений, а также при наличии 2-х и более ФР при исходно нормальных значениях.
У лиц с дислипидемией и клиническими признаками недостаточности мозгового кровообращения необходимо проведение дуплексного сканирования брахиоцефальных артерий для исключения атеросклеротического поражения сосудов головного мозга (стеноз более 75%, изъязвление, кровоизлияние в АСБ, появление гипоэхогенных АСБ).
Появление симптомов перемежающей хромоты требует исследования ЛПИД.
Детям старше 10 лет с диагнозом «семейная гиперхолестеринемия» показано измерение ТИМ.
Определение коронарного кальция и неинвазивная коронарография c помощью мультиспиральной компьютерной томографии (МСКТ)
Ранняя диагностика коронарного атеросклероза с помощью МСКТ основана на обнаружении кальцинатов в атеросклеротических бляшках и количественной или полуколичественной оценке кальциноза. В отличие от других распространенных инструментальных методов раннего выявления (скрининга) коронарного атеросклероза, а также анализа ФР, КТ позволяет видеть прямые, а не косвенные признаки коронарного атеросклероза. Из морфологических исследований известно, что большинство атеросклеротических бляшек содержат кальцинаты. Небольшие депозиты кальция встречаются уже на ранних стадиях атеросклеротического процесса — начиная с липидных полос. Морфологические исследования показали высокую корреляцию между коронарным кальцинозом и степенью атеросклеротического поражения артерий.
МСКТ позволяет выявлять и количественно оценивать небольшие количества коронарного кальция и, в известной степени, оценивать наличие и тяжесть коронарного атеросклероза. Кальцинаты визуализируются из-за их высокой плотности по отношению к крови. Важнейшим аспектом оценки коронарного кальциноза является возможность количественной оценки степени кальциноза, выражаемой в единицах кальциевого индекса (КИ). Программное обеспечение томографа позволяет определять как величину, так и плотность кальцифицированного участка.
Еще одним способом определения и описания границ нормальных значений коронарного кальция является анализ процентильного распределения КИ. В рамках большого многоцентрового исследования MESA была изучена прогностическая значимость кальциноза коронарных артерий и создана одна из лучших референтных баз по определению возрастных норм коронарного кальция (www.mesa-nhlbi.org).
Выявление кальциноза коронарных артерий указывает на наличие у пациента коронарного атеросклероза. Однако наличие кальциноза коронарных артерий не является эквивалентом диагноза ИБС и не является обязательным показанием к коронарографии. Величина КИ коронарных артерий обязательно должна соотноситься с результатами клинического обследования, лабораторных методов и других методов диагностики.
Проведение МСКТ с целью выявления кальциноза коронарных артерий рекомендовано в следующих ситуациях:
- Обследование мужчин в возрасте 40-65 лет и женщин в возрасте 50-75 лет без установленных сердечно-сосудистых заболеваний с целью скрининга начальных признаков коронарного атеросклероза (при наличии у них ФР).
- Обследование пациентов, имеющих по данным международных шкал SCORE или NCEP промежуточный риск развития коронарных событий. Этот тест позволяет определить, относятся ли на самом деле эти пациенты (которые могут составлять до 40% популяции в возрасте старше 45 лет) к группе высокого или низкого коронарного риска.
- Обследование в амбулаторных условиях пациентов с атипичными болями в грудной клетке при отсутствии установленного диагноза ИБС или с сомнительными результатами нагрузочных тестов.
- Проведение дифференциального диагноза между хронической сердечной недостаточностью ишемического и неишемического (кардиопатии, миокардиты) генеза.
КТ-ангиография коронарных артерий
С помощью МСКТ с болюсным введением контрастного вещества (КТ-ангиография) возможно выполнение неинвазивной КТ-коронарографии. С ее помощью возможна детальная визуализация коронарных артерий и их ветвей.
На сегодняшний день можно следующим образом сформулировать основные показания квыполнению КТ-коронарографии:
- Неинвазивная коронарография у пациентов с предполагаемым или сомнительным диагнозом ИБС, когда отсутствуют явные показания к проведению коронарной ангиографии (КАГ). Выявление неизмененных коронарных артерий при КТ-ангиографии практически исключает вероятность наличия гемодинамически значимых стенозов. При обнаружении значимых коронарных стенозов по данным МСКТ больного направляют на КАГ для уточнения состояния коронарного русла и выбора метода реваскуляризации.
- Предоперационная оценка состояния коронарных артерий у пациентов, которым планируются различные виды оперативных вмешательств на сердце (без реваскуляризации, например, протезирование клапанов сердца) или других органах.
- Неинвазивная оценка состояния венозных и артериальных коронарных шунтов, стентов.
- Диагностика аневризм и врожденных аномалий коронарных артерий
- Уточнение данных КАГ, высокий риск выполнения КАГ.
- Случаи, когда требуется одновременная оценка состояния миокарда (рубцовые зоны) и коронарных артерий (например, при дифференциальной диагностике кардиомиопатий).
МРТ в диагностике атеросклероза сонных артерий
Для исследований сонных артерий применяют несколько методик МРТ. Основным методом выявления диагностики стенозов, окклюзий, аневризм и мальформаций экстра- и интракраниальных артерий является МР-ангиография (МРА). Этот метод позволяет получать двух- и трехмерные ангиографические изменения сонных, вертребральных и мозговых артерий на большом протяжении, с высоким пространственным разрешением, без артефактов, присущих УЗИ.
Современные принципы коронарной ангиографии у больных ИБС
Коронарная ангиография (КАГ) — рентгеновский метод изображения коронарных артерий при селективном введении контрастного вещества в устье коронарной артерии.
Целью КАГ является точное определение анатомии артерий сердца, вплоть до мельчайших ветвей, а также выявление патологических изменений. Информация, получаемая в ходе исследования, включает: установление анатомического типа кровоснабжения, протяженности и диаметра коронарных артерий, оценку степени их сужения, выявление рентгеноморфологичеких особенностей сужений (тип атеросклеротической бляшки, наличие пристеночного тромбоза или разрыва бляшки, отложений кальция, спазма артерии в пораженных сегментах), оценку коронарного кровотока. Кроме того, в ходе исследования определяется наличие и степень выраженности коллатерального кровоснабжения.
Противопоказания к КАГ
Считается, что абсолютных противопоказаний для проведения КАГ нет.
Относительными противопоказаниями считаются:
- Острая почечная недостаточность.
- Хроническая почечная недостаточность вследствие СД.
- Желудочно-кишечное кровотечение.
- Лихорадка неизвестной этиологии.
- Острые инфекционные заболевания.
- Острое нарушение мозгового кровообращения.
- Выраженная анемия.
- Злокачественная артериальная гипертония, рефрактерная к медикаментозной терапии.
- Выраженные нарушения электролитного обмена.
- Выраженное нарушение психического состояния больного.
- Сопутствующие заболевания, значительно укорачивающие жизнь больного или резко увеличивающие риск последующих лечебных вмешательств.
- Отказ больного от дальнейшего лечения (эндоваскулярная терапия, АКШ) после исследования.
- Интоксикация сердечными гликозидами.
- Документированный анафилактический шок на контрастное вещество в анамнезе.
- Выраженное поражение периферических артерий, ограничивающее артериальный доступ
- Декомпенсированная сердечная недостаточность или острый отек легких.
- Выраженная коагулопатия.
- Бактериальный эндокардит с вовлечением аортального клапана.
- Проведение КАГ в различных клинических ситуациях
- При появлении симптомов ИБС основными факторами, определяющими показания для проведения КАГ, являются степень выраженности клинических проявлений и выраженность ишемии миокарда по результатам неинвазивных тестов. Исключением могут быть определенные категории лиц, от работы которых зависит жизнь и безопасность других людей (летчики, водители общественного транспорта и др).
- КАГ часто проводится в рамках комплексного обследования у больных с некоронарогенными заболеваниями сердца (врожденные и приобретенные пороки сердца, застойная сердечная недостаточность и др).
- КАГ у больных со стабильной стенокардией
- Наличие тяжелой формы стенокардии (III или IV функционального класса).
- Отсутствие эффекта от антиангинальной терапии.
- Нарастание симптомов стенокардии на фоне терапии.
- Внезапная клиническая смерть или документированные эпизоды стойкой желудочковой тахикардии в анамнезе.
- КАГ у больных с бессимптомным или малосимптомным течением ИБС
- Выявление во время обследования показателей высокого риска неблагоприятных клинических исходов.
- Проведение КАГ у больных, реанимированных после внезапной сердечной смерти.
- Проведение КАГ у больных с нестабильной стенокардией (НС)
- Больным с низким риском неблагоприятных сердечно-сосудистых событий показано неинвазивное обследование и лечение в амбулаторных условиях с последующим проведением КАГ в плановом порядке. При наличии критериев среднего и высокого риска, неблагоприятных сердечно-сосудистых событий показана срочная госпитализация больного для интенсивного консервативного лечения. При отсутствии эффекта медикаментозного лечения показано проведение неотложной КАГ (в течение первых 6 часов после госпитализации). Если у этой же категории больных удается стабилизировать состояние медикаментозными средствами необходимо проводить отсроченую КАГ (в течение первых 24 ч с момента поступления в стационар).
- Отсроченная КАГ также показана больным с вазоспастической стенокардией Принцметала.
- КАГ у больных после операций реваскуляризации миокарда
- Рестеноз после эндоваскулярного лечения, сопровождающийся клиническими проявлениями (рецидивированием стенокардии и признаков ишемии миокарда).
- Рутинное проведение контрольной КАГ после эндоваскулярного лечения при отсутствии клинических симптомов не показано.
- Ограничения селективной рентгенконтрастной коронарографии
Несмотря на высокую диагностическую точность, селективная КАГ имеет ряд ограничений. Атеросклеротическая бляшка имеет сложную геометрическую форму и часто неадекватно визуализируется даже при использовании множественных ортогональных проекций. Это обусловлено извитостью артерий, частым наслоением боковых ветвей в области бифуркации, а также невозможностью выведения оптимальной проекции. Наиболее важным является интерпретация степени поражения основного ствола левой коронарной артерии, так как это имеет большое клиническое значение и влияет на тактику лечения больного.
Получаемое при контрастировании артерии изображение ее просвета не позволяет полностью исключить отсутствие атеросклероза в стенке оцениваемого сегмента сосуда. Начальные проявления атеросклероза не всегда выявляются вследствие «адаптивного» ремоделирования (увеличения диаметра) коронарной артерии (феномен Глагова). Небольшие атеросклеротические бляшки значимо не нарушают коронарный кровоток, однако, могут играть важную роль в возникновении ОКС, включая острый ИМ. При диффузном поражении степень стеноза часто недооценивается из-за невозможности определить локализацию нормального референсного сегмента артерии.
Ввиду вышеперечисленных ограничений, в сложных диагностических случаях дополнительно применяются новые методы внутрисосудистой визуализации (внутрисосудистый ультразвук, внутрисосудистая оптическая когерентная томография, ангиоскопия), а также методики, позволяющие оценить физиологическую значимость стеноза (внутрисосудистая доплерография, определение фракционного коронарного резерва). Эти методики применяются, как правило, во время КАГ или эндоваскулярного вмешательства и не могут полностью ее заменить. Кроме того, они значительно повышают стоимость исследования.
Хотя во время диагностической КАГ могут возникнуть серьезные последствия, риск их низок. По данным Общества сердечной ангиографии и инвазивных вмешательств США частота осложнений во время диагностической КАГ не превышает 2%.
Более тяжелые осложнения возникают чаще у больных с исходно высоким риском. Наиболее неблагоприятным фактором, повышающим риск осложнений, является нестабильность клинического состояния. Частота осложнений КАГ выше при проведении исследования в экстренном порядке.
Лабораторная диагностика
- ХС общий – в практике энзиматический метод, референтный химический метод; норма – до 5.17 ммоль/л, пограничное значение 6.2, высокое – более 6.2. Стабилен при хранении сыворотки 24 часа, уровень от времени приема пищи не зависит, в течение суток уровень стабилен. Целевое значение при лечении статинами – снижение менее 4.5 ммоль/л.
- ТГ – энзиматический метод; норма до 2.3 ммоль/л, пограничное значение до 4.5, высокое более 4.5. Хранение сыворотки допускается в замороженном виде; взятие крови – строго после 12-часового голодания (во избежание ложного завышения показателя из-за длительной циркуляции ХМ в крови). Есть циркадные ритмы – минимум уровня в 3 часа, максимум уровня в 15 часов.
- ЛПНП, ЛПВП, ЛПОНП – референтный метод ультрацентрифугирование, методы ИФА, электрофорез в геле используют для научных целей; в практике классы ЛП определяют по количеству содержащегося в них ХС, так как это быстрые, сравнительно недорогие и легко автоматизируемые методы для широкого клинического применения.
ХС-ЛПВП определяют прямым энзиматическим методом после осаждения других фракций, норма 0.9-1.9 ммоль/л; уровень менее 0.9 – высокий риск ИБС, уровень более 1.6 – благоприятный фактор защиты от ИБС.
ХС-ЛПОНП рассчитывают как ТГх0.46 (только в случае, если ТГ не выше 4.5).
ХС-ЛПНП можно определять прямым количественным методом. С целью экономии реагентов иногда применяют расчет по следующей формуле: ХС общ. – (ХС ЛПВП+ХС ЛПОНП) – при этом результаты теста считаются ориентировочными. В норме ХС-ЛПНП для взрослых не должен превышать 3.34 ммоль/л, для детей – не более 2.85.
Апобелки в практике определяют иммуно-турбидиметрическим методом, референтный метод — радиоиммунный анализ.
Апо А1 — норма для женщин 106 — 228 мг/дл, для мужчин 109 — 184 мг/дл. Уровень выше 125 мг/дл считается фактором защиты от ИБС.
АпоВ100 – норма 56-182 мг/дл для женщин и 63-188 для мужчин; превышение пограничного уровня требует обязательного лечения диетой и препаратами, блокирующими синтез липидов в связи с резко возрастающим риском развития ИБС, так как АпоВ100 количественно соответствует уровню ЛПНП и ЛПОНП.
ЛП(а) – надежный показатель для выявления наследственных форм ИБС. В норме его содержание 0-30 мг/дл, не меняется под действием статинов, повышение при диабете и нефротическом синдроме не доказано. Применяется для ранней диагностике семейной ИБС у молодых лиц. Не рекомендуется применять для массовых обследований бессимптомных пациентов.
Гомоцистеин (ГЦ) – независимый фактор риска поражения сосудов. Повышение его уровня резко увеличивает риск развития ИБС и ИБМ во всех группах, даже при нормальном уровне ХС. Является естественным продуктом метаболизма метионина, в норме в крови не накапливается в связи с быстрым разрушением в клетках при участии фолиевой кислоты, витамина В12 и В6. При замедлении его распада в клетках задерживается в крови и окисляется с образованием свободных радикалов, повреждающих эндотелий и окисляющих ЛПНП. ГЦ также подавляет синтез оксида азота и простациклина в эндотелии артерий. В норме уровень ГЦ 5-12 мкмоль/л, умеренное повышение 15-30 мкмоль/л, тяжелое – 30-100 мкмоль/л. Повышение свыше 22 мкмоль/л считается высоким фактором тромбоза глубоких вен, уровень ГЦ более 13 утраивает степень риска сердечного приступа у мужчин, резко ускоряет повреждение сосудов при диабете. У беременных повышенный уровень ГЦ приводит к ранним выкидышам и отслойке плаценты, рождению детей с дефектами развития.
Причиной гипергомоцистенинемии являются: врожденный дефект обмена гомоцистеина, дефицит фолата, витамина В12, В6 (неправильное питание, болезни желудка).
Внелабораторные ошибки при исследовании липидов.
- Взятие крови ненатощак (необходимо 12-часовое голодание перед забором крови) — завышаются ТГ, ЛПОНП, занижается ЛПНП.
- Применение недостаточно отмытых пробирок для взятия крови (поэтому предпочтительнее одноразовые пробирки)
- Наложение жгута более, чем на 2 минуты (на 5 мин. — завышает ХС на 10-15 процентов, на 15мин. — на 20-40 процентов!). Применение вакуумных пробирок позволяет набрать кровь при удалении жгута всего за 5-7 секунд.
- Хранение сыворотки допускается до 48 часов в холодильнике, до 1 месяца при –20 (только при отсутствии системы no-frost в морозильной камере!).
- Перед взятием крови пациент должен спокойно посидеть 5 –10 минут.
- Диагностическое определение должно проводиться до назначения лекарств на привычной диете, контрольные – с учетом лечения и диеты
Факторы, влияющие на уровень липидов в крови.
- Диета: калорийная пища, богатая жирами и углеводами повышает уровень ТГ, ХС, ЛПНП, ЛПОНП у 30 процентов людей. У вегетарианцев ХС и ЛПНП на 37 процентов ниже, чем при обычном питании. При потреблении рыбьего жира достоверно снижаются ТГ и ЛПОНП на 15-25 процентов.
- Курение: резко повышает ЛПНП и ЛПОНП, снижает АпоА1.
- Алкоголь: в дозе до 36г/сут. повышает АпоА1, в дозе 100 г/сут снижает ХС-ЛПВП и повышает ТГ.
- Физические нагрузки: повышают АпоА1, снижают АпоВ, ТГ, ЛПНП.
- Стрессы: кратковременно снижают АпоА1 и ЛПВП.
- Гипотиреоз: повышает на 30 процентов все атерогенные компоненты.
- Диабет: снижаются АпоА1, повышаются ХС, ТГ, ЛПНП, АпоВ (дефицит инсулина уменьшает активацию фермента ЛПЛ в крови).
- Острый период ОИМ: на срок 6-8 недель снижаются исходные уровни ХС, ЛПНП, АпоА1, АпоВ100, поэтому кровь берут либо в 1 сутки, либо по окончании острого периода.
- Остро-воспалительные процессы: повышаются ТГ, снижаются общий ХС, ХС-ЛПВП на период острой фазы.
- Лекарства: диуретики – тиазиды повышают ХС, ТГ, снижают АпоА1, гормональные контрацептивы действуют аналогично; эстрогенотерапия повышает АпоА1, снижает атерогенные фракции; статины снижают синтез ХС-ЛПНП, АпоВ начиная с 4-5 суток от начала приема на 25-50 процентов (не изменяя синтез ЛП(а)); гемофиброзил, рыбий жир, полиен снижают ТГ на 30-35 процентов; никотиновая кислота снижает ТГ на 40 процентов, ХС на 10-20 процентов.
Лабораторный контроль при лечении статинами.
При лечение статинами требуется индивидуальный подбор эффективной дозы и вида препарата и своевременное выявление побочных эффектов с использованием лабораторных исследований.
Холестерол общий – 3.1-5.2 ммоль/л в норме, при лечении – менее 4.2 ммоль/л ЛПНП (прямой количественный метод) – может использоваться как самостоятельный, более объективный, чем общий холестерол, показатель. Составляет в норме 1.56-3.4 ммоль/л, при лечении должен снизиться до 2.2-2.5 ммоль/л. Первичный эффект проявляется уже через 4-5 дней, максимальный стабильный эффект – через 1-3 месяца от начала приема препарата. Наиболее выраженный эффект дает розувастатин (крестор).
Побочные эффекты статинов – токсическое воздействие на печень и мышечную ткань – контролируются по уровню АлАТ (допускается увеличение не более, чем в 1.5 раза по сравнению с исходным уровнем) и КФК (не допускается превышение верхней границы нормы – 195 Е/л).
- ХС – холестерол
- ТГ – триглицериды
- ХМ – хиломикроны
- ЛП – липопротеиды (сложные транспортные формы, состоящие из апобелков и жировых компонентов).
- ЛПЛ – липопротеидлипаза (фермент для расщепления ХМ и ЛП в крови)
- ФЛ – фосфолипиды
- ЖК – жирные кислоты
- ЛХАТ – лецитинхолестеринацилтрансфераза-фермент для образования эфиров ХС в печени
- Апобелки – белковые части молекул липопротеидов
- ЛПВП – липопротеиды высокой плотности-антиатерогенная фракция
- ЛПНП – липопротеиды низкой плотности-атерогенная фракция
- ЛПОНП – липопротеиды очень низкой плотности-атерогенная фракция
- ИА – индекс атерогенности – соотношение ХС атерогенных фракций к ХС неатерогенной фракции,в норме составляет менее 3.5
Целевые содержание холестерина ЛПНП, которые необходимо достигать при лечении, а также уровни ЛНП, при которых нужно начинать медикаментозную терапию, представлены в таблице.
Нарушения липидного обмена
Одобрено на заседании Научно-практического совета Министерства здравоохранения Российской Федерации (заседание от 27.12.2022г)
В соответствии с Правилами поэтапного перехода медицинских организаций к оказанию медицинской помощи на основе клинических рекомендаций, разработанных и утвержденных в соответствии с частями 3, 4, 6 –9 и 11 статьи 37 Федерального закона «Об основах охраны здоровья граждан в Российской Федерации», утвержденных постановлением Правительства Российской Федерации от 19.11.2021 № 1968, клинические рекомендации применяются следующим образом:
– размещенные в Рубрикаторе после 1 июня 2022 года – с 1 января 2024 года.
Нарушения липидного обмена
Год утверждения: 2023 г.
Статус: Действует
ID: 752
Применение отложено
Определение заболевания или состояния (группы заболеваний или состояний)
Дислипидемии (ДЛП) — состояния, когда концентрации липидов и липопротеидов крови выходят за пределы нормы, могут быть вызваны как приобретенными (вторичными), так и наследственными (первичными) причинами [8].
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статической класификации болезней и проблем, связанных со здоровьем
E78.0 Чистая гиперхолестеринемия
Гиперлипопротеидемия Фредриксона, тип IIa
Гиперлипидемия, группа A
Гиперлипопротеидемия с липопротеидами низкой плотности
E78.1 Чистая гиперглицеридемия
Гиперлипопротеидемия Фредриксона, тип IV
Гиперлипидемия, группа B
Гиперлипопротеидемия с липопротеидами очень низкой плотности
E78.2 Смешанная гиперлипидемия
Обширная или флотирующая бета-липопротеидемия
Гиперлипопортеинемия Фредриксона, типы IIb или III
Гипербеталипопротеидемия с пре-бета-липопротеидемией
Гиперхолестеринемия с эндогенной гиперглицеридемией
Гиперлипидемия, группа C
E78.3 Гиперхиломикронемия
Гиперлипопротеидемия Фредриксона, типы I или V
Гиперлипидемия, группа D
E78.4 Другие гиперлипидемии
Семейная комбинированная гиперлипидемия

Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
— 800 RUB / 5500 KZT / 27 BYN — 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
Классификация
Классификация заболевания или состояния (группы заболеваний или состояний)
ДЛП классифицируют в зависимости от того, уровень каких именно липидов и липопротеидов выходит за пределы нормы. Крайне важно дифференцировать первичные и вторичные дислипидемии, так как в этих случаях принципиально отличается тактика лечения. В настоящее время ВОЗ принята классификация Fredrickson (1976), согласно которой выделяют несколько ее фенотипов (Таблица 1, Приложение А3). Следует подчеркнуть, что данная классификация не устанавливает диагноз, а лишь фиксирует тип ДЛП, вне зависимости от того, является ли она приобретенной или наследственной. Класификация также позволяет определить риск развития атеросклероза в зависимости от типа ДЛП. Так, IIа, IIb и III типы являются атерогенными, в то время как I, IV и V типы — «относительно» атерогенными. Классификация наследственных (семейных) дислипидемий приведена в таблице 2, приложение А3.
Принципы формулировки диагноза
Примеры формулировки диагноза
Гиперлипидемия (Гиперлипопротеидемия — ГЛП) IIa типа. Гиперлипопротеидемия(а).
Этиология и патогенез
Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Первичные дислипидемии имеют генетическую природу, развиваются в результате аномалий генов, которые регулируют функции рецепторов, ферментов или транспортных белков, участвующих в липидном обмене. В этих случаях они проявляются как семейные (наследственные) нарушения липидного метаболизма и относятся к первичным моногенным ДЛП. СГХС – это наследственное аутосомно-доминантное заболевание, обусловленное мутациями генов, кодирующие рецептор липопротеидов низкой плотности (LDLR), аполипопротеин В-100 (APOB) и профермента пропротеин-конвертаза субтилин/кексин типа 9 (PCSK9), сопровождающееся стойким повышением уровня холестерина (ХС) липопротеидов низкой плотности (ЛНП) и ранним развитием атеросклероза. Заболевание проявляется в виде двух форм: менее тяжелой гетерозиготной и более тяжелой гомозиготной [9]. Но в подавляющем большинстве случаев они развиваются как первичные полигенные ДЛП, т.е. являются следствием сочетания слабых генетических влияний с факторами внешней среды: курением, нарушением диеты, малоподвижным образом жизни. Наиболее атерогенными ДЛП являются изолированная гиперхолестеринемия (ГХС) (фенотип IIа), представленная семейной и полигенной ГХС, комбинированная гиперлипидемия (различные фенотипы гиперлипидемии в одной семье). Менее атерогенна изолированная гипертриглицеридемия (ГТГ) (фенотип IV или V). ГТГ натощак может быть связана с рядом факторов, внешних и внутренних. К внешним факторам, способствующим развитию ГТГ и, соответственно, высокой ее распространенности в популяции, относятся избыточное питание с преобладанием жирной пищи, простых углеводов с высоким гликемическим индексом (сахар, глюкоза), а также избыточное потребление алкоголя, длительный прием ряда лекарств, в первую очередь глюкокортикоидов, неселективных бета-адреноблокаторов. Вторичная ГТГ встречается значительно чаще первичной и может быть обусловлена, в первую очередь, инсулинорезистентностью и связанными с ней состояниями: СД 2 типа, метаболическим синдромом и ожирением. К метаболическим факторам, способствующим формированию ГТГ, относится низкая активность липолитических ферментов, в частности, периферической липопротеинлипазы (ЛПЛ), которая определяется или генетическими особенностями фермента, или повышением содержания в липопротеидах ингибиторов ЛПЛ в первую очередь апоCIII [10, 11]. Среди первичных причин повышения ТГ следует упомянуть наследственные механизмы (гиперпродукция ЛОНП, дефект гидролиза ТГ, дефект клиренса ремнантов ТГ в печени). [12]. Основными причинами вторичных ДЛП являются сахарный диабет (СД), гипотиреоз, хроническая болезнь почек (ХБП).
Патогенез атеросклероза, ассоциированного с ДЛП
Атеросклероз проявляется уплотнением сосудистой стенки и образованием атеросклеротических бляшек. Это динамичный процесс, для которого характерно как прогрессирование, так и обратное развитие изменений в стенке артерии. Однако со временем атеросклероз прогрессирует, приводя, в итоге, к клиническим проявлениям заболевания. К настоящему времени сложилось четкое представление об атеросклерозе как мультифакториальном заболевании, в основе которого лежат сложные нарушения в биохимических, иммунологических и молекулярно-генетических процессах. Сегодня доминируют две гипотезы развития и становления атеросклероза: гипотеза «ответ на повреждение» и липидно-инфильтрационная гипотеза. Гипотеза «Ответ на повреждение» ставит во главу угла нарушение целостности эндотелия в качестве инициирующего фактора атеросклеротического процесса. Факторы, вызывающие повреждение эндотелия, весьма многообразны, но наиболее распространены окись углерода, поступающая в кровь при активном и «пассивном» курении, повышение артериального давления, дислипидемия, в особенности ГХС, обусловленная либо семейной предрасположенностью, либо вредными привычками, в первую очередь, диетическими погрешностями. В качестве повреждающих агентов могут выступать модифицированные (окисленные, десиалированные) липопротеиды и целый ряд других, как эндогенных, так и экзогенных факторов. На месте повреждения эндотелия происходит адгезия моноцитов и тромбоцитов, сопровождающаяся миграцией моноцитов в интиму. Прогрессирующее утолщение интимы ведет к развитию гипоксии внутри бляшки и в близлежащих участках сосуда. Гипоксия является возможной причиной развития некротических изменений в ядре бляшки и усиленной васкуляризации бляшки из системы ваза вазорум адвентиции. Эти сосуды в сердцевине бляшки являются источником микрогеморрагий (апоплексии) в ней, что в свою очередь ведет к усилению ее тромбогенной активности. В результате ослабления мышечно-эластического слоя сосуда в коронарных артериях происходит их ремоделирование с дилатацией, причем внутренний диаметр просвета сосуда какое-то время поддерживается «нормальным», до тех пор, пока прогрессирующий рост бляшки не превысит компенсаторные возможности медиального слоя артерии, и не приведет к прогрессирующему сужению ее просвета. Именно на этом этапе бляшки приобретают характер нестабильных и играют основную роль в развитии осложнений атеросклероза. Кроме того, происходит изменение фенотипа гладклмышечных клеток, который при поврежедении сосудистой стенки, из сократительного переходит в секреторный с высвобождением провоспалительных цитокинов и активацией молекул адгезии.
Липидная теория атеросклероза предполагает пусковым моментом в развитии атеросклероза инфильтрацию интимы и субэндотелия липидами и липопротеидами. По мере накопления липидов в сердцевине бляшки, происходит увеличение ее размеров, в результате чего фиброзная покрышка бляшки под действием специфических энзимов (эластаз, металлопротеиназ) истончается и при определенных условиях (повышение артериального давления, значительная физическая нагрузка) разрывается. Разрыв сопровождается активацией каскада коагуляции крови, агрегации тромбоцитов с образованием тромба, блокирующего просвет сосуда. Клинически этот процесс проявляется, в зависимости от локализации либо нестабильной стенокардией, либо инфарктом миокарда (ИМ), либо ишемическим инсультом.
Эпидемиология
Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Так же, результаты исследования ЭССЕ-РФ, показали, что 23% лиц из популяции имели выраженное повышение уровня ОХС >6,2 ммоль/л, а выраженное повышение уровня ХС ЛНП >4,2 ммоль/л встречалось в 20,6%[152].
Взаимосвязь ДЛП с риском развития сердечно-сосудистых осложнений
Крупнейшим проспективным исследованием было исследование MRFIT (Multiple Risk Factor Intervention Trial). У 361662 обследованных мужчин 35-57 лет были определены основные факторы риска ИБС, включая липиды сыворотки крови. Впервые был определен пороговый уровень ОХС (5,2 ммоль⁄л), с которого регистрируется значительный прирост смертности от ИБС. Абсолютный риск ИБС при самых высоких средне-популяционных значениях ОХС был в 20 раз выше, чем при наиболее низких уровнях, равных 4,7 ммоль⁄л [14].
Мета-анализ 4-х проспективных эпидемиологических исследований (Фремингемское, MRFIT, Coronary Primary Prevention Trial, Lipid Research Clinic) выявил зависимость повышения уровня ХС ЛВП на 1 мг⁄дл и снижением на 2-3% риска ИБС, независимо от других ФР, включая ХС ЛНП [15].
В мета-анализе 17 проспективных популяционных исследований было показано, что повышение ТГ сыворотки крови на 1 ммоль⁄ л ассоциируется с увеличением новых случаев ИБС на 32% у мужчин и на 76% – у женщин [15]. По данным крупнейшего эпидемиологического исследования (Framingham Study), уровень ТГ более 1,7 ммоль/л означает достоверно более высокий риск развития ССО [15]. При достижении целевого уровня (ЦУ) ХС ЛНП
Клиническая картина
Cимптомы, течение
Клиническая картина заболевания или состояния (группы заболеваний или состояний)
К клиническим проявлениям заболевания приводят прогрессия атеросклеротического процесса, вызванного ДЛП. В зависимости от преимущественно пораженного сосудистого бассейна комплекс симптомов и синдромов широко варьирует. Основным осложнением атеросклероза коронарных артерий является ИБС, которая клинически проявляется стенокардией, ИМ, с частым исходом в хроническую сердечную недостаточность. Поражение магистральных артерий головного мозга проявляется симптомами его хронической ишемии с последующим развитием атеросклеротической энцефалопатии и/или инсульта. Атеросклероз артерий нижних конечностей сопровождается клинической картиной перемежающей хромоты. При отсутствии соответствующего лечения заболевание прогрессирует и может закончиться развитием гангрены нижних конечностей.
Диагностика
Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Критерии установления диагноза:
Диагноз ДЛП на основании значения липидных параметров устанавливается в соответствии с пороговыми значениями, указанными в таблице 2, Приложение А3.
Современный алгоритм обследования состоит из следующих основных этапов:
выявление основных факторов риска (ФР) (таблица 3, Приложение А3)
выявление клинических симптомов атеросклероза (данные опроса и осмотра);
определение липидного профиля (венозная кровь) с расчетом ХС ЛНП, ХС неЛВП;
оценка сердечно-сосудистого риска по шкале SCORE2;
исключение/верификация субклинического и клинически значимого атеросклероза (инструментальные методы обследования).
Жалобы и анамнез
Многие пациенты с повышенным уровнем липидов сыворотки крови могут не иметь никаких жалоб. Симптомы зависят от локализации атеросклеротического процесса — сосудистого бассейна, который преимущественно вовлечен в процесс. Поражение коронарного русла приводит к появлению болей в левой половине грудной клетки, загрудинной области при физической нагрузке или в покое, нарушениям сердечного ритма (жалобы на неритмичное, резко учащенное сердцебиение или ощущение «замирания», «перебоев в работе сердца»), одышки, отеков нижних конечностей. При локализации атеросклеротического процесса преимущественно в цереброваскулярном бассейне превалируют жалобы на головную боль, субъективное чувство головокружения, снижение памяти, внимания, работоспособности, появление «шума в ушах», «шума в голове». Развитие облитерирующего атеросклероза артерий нижних конечностей приводит к перемежающей хромоте, в тяжелых случаях – появлению интенсивных болей в нижних конечностях в покое, больше в ночное время, в горизонтальном положении пациента (интенсивность болевого синдрома может снижаться после пациента перехода в положение сидя/стоя).
На первом этапе обследования собирается анамнез, во время которого выясняется наличие у пациента ИБС, АГ, СД, атеросклероза периферических артерий, семейной гиперхолестеринемии (СГХС), метаболического синдрома, ожирения, ХБП. При сборе семейного анамнеза, особое внимание должно уделяться раннему проявлению ССЗ у родственников пациента 1-й линии родства.
Физикальное обследование
Всем пациентам для выявления клинических признаков нарушений липидного обмена и признаков состояний/заболеваний, обусловленных нарушениями липидного обмена, рекомендовано проводить физикальное обследование в объеме: осмотр (липоидная дуга роговицы у лиц моложе 45 лет, ксантелазмы, ксантомы); пальпация основных магистральных артерий верхних и нижних конечностей, сонных артерий; определение характера пульса; аускультация сердца и магистральных сосудов; измерение окружности талии [153-154].
ЕОК/ЕОА нет (УУР C, УДД 5)
Комментарии. Ксантомы (xanthomata) – это очаговые образования различного цвета (от нормального до желто-коричневого, оранжевого или розового); чаще всего располагаются в области сухожилий, суставов, на ладонях, стопах, ягодицах, бёдрах. Гистологически ксантомы представляют собой скопление ксантомных (пенистых) клеток, клеток-макрофагов, нагруженных липидами. Ксантомные клетки обычно имеют одно ядро, но встречается и многоядерные клетки типа инородных тел (клетки Тутона); среди них могут быть гистиоциты и лимфоидные клетки. Фиброз обычно не наблюдается. В старых очагах преобладают фибробласты и новообразованные коллагеновые волокна, окружающие группы пенистых клеток. В дальнейшем фиброзная ткань замещает пенистые клетки. Различают 4 клинические разновидности ксантом- плоскую, множественную узелковую (эруптивные ксантомы), туберозную, сухожильную. Плоские ксантомы (xanthoma planes) наблюдаются чаще у пожилых людей, представляют собой желтовато-оранжевые плоские или слегка выпуклые полосы в складках ладони и пальцев. Эруптивные ксантомы (син.: xanthoma papulosum multiplex, множественные узелковые ксантомы) характеризуются множественными плоскими или полусферическими узелками от 2 до 6 мм в диаметре, желтоватого или желтовато-оранжевого цвета с розово-синюшным венчиком у основания. Элементы высыпаний могут быть рассеянными по всему кожному покрову, но чаще – на разгибательных поверхностях конечностей, в области суставов, спины, ягодиц. Туберозные ксантомы (син.: xanthoma tuberosum, туберкулёзная ксантома, узловатая ксантома) встречаются у больных с семейной гиперхолестеринемией в области разгибательных поверхностей коленных и локтевых суставов, на ягодицах. Высыпания симметричны – безболезненные, плотной консистенции узлы величиной от 1,5 до 3,5 см в диаметре, желтоватого цвета с буроватым или синюшным оттенком. Сухожильные ксантомы (син.: xanthoma tendinеа, ксантома сухожилий) – плотные, медленно увеличивающиеся, опухолевидные образования желтого цвета, располагающиеся в области ахилловых сухожилий и сухожилий разгибателей пальцев.
Ксантелазмы — это плоские, желтые, образования на коже век Величина их колеблется от нескольких миллиметров до 3-5 см и более.
Липидная дуга роговицы имеет диагнстическое значение у лиц моложе 40-45 лет.
Лабораторные диагностические исследования
- Всем лицам старше 40 лет рекомендуется скрининг, включающий анализ крови по оценке нарушений липидного обмена биохимический (липидный профиль) с целью стратификации сердечно-сосудистого риска по шкале SCORE2 [50, 241].
ЕОК/ЕОА I C (УУР С, УДД 5)
Пациентам с дислипидеией рекомендуется лабораторное исследование с определением уровня глюкозы, креатинина, мочевины, общего билирубина в крови, определение активности АЛТ, АСТ, КФК в крови и общий (клинический) анализ крови [154].
ЕОК/ЕОА I C (УУР С, УДД 5)
Определение уровеня ХС ЛВП в крови рекомендовано всем пациентам для дополнительной оценки риска в системе SCORE2 [50, 241].
ЕОК/ЕОА I C (УУР С, УДД 5)
У всех пациентов старше 40 лет рекомендовано определять уровень ХС ЛНП как главный показатель оценки сердечно-сосудистого риска [19, 20, 21].
ЕОК/ЕОА I C (УУР С, УДД 4)
Пациентам высокого/очень высокого риска рекомендуется, кроме уровня ХС ЛНП, ХС неЛВП в крови [155, 156].
ЕОК/ЕОА IIa C (УУР B, УДД2)
У пациентов с ГТГ, СД, ожирением, метаболическим синдромом рекомендовано проводить лабораторную оценку ХС неЛВП – для более точной оценки сердечно-сосудистого риска [20, 21, 22].
ЕОК/ЕОА I C (УУР А, УДД 1)
В случаях, когда трактовка сердечно-сосдистого риска вызывает затруднения(сомнения) в особенности у пациентов с ГТГ, СД, ожирением, метаболическим синдромом рекомендовано лабораторное исследование уровня атерогенного аполипопротеина В100[20].
ЕОК/ЕОА I C (УУРС, УДД 5)
Хотя бы раз в жизни у любого взрослого рекомендовано измерить уровень Лп(а) в крови. При значении Лп(а)>180 мг/дл риск эквивалентен гетерозиготной СГХС [20].
ЕОК/ЕОА IIa C (УУР С, УДД 5)
У пациентов с отягощённым семейным анамнезом рекомендовано измерять уровень Лп(а) в крови. Уровень Лп(а)>50 мг/дл ассоциируется с увеличением сердечно-сосудистого риска. [20].
ЕОК/ЕОА IIa C (УУРС, УДД 5)
Комментарии. Принципы определения уровня липидов сыворотки крови: традиционно образцы крови для анализа липидов берутся натощак, однако последние исследования говорят о том, что колебания концентрации липидов плазмы крови незначительны в зависимости от приема пищи [23, 24].Однако у лиц с ГТГ забор крови рекомендуется проводить натощак.
Референсный метод определения уровня ХС ЛНП является многостадийным:
1) ультрацентрифугирование в плотности 1,006 г/мл в течение 18 часов для удаления липопротеидов, богатых ТГ (ХМ и ЛОНП);
2) выделение донной фракции (плотности 1,006 г/мл) и преципитация в ней липопротеидов, содержащих апоВ смесью гепарин и MnCl2 для выделения ЛВП;
3) определение концентрации ХС в донной фракции и супернатанте референсным методом для определения ХС (модифицированный метод Абеля-Кендалла);
4) вычисление ХС ЛНП как разности для значений ХС в донной фракции и ХС ЛВП. Препаративное выделение методом ультрацентрифугирования в солевом растворе определенной плотности позволяет изолировать ЛНП и определить их состав.
Длительность и трудоемкость ультрацентрифугирования привела к разработке методов, более доступных для лабораторной практики. Самым распространенным способом определения уровня ХС ЛНП в клинических лабораториях является расчетный. В этом случае необходимо определить уровень ХС, ТГ и ХС ЛВП в крови и концентрацию ХС ЛВП в супернатанте после преципитации липопротеидов, содержащих апоВ (ЛОНП и ЛНП), и вычислить значение концентрации ХС ЛНП по формуле Фридвальда:
ХС ЛНП (в мг/дл) = общий ХС – ХС ЛВП – ТГ/5
ХС ЛНП (в ммоль/л) = общий ХС – ХС ЛВП – ТГ/2,2
В основе этой формулы лежат два допущения: 1) большая часть ТГ плазмы находится в ЛОНП; 2) массовое отношение ТГ/ХС в ЛОНП равно 5:1.
Формула Фридвальда позволяет получить значения ХС ЛНП, сопоставимые с полученными референсным методом при ТГ < 200 мг/дл, при концентрации 200–400 мг/дл возможна ошибка рассчетов. Применение этой формулы при концентрации ТГ>400 мг/дл, наличии хиломикронов (ХМ), ДЛП III типа приводит к завышению содержания ХС ЛОНП и занижению ХС ЛНП и не позволяет получить сопоставимые результаты. В настоящее время разработаны прямые методы выделения ЛНП, пригодные для использования в клинико-диагностической лаборатории [5]. Исследовать уровень липидов с целью скрининга для определения риска не обязательно натощак. Однако при таком определении уровня липидов риск может быть недооценен у больных сахарным диабетом, так как в одном исследовании пациенты с диабетом имели на 0,6 ммоль/л ниже ХС ЛНП после приема пищи [8]. В последующем, для уточненной и дальнейшей характеристики тяжелых ДЛП, а также для наблюдения пациентов, рекомендуется определять уровень липидов натощак.
Пациентам с клиническими проявлениями СГХС (ССЗ у мужчин моложе 55 лет и женщин моложе 60 лет, ксантоматоз, гиперхолестеринемия (ХС ЛНП >5 ммоль/л. у взрослых, >4 ммоль/л. у детей) для установления клинического диагноза СГХС рекомендуется использовать диагностические критерии Голландских липидных клиник (Dutch Lipid Clinic Network — DLCN) (Таблица 3/А3) [50, 153].
ЕОК/ЕОА I C (УУР C, УДД 5)
Инструментальные диагностические исследования
Неинвазивные методы визуализации могут обнаружить наличие, оценить степень и оценить клинические последствия атеросклеротического повреждения сосудов. Визуализация коронарных артерий с помощью компьютерной томографии (КТ) сердца и сонных артерий методом дуплексного сканирования экстракраниальных отделов брахиоцефальных артерий являются информативными в выявлении атеросклеротического поражения артерий. Обнаружение кальцификации коронарной артерии с помощью неконтрастной КТ дает хорошую оценку атеросклеротической нагрузки и тесно связано с ССО. КТ-ангиография имеет высокую чувствительность 95-99% и специфичность 64-83% для диагностики ИБС [25]. Для скрининга атеросклероза коронарных артерий может использоваться кальциевый индекс (КИ), определяемый при КТ по Agatston [26]. Это исследование позволяет обеспечить дополнительную стратификацию риска [27], имеет меньшую стоимость, не требует внутривенного введения контрастных веществ (Таблица 4, Приложение А3). Использование КИ улучшает как дискриминацию, так и реклассификацию категории риска [28, 29]. Оценка атеросклеротических бляшек в сонной или бедренной артерии с помощью ультразвука является прогностическим фактором сердечно-сосудистых событий, сравнимым с КИ [30, 31], в то время как измерение толщины интимы-медиа сонной артерии уступает КИ и наличию бляшек в сонной артерии [32, 33] и не используется в качестве стратификатора риска.
У бессимптомных лиц с умеренным риском наличие КИ > 100 единиц по Agatston и наличие атеросклеротических бляшек в сонной или бедренной артерии по данным дуплексного сканирования может перевести их в категорию более высокого риска. При этом КИ невысок и имеет низкую специфичность у пациентов моложе 45 лет с тяжелой СГХС, включая гомозиготную СГХС (гоСГХС).
Всем пациентам с дислипидемией рекомендовано дуплексное сканирование брахиоцефальных артерий [34]
ЕОК/ЕОА IIaВ (УУР А, УДД1)
У пациентов с выявленными атеросклеротическими бляшками в сонной или бедренной артерии по данным дуплексного сканирования рекомендовано реклассифицировать категорию риска от низкого и умеренного до высокого с целью эффективного управления определяющими риск факторами [34, 35, 50].
ЕОК/ЕОА IIaВ (УУР А, УДД1)
У пациентов с коронарным атеросклерозом и значением КИ выше 100 единиц по данным КТ сердца рекомендовано реклассифицировать категорию риска от низкого и умеренного до высокого с целью эффективной корекции факторов риска [36, 33].
ЕОК/ЕОА IIaВ (УУР В, УДД 2)
Иные диагностические исследования
Иные диагностические исследования в рамках диагностики ДЛП не предусмотрены, возможно расширение диагностических исследований по решению врача в зависимости от клинической ситуации и состояния пациента.
Оценка сердечно-сосудистого риска
ЕОК/ЕОА IC (УУР C, УДД 5)
Пациентов с установленными ранее ССЗ, СГХС, СД, ХБП 3-5 стадий, очень высоким риском по шкале SCORE2 или уровнем ХС ЛНП >4,9 ммоль/л рекомендовано относить к категории высокого или очень высокого риска с целью эффективного управления определяющими ФР [8, 50].
ЕОК/ЕОА IC (УУР C, УДД 5)
Комментарии. В РФ для расчета риска фатальных и нефательных сердечно-сосудистых осложнений в процентах в течение ближайших 10 лет следует использовать шкалу SCORE2 для стран с высоким сердечно-сосудистым риском (приложение Г2) [254]. Для оценки риска по шкале SCORE2 следует выбрать квадрат в зависимости от пола, возраста и статуса курения пациента. В найденном квадрате следует отыскать ячейку, наиболее соответствующую уровню систолического АД и ХС неЛВП данного пациента. Оценка риска по шкале SCORE2 не рекомендована у лиц с подтвержденным ССЗ, СД, ХБП, с единственным, но выраженным ФР (например, тяжелая АГ), с СГХС. Такие пациенты автоматически относятся к группе очень высокого и высокого риска ССО и требуют интенсивной коррекции ФР. Наличие стеноза более 50% в крупных (магистральных) артериях любого сосудистого бассейна по данным любых инструментальных методов исследования, даже в отсутствие клинических симптомов, также переносит пациента в категорию очень высокого риска.
Категории сердечно-сосудистого риска, согласованные со шкалой SCORE2, представлены в Приложении Г2.
Следует обратить особое внимание на выделение внутри категории очень высокого риска категории экстремального риска. К экстремальному риску следует относить: наличие 2 и более сердечно-сосудистых осложнений в течение 2 лет, несмотря на оптимальную гиполипидемическую терапию и/или достигнутый уровень ХС ЛНП
Под атеросклеротическим сердечно-сосудистым заболеванием (АССЗ) подразумевают все проявления ИБС, ишемический инсульт или транзиторное нарушение мозгового кровообращения, атеросклероз артерий нижних конечностей.
Пациентов с СГХС и АССЗ рекомендовано относить к категории очень высокого риска с целью эффективного управления определяющими ФР [37].
ЕОК/ЕОА IC (УУР В, УДД 2)
Пациентов с СГХС без АССЗ рекомендовано относить к категории высокого риска с целью эффективного управления определяющими ФР [37].
ЕОК/ЕОА IC (УУР В, УДД 2)
Лечение
Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Решение о тактике лечения рекомендуется принимать в зависимости от исходного уровня сердечно-сосудистого риска. Тактика немедикаментозной и медикаментозной терапии суммирована в таблице 1, Приложение Б4.
1. Целевые уровни ХС ЛНП
ЕОК/ЕОА IС (УУР С, УДД 5)
У пациентов с подтвержденным АССЗ, перенесших повторное сосудистое событие в течение 2 лет (в любом сосудистом бассейне), несмотря на прием максимально переносимой дозы ингибитора гидроксиметилглутарил-кофермента А (ГМГ-КоА) редуктазы, рекомендован целевой уровень ХС ЛНП
ЕОК/ЕОА IIbB (УУРС, УДД 5)
У пациентов высокого риска рекомендован целевой уровень ХС ЛНП
ЕОК/ЕОА IA (УУР С, УДД 5)
У пациентов умеренного риска рекомендован целевой уровень ХС ЛНП
ЕОК/ЕОА IIaА (УУРС, УДД 5)
У пациентов низкого риска рекомендован целевой уровень ХС ЛНП
ЕОК/ЕОА IIbA (УУРС, УДД 5)
Комментарии. Статины — C10AA ингибиторы ГМГ-КоА-редуктазы.
2. Немедикаментозное лечение ДЛП
Для профилактики ССЗ доказала свое преимущество диета [44] с высоким уровнем употребления фруктов, овощей, цельнозерновых злаков и клетчатки, орехов, рыбы, птицы и молочных продуктов с низким содержанием жира и ограниченным потреблением сладостей, сладких напитков и красного мяса. Рекомендуется использовать жиры растительных масел. Такая диета является эффективным средством первичной и вторичной профилактики атеросклероза [45]. В частности, многоцентровое рандомизированное исследование PREDIMED, выполненное в Испании, у лиц из группы высокого риска, но без ССЗ, доказало снижение частоты основных ССО (ИМ, инсульт или смерть от сердечно-сосудистой причины) на 28-31% при ежедневном употреблении оливкового масла или орехов [46]. Наблюдательные исследования подтверждают рекомендации о том, что потребление рыбы, по крайней мере, дважды в неделю и омега-3 полиненасыщенных жирных кислот в низких дозах в качестве пищевой добавки могут снижать риск сердечно-сосудистой смерти и инсульта в первичной профилактике без влияния на метаболизм липопротеидов плазмы [47]. Оценка биологически активных добавок и функциональных продуктов питания должна в обязательном порядке включать в себя не только доказательства полезных свойств по влиянию на липидный профиль и атеросклероз, но, также и хорошую переносимость. Важным является производственный стандарт для указанных продуктов, гарантирующий стандартизацию и качество. К пищевым добавкам, влияющим на липидный профиль относится красный дрожжевой рис (монаколин), действие которого, как и статинов, связано с ингибированием ГМГ-КоА-редуктазы. В крупном исследовании, выполненном в Китае у больных с ИБС, монаколин снижал частоту ССО на 45% [48]. Гипохолестеринемический эффект (снижение ХС ЛНП на 15-25%) наблюдается при ежедневном приеме монаколина K в дозе 10 мг. [49]. Монаколин К можно применять, с учетом доказанной клинической эффективности и безопасности, у лиц низкого и умеренного риска с умеренно повышенным ХС ЛНП и отсутствием показаний для приема статинов. Влияние изменения образа жизни на уровень липидов и рекомендации по диете для улучшения общего профиля липопротеидов представлены в Приложении В («Информация для пациентов») и таблице П2, приложении Б4.
3. Медикаментозная терапия ДЛП
3.1 Общие принципы медикаментозной терапии
Комментарии: при планировании гиполипидемической терапии рекомендуется придерживаться следующей схемы:
— оценить общий риск развития ССЗ;
— обсудить с пациентом особенности профилактики ССЗ;
— определить ЦУ ХС ЛНП в соответствии с категорией риска;
— подсчитать в процентах степень снижения уровня ХС ЛНП, необходимого для достижения целевого значения;
— выбрать из группы статинов препарат, который может обеспечить такой уровень снижения ХС ЛНП;
-эффективность и переносимость терапии статинами вариабельны, поэтому может потребоваться титрация дозы препарата;
— если монотерапия статином не позволяет достичь цели, следует рассмотреть возможность комбинированной терапии, в том числе статина с эзетимибом, предпочтительно в одной таблетке или капсуле (зарегистрированы розувастатин+эзетимиб и аторвастатин+эзетимиб) (у лиц очень высокого риска возможно начать гиполипидемическую терапию сразу с комбинации статина с эзетимибом).
— врачу убедить пациента в необходимости непрерывной (пожизненной) гиполипидемической терапии.
3.2 Основные классы препаратов для лечения дислипидемий
К средствам, корригирующим ДЛП, относятся статины, эзетимиб, фибраты, другие гиполипидемические средства (эзетимиб, омега-3 триглицериды, включая другие эфиры и кислоты (омега-3 ПНЖК), алирокумаб**, эволокумаб**, инклисиран**).
Статины являются одними из наиболее изученных классов препаратов в профилактике ССЗ. Результаты многочисленных клинических исследований свидетельствуют о том, что статины значительно снижают заболеваемость и смертность от ССЗ при первичной и вторичной профилактике во всех возрастных группах, как у мужчин, так и у женщин. В клинических исследованиях статины замедляли прогрессирование и даже вызывали регрессию атеросклеротической бляшки. Крупнейший метаанализ 19 исследований с различными статинами показал снижение смертности от всех причин на 14%, частоты сердечно-сосудистых событий на 27%, нефатальных и фатальных коронарных осложнений на 27%, инсульта на 22% при снижении уровня ХС ЛНП на 1,0 ммоль/л [51]. Относительное снижение риска при первичной профилактике сопоставимо с таковым во вторичной профилактике. Доступные данные позволяют предположить, что клинический эффект в значительной степени зависит не от препарата, а от степени снижения ХС ЛНП. В РФ представлены (в порядке убывания гиполипидемического эффекта) розувастатин в дозах 5, 10, 15, 20 и 40 мг, аторвастатин** — 10, 20, 30, 40 и 80 мг/сут, питавастатин — 1, 2 и 4 мг, симвастатин** — 10, 20 и 40 мг. Максимальное снижение ХС ЛНП на 50–55% возможно при применении высоких доз розувастатина и аторвастатина**. Статины различаются по своим свойствам всасывания, биодоступности, связывания с белками плазмы, выведения и растворимости. Всасывание препаратов варьирует от 20 до 98%. Многие статины в значительной степени подвергаются метаболизму в печени с участием изоферментов цитохрома P450, за исключением правастатина, розувастатина и питавастатина. Препараты, потенциально взаимодействующие с статинами, представлены в таблице П3, приложении Г4 [52, 53, 54, 55, 56, 57, 58, 59, 60]. Важно отметить, что по данным опубликованного в 2014 году метаанализа 8 важнейших рандомизированных клинических исследований с статинами (n=38153, 6286 ССО у 5387 человек) была продемонстрирована меньшая частота ССО при уровне ХС ЛНП 4,5 ммоль/л (175 мг/дл) было отмечено прогрессивное снижение относительного риска развития сердечно-сосудистых осложнений в зависимости от уровня ХС ЛНП: 2,0–2,6 ммоль/л (75–100 мг/дл), 1,3–2,0 ммоль/л (50–75 мг/дл), и
Фибраты. Механизм их действия заключается в активации альфа-рецепторов, активируемых активатором пероксисом (РРARα), расположенных в печени, мышцах, жировой ткани, сердце, почках, макрофагах и тромбоцитах. Основная роль PPARα-рецепторов заключается в регуляции метаболизма липидов и липопротеидов, воспаления, функции эндотелия. Активированные PPARα-рецепторы связываются со специфическими участками ДНК, стимулируя или угнетая основные гены, кодирующие метаболические процессы. При этом необходимо отметить, что из класса фибратов только фенофибрат** может использоваться в комбинации со статинами [44]. Фенофибрат** увеличивает синтез апоА1, апоА2, активность ЛПЛ и снижает синтез апоСIII, апоВ100 и концентрацию малых плотных частиц ЛНП на 50%. Это ведет к увеличению уровня ХС ЛВП на 10–30%, ускорению превращения ХМ в их ремнанты, снижению уровня ХС ЛНП на 25%, уменьшению синтеза ТГ и ЛОНП. Уровень ТГ может снижаться до 50% [62, 63]. Помимо влияния на обмен липидов, фенофибрат** снижает уровень мочевой кислоты в среднем на 25%, фибриногена на 21%, С-реактивного белка на 34% [62, 63].
Ингибиторы абсорбции холестерина. Эзетимиб ингибирует всасывание в кишечнике холестерина, поступающего с пищей и из желчи, не влияя на всасывание других жирорастворимых пищевых веществ. Ингибируя всасывание ХС на уровне ворсинок слизистой тонкого кишечника (путем взаимодействия с белком NPC1L1), эзетимиб снижает количество холестерина, поступающего в печень. В ответ на снижение поступления ХС печень активирует на своей поверхности рецепторы ЛНП, что ведет к увеличению клиренса ХС ЛНП из крови. В клинических исследованиях монотерапия эзетимибом сопровождалась снижением уровня ХС ЛНП на 15–22%. Комбинация эзетимиба с статинами обеспечивала дополнительное снижение уровня ХС ЛНП на 15-20%. В исследовании SHARP (Study of Heart and Renal Protection) у пациентов с ХБП было отмечено снижение частоты развития ССЗ в основной группе, получавшей терапию эзетимибом в сочетании с симвастатином** по сравнению с группой, получавшей плацебо, на 17% [64]. Исследование IMPROVE-IT (Improved Reduction of Outcomes: Vytorin Efficacy International Trial) — самое крупное и продолжительное рандомизированное клиническое исследование по применению эзетимиба, включившее 18144 больных, госпитализированных по поводу острого коронарного синдрома [38]. На момент включения больные не получали эзетимиба или максимальной дозы любого статина, но должны были иметь относительно невысокий уровень ХС ЛНП (1,3-3,2 ммоль/л или 50-125 мг/дл). Период наблюдения за больными достигал 7 лет. Через 1 год наблюдения средний уровень ХС ЛНП в группе эзетимиба составил 1,4 ммоль/л (54 мг/дл), что на 0,4 ммоль/л (14 мг/дл) меньше, чем в группе симвастатина**. В группе комбинированного лечения было продемонстрировано значимое снижение суммарного количества смертельных исходов вследствие сердечно-сосудистых причин, ИМ, госпитализации по поводу нестабильной стенокардии, коронарной реваскуляризации и инсульта на 6,4% (относительный риск (ОР)=0,936; 95% доверительный интервал (ДИ)=0,89–0,99, р=0,016), снижение абсолютного риска — на 2,0% [38]. Таким образом, эзетимиб может быть использован в качестве средства второй линии в комбинации со статинами, когда монотерапия статинами не позволяет достичь целевого уровня даже при их назначении в максимальных дозах, а также при непереносимости статинов или наличии противопоказаний к их применению.
Ингибиторы пропротеиновой конвертазы субтилизин-кексина типа 9 (PCSK9) Алирокумаб ** и эволокумаб ** (по АТХ — C10AX Другие гиполипидемические средства) являются ингибиторами (моноклональными антителами к) PCSK9 — белка, контролирующего экспрессию рецепторов к ХС ЛНП гепатоцитов [65]. Повышенные уровень/функция PCSK9 снижают экспрессию рецепторов ЛНП и увеличивают концентрацию ХС ЛНП в плазме, в то время как снижение уровня/функции PCSK9 вызывает снижение ХС ЛНП в плазме крови [66]. Алирокумаб** в дозировках 75 и 150 мг и эволокумаб** в дозировке 140 мг подкожно с частотой введения 1 раз в 2 недели в клинических исследованиях показали возможность снижения уровня ХС ЛНП на 60% и риска сердечно-сосудистых осложнений на 15% у больных с АССЗ в комбинации с умеренной и высокоинтенсивной терапией статинами. Исследование FOURIER (Further cardiovascular OUtcomes Research with PCSK9 Inhibition in subjects with Elevated Risk) включило 27564 пациентов с атеросклеротическим поражением различных сосудистых бассейнов: 22040 пациентов (81%) в прошлом перенесли ИМ (из них 5500 в сроки от 4 недель до 1 года перед включением в исследование), у 5330 (19%) в анамнезе был негеморрагический инсульт и у 3640 (13%) — периферический атеросклероз. Пациенты находились на адекватной гиполипидемической терапии: 69,2% получали статины в режиме высокой интенсивности и 30,4% — умеренной интенсивности, у 5,1% дополнительно к статину назначали эзетимиб. Участники, рандомизированные в группу активного лечения, получали эволокумаб** подкожно в дозе 140 мг 1 раз в 2 недели или 420 мг в месяц, тогда как пациентам в группе контроля на протяжении исследования подкожно вводили плацебо [40]. Медиана наблюдения в исследовании составила 2,2 года. Была подтверждена высокая гиполипидемическая эффективность эволокумаба**: уровень ХС ЛНП снизился на 59% с 2,40 ммоль/л до 0,78 ммоль/л. Впервые было продемонстрировано положительное влияние терапии эволокумабом** на сердечно-сосудистые исходы: частота событий, оцениваемых по первичной конечной точке, в группе эволокумаба** была ниже на 15% (ОР=0,85, 95% ДИ=0,79-0,92, p <0,001), а по вторичной точке — ниже на 20% (ОР=0,80, 95% ДИ=0,73–0,88, p <0,001), чем в группе плацебо. Чуть позднее были представлены результаты дополнительного, заранее спланированного анализа, целью которого было определение связи между границами и степенью снижения уровня ХС ЛНП и частоты ССО [67]. В этот анализ были включены 25982 человека (94% от общего количества рандомизированных, 13013 — на эволокумабе**, 12969 — плацебо). Их ранжировали по уровню достигнутого к 4-й неделе лечения ХС ЛНП на 5 подгрупп: <0,5 ммоль/л (n=2669), 0,5–1,3 ммоль/л (n=8003), 1,4–1,8 ммоль/л (n=3444), 1,9–2,6 ммоль/л (n=7471), >2,6 ммоль/л (n=4395). Было отмечено, что при снижении ХС ЛНП вплоть до 0,2 ммоль/л (7,7 мг/дл) уменьшается частота ССО без увеличения риска нежелательных явлений. Однако статистически значимое снижение частоты событий из первичной и вторичной конечных точек было показано только в первых двух подгруппах низких значений ХС ЛНП, т.е. менее 0,5 и 1,3 ммоль/л: на 24% и 15% [ОР=0,76 (0,64–0,90) и 0,85 (0,76–0,96)] для первичной точки и на 31% и 25% [0,69 (0,56–0,85)] и [0,75 (0,64–0,86)] для вторичной точки, соответственно. В связи с этими данными авторы отметили целесообразность пересмотра целевого уровня ХС ЛНП в современных рекомендациях для лиц очень высокого сердечно-сосудистого риска. Исследование ODYSSEY OUTCOMES (Evaluation of Cardiovascular Outcomes After an Acute Coronary Syndrome During Treatment With Alirocumab) с участием 18 924 пациентов с перенесенным 1–12 месяцев назад ОКС продемонстрировало, что алирокумаб** статистически значимо снижает риск крупных сердечно-сосудистых событий. Они отмечались у 903 пациентов (9,5%) в группе терапии препаратом алирокумаб** и у 1052 пациентов (11,1%) в группе плацебо, что соответствует снижению относительного риска на 15% (ОР 0,85; 95% ДИ, 0,78–0,93; p<0,001). Кроме того, на фоне алирокумаба ** снижался риск смерти от всех причин на 15%. У пациентов с исходно более высоким уровнем ХС ЛНП (≥100 мг/дл/2,6 ммоль/л) при применении алирокумаба ** отмечалось более выраженное снижение риска сердечно-сосудистых событий на 24% ниже (ОР 0,76; 95% ДИ, 0,65–0,87), а смерти от всех причин — на 29% (ОР 0,71; 95% ДИ, 0,56–0,90), в сравнении с плацебо [41].
Инклисиран** — это химически модифицированная двухцепочечная малая интерферирующая рибонуклеиновая кислота (миРНК). В гепатоцитах инклисиран** использует механизм РНК-интерференции, чтобы нацелиться на матричную РНК PCSK9 и запустить процесс ее деградации, тем самым увеличивая рециркуляцию и экспрессию рецепторов ЛНП, с последующим увеличением его захвата и уменьшением уровня ХС ЛНП в крови [157–160]. Инклисиран** вводится подкожно 3 раза в первый год, а затем два раза в год.
В группе клинических исследований ORION (A Randomized Trial Assessing the Effects of Inclisiran on Clinical Outcomes Among People With Cardiovascular Disease) 9, 10, 11 была подтверждена долгосрочная гиполипидемическая эффективность инклисирана** для следующих групп пациентов: СГХС, АССЗ и эквиваленты сердечно-сосудистого риска, такие как как СД 2 типа, СГХС или 10-летний риск ССО >20% по Фрамингемской шкале или эквивалентной ей. Было установлено, что назначение инклисзирана приводит к снижению уровня ХС ЛНП у указанных категорий больных на 50–58%, как в краткосрочной, так и в долгосрочной перспективе [161, 162]. Профиль безопасности инклисирана** сопоставим с плацебо [161, 162], не было получено данных о возникновении специфических серьезных нежелательных явлений, возникших в ходе лечения [50]. В метаанализе по результатам трех рандомизированных клинических исследований было показано снижение частоты серьезных неблагоприятных сердечно-сосудистых событий на 24% (отношение рисков = 0,76; 95% доверительный интервал, 0,61–0,92) [252].
Омега-3 ПНЖК в соответствии с современными воззрениями являются основными препаратами для снижения уровня ТГ. Недавно завершившееся исследование REDUCE-IT (Cardiovascular Risk Reduction with Icosapent Ethyl for Hypertriglyceridemia) с участием 8179 пациентов доказало влияние омега-3 ПНЖК на твердые конечные точки [68]. Критериями включения были: установленные в анамнезе ССЗ (~70% пациентов) или СД 2-го типа + >1 ФР, уровень ТГ ≥2,3 ммоль/л и 1,03 ммоль/л и ≤2,6 ммоль/л. Первичной конечной точкой являлось время от рандомизации до первого события: сердечно-сосудистая смерть, нефатальный ИМ, нефатальный ишемический инсульт, реваскуляризация, нестабильная стенокардия. Было продемонстрировано снижение относительного риска развития серьезных неблагоприятных СС событий на 25% (р <0,001), в группе пациентов, принимавших омега-3 ПНЖК (форма эйкозопентаеновой кислоты 4 г/сут) в сравнении с плацебо. Таким образом, Омега-3 триглицериды, включая другие эфиры и кислоты, могут использоваться для терапии ГТГ в дозе 2–4 г/сут.
Сравнение эффективности статинов, фибратов и эзетимиба представлено в таблице П4, приложении Г4.
Сводные данные по эффективности, дозам, побочным эффектам гиполипидемических препаратов приведены в таблице П8, приложении Г4.
3.3 Медикаментозная терапия ДЛП для достижения целевого уровня ХС ЛНП
Всем пациентам с ДЛП рекомендована терапия статином в дозах, необходимых для достижения целевого уровня ХС ЛНП [39, 69, 70].
Комментарии: дозы статинов для интенсивного и умеренного снижения ХС ЛНП приведены в таблице П4, приложение Б3. При непереносимости высокоинтенсивной терапии статинов следует рассмотреть снижение дозы препарата с последующей переоценкой переносимости.
ЕОК/ЕОА IA (УУР В, УДД 1)
Пациентам, не достигшим целевого уровня ХС ЛНП на фоне максимально переносимых доз статинов, следует рассмотреть возможность комбинированной терапии, в том числе статин с эзетимибом, предпочтительно в одной таблетке или капсуле (зарегистрированы розувастатин+эзетимиб и аторвастатин+эзетимиб) [38].
ЕОК/ЕОА IВ (УУР А, УДД 2)
У пациентов с очень высоким риском и недостижением целевого уровня ХС ЛНП на фоне максимально переносимых доз статина в комбинации с эзетимибом рекомендовано добавить алирокумаб** (ЕОК/ЕОА I A), эволокумаб**(ЕОК/ЕОА I A) или инклисиран** (ЕОК/ЕОА нет) с целью вторичной профилактики ССЗ [40, 41, 67, 243].
(УУР А, УДД 1)
В случае значительного повышения уровня ХС ЛНП у больных очень высокого риска (выше 4,0 ммоль/л), рекомендуется рассмотреть возможность инициального назначения статина и эзетимиба, предпочтительно в одной таблетке или капсуле (зарегистрированы розувастатин+эзетимиб и аторвастатин+эзетимиб) [244].
ЕОК/ЕОА нет (УУР А, УДД 1)
В случае значительного повышения уровня ХС ЛНП у больных экстремального или очень высокого риска (выше 5,0 ммоль/л), рекомендуется рассмотреть возможность инициального назначения статина максимально переносимой дозе+эзетимиб+ингибитора PCSK9: алирокумаба** (ЕОК/ЕОА I A), эволокумаба** (ЕОК/ЕОА I A) или инклисирана** (ЕОК/ЕОА нет) [243, 245, 246,255].
(УУР А, УДД 1)
У пациентов с очень высоким риском, без СГХС, и недостижением целевого уровня ХС ЛНП на фоне максимально переносимых доз статина с/без эзетимибом рекомендовано добавить алирокумаб**, эволокумаб** или инклисиран** [40, 41, 67, 243] с целью первичной профилактики ССЗ.
ЕОК/ЕОА IIbC (УУР А, УДД 2)
Пациентам с непереносимостью любой дозы статина рекомендован прием эзетимиба [71, 72].
ЕОК/ЕОА IIаC (УУР А, УДД 2)
Пациентам с непереносимостью любой дозы статина, которые на фоне приема эзетимиба не достигли целевого уровня ХС ЛНП, рекомендовано добавление к терапии алирокумаба**, эволокумаба** или инклисирана** [71, 72, 73, 243].
ЕОК/ЕОА IIbC (УУР А, УДД 2)
Комментарии: степень снижения уровня ХС ЛНП при различных вариантах гиполипидемической терапии указан в таблице А3.11. Алгоритм медикаментозной терапии достижения целевого уровня ХС ЛНП приведен в Приложении Б2.
3.4 Медикаментозная терапия гипертриглицеридемии
- Пациентам любой категории риска рекомендован целевой уровень ТГ
ЕОК/ЕОА IIaC (УУР B, УДД 2)
Комментарии: важными причинами остаточного риска являются высокий уровень ТГ и низкий уровень ХС ЛВП в плазме крови. Даже при достижении целевого уровня ХС ЛНП у пациентов сохраняется остаточный риск ССО. По данным крупнейшего эпидемиологического исследования (Framingham Study), уровень ТГ
Пациентам высокого и очень высокого риска, достигшим на терапии статином уровня ТГ 1,7–2,3 ммоль/л, рекомендовано добавить препарат омега-3 ПНЖК в дозе до 2 г 2 раза в день [68].
ЕОК/ЕОА IIaВ (УУР В, УДД 2)
Пациентам с уровнем ТГ> 2,3 ммоль/л на терапии статином, рекомендовано добавить фенофибрат** (предпочтительно в одной таблетке (зарегистрирован розувастатин+фенофибрат) или препарат омега-3 ПНЖК в дозе до 2 г 2 раза в день [68, 77, 78, 79].
Комментарии: В исследовании ECLIPSE-REAL к концу 12 недель терапии комбинацией фенофибрата** и статина значительно снизили ОХС, ТГ, ХС ЛНП, ХС ЛОНП, но более значимым и статистически значимым снижение было в группе, получавшей комбинацию розувастатина и фенофибрата** [164–166].
ЕОК/ЕОА IIaВ (УУР С, УДД 5)
Пациентам с уровнем ТГ > 5,0 ммоль/л, рекомендовано назначить фенофибрат** и препарат омега-3 ПНЖК в дозе до 2 г 2 раза [242].
ЕОК/ЕОА IIaВ (УУР В, УДД 2)
Алгоритм выбора медикаментозной терапии ГТГ представлен в приложении Б1.
4. Аппаратное лечение ДЛП
Подразумевает такие экстракорпоральные методы удаления атерогенных липопротеидов как плазмаферез, плазмосорбция. Они назначаются пациентам, у которых после 6 месяцев комбинированной гиполипидемической терапии в максимально переносимых дозах не достигнуты целевые уровни ХС ЛНП. Помимо этого, плазмаферез, плазмосорбция проводятся по следующим показаниям: гомозиготная СГХС и ХС ЛНП >7,8 ммоль/л, или гетерозиготная СГХС и ХС ЛНП >7,8 ммоль/л + 1 дополнительный фактор сердечно-сосудистого риска, или гетерозиготная СГХС и ХС ЛНП > 5,0 ммоль/л + 2 фактора риска или уровень Лп(а) >50 мг/дл; гетерозиготная СГХС и ХС ЛНП >4,1 ммоль/л у лиц очень высокого риска; СГХС при отмене гиполипидемической терапии в связи с беременностью при высоком риске сердечно-сосудистых осложнений [8].
Плазмаферез, плазмосорбция проводятся еженедельно или 1 раз в две недели. Во время процедуры из плазмы крови пациента удаляется до 80% уровня ХС ЛНП, при этом концентрация уровня ХС ЛНП в плазме крови пациента в зависимости от объема обработанной плазмы снижается на 70–80%. В настоящее время существует ряд методов плазмафереза, плазмосорбции ХС ЛНП: каскадная плазмофильтрация, гепарин-преципитация ЛНП (HELP), аффинная плазмо- и гемосорбция липопротеидов, иммуносорбция ЛНП.
Плазмаферез, плазмосорбция проводятся только в специализированных отделениях больниц и клиник.
Показания к ЛНП и Лп(а) плазмаферезу, плазмосорбции приведены в таблице П3, приложении Б.
5. Лечение ДЛП в отдельных клинических ситуациях
5.1 Семейная гиперхолестеринемия
Определение. Эпидемиология
Семейная гиперхолестеринемия (СГХС) — генетически детерминированное моногенное нарушение липидного обмена с преимущественно аутосомно-доминантным типом наследования, сопровождающееся значительным повышением уровня ХС ЛНП в крови и, как следствие, преждевременным развитием и прогрессирующим течением атеросклероза, как правило, в молодом возрасте [9, 220]. Различают две формы: гетерозиготную (геСГХС) и гомозиготную (гоСГХС). В структуре моногенных дислипидемий геСГХС занимает первое место по распространенности и составляет в среднем 1 на 200–250 человек [9, 220]. Согласно результатам эпидемиологического исследования, проведенного в ряде регионов Российской Федерации, распространенность геСГХС колеблется от 1:108–1:173 лиц [221]. ГоСГХС встречается значительно реже, распространенность составляет 1 случай на 160–300 тыс. населения Европы [222].
Этиология и патогенез
Генетические основы заболевания
Развитие СГХС обусловлено дефектами генов белков, участвующих в метаболизме липопротеидов, в результате которых нарушается захват клетками ЛНП-частиц и в крови повышается уровень ХС ЛНП [223, 224].
Самая частая генетическая причина СГХС — мутация в гене рецептора липопротеидов низкой плотности (LDLR), который расположен главным образом на поверхности гепатоцитов и играет ключевую роль в связывании и выведении из кровотока циркулирующих ЛНП-частиц [225, 226]. На сегодняшний день известно более 1600 мутаций LDLR, способных нарушить функцию рецептора и вызывать развитие СГХС. Мутации в гене LDLR обуславливают от 85 до 90% случаев СГХС [227].
Вторая по частоте причина — мутация в гене аполипопротеина В (APOB), кодирующего апобелок В100, входящий в состав ЛНП-частиц и ответственный за связывание ЛНП с рецептором. В результате изменений в гене половина ЛНП-частиц не способна связаться с ЛНП-рецептором [228]. Мутации гена APOB обеспечивают от 5 до 10% случаев СГХС [229]. Показано, что носители мутаций гена LDLR имеют более высокий уровень ОХС и ХС ЛНП и более выраженные проявления атеросклероза артерий, чем носители мутаций гена APOB [230].
Третий ген, мутации в котором способны приводить к развитию СГХС, — это ген, кодирующий пропротеинконвертазу субтилизин/кексин тип 9 (PCSK9 — ПКСК9) — сериновую протеазу, участвующую в разрушении ЛНП-рецептора [231, 232, 233]. Мутации гена PCSK9 обеспечивают меньше 5% случаев СГХС [227]. Уровни ХС ЛНП у носителей миссенс-мутаций PCSK9 очень варьируют от относительно умеренных до очень высоких [234].
Диагностические критерии заболевания
Потенциальную вероятность наличия СГХС необходимо оценивать в случаях [235, 236]:
ОХС ≥8 ммоль/л и/или ХС ЛНП ≥5 ммоль/л без терапии для взрослых и ОХС> 6,7 ммоль/л или ХС ЛНП ≥3,5 ммоль/л у детей,
Ранний дебют ССЗ атеросклеротического генеза (у мужчин
Кожные / сухожильные ксантомы,
Случай внезапной сердечной смерти члена семьи.
С учетом генетической предиспозиции быстрая прогрессия атеросклероза у пациентов с СГХС приводит к раннему дебюту ССЗ атеросклеротического генеза, чаще всего — ИБС. Длительное бессимптомное течение заболевания диктует необходимость опираться в первую очередь на лабораторные показатели и семейный анамнез при выявлении новых случаев СГХС для своевременного старта терапии в зоне первичной профилактики.
Для клинической диагностики заболевания целесообразно использование специализированных критериев, разработанных для взрослых и детей с геСГХС и для пациентов с гоСГСХ. Крайне важно проведение дообследования с целью исключения вторичных дислипидемий и их вклада в повышенные значения ХС ЛНП у лиц с подозрением на СГХС.
Диагностические критерии геСГХС
Ø Для диагностики геСГХС у взрослых пациентов 18 лет и старше рекомендовано использовать диагностические критерии Dutch Lipid Clinic Network (DLCN) — шкалы Голландских липидных клиник (Приложение Г1) [50, 235].
ЕОК/ЕОА I С (УУРС, УДД 5)
- Диагноз устанавливается на основании суммы баллов, полученных в каждой группе. Внутри группы баллы не суммируются, учитывается только один признак, дающий максимальное количество баллов внутри каждой из групп.
В соответствии с набранной суммой баллов геСГХС может быть определенной, вероятной или возможной. При этом диагноз геСГХС выставляется только при наличии определенной или вероятной формы.
Для определения 95-го перцентиля уровня ХС ЛНП в зависимости от пола и возраста следует использовать значения, приведенные в Таблице П6/А3 (Популяционные показатели ХС ЛНП в зависимости от пола и возраста, по данным исследования ЭССЕ-РФ) [152].
Ø Для диагностики геСГХС у взрослых пациентов 18 лет и старше только в случаях отсутствия возможности определения ХС ЛНП, а также у детей рекомендовано использовать диагностические критерии Simon Broome Registry — Саймона Брума (Таблица 7/А3) [235, 237].
ЕОК/ЕОА I С (УУРС, УДД 5)
Ø Диагноз геСГХС выставляется в случае соответствия пациента критериям определенного или вероятного диагноза СГХС.
Диагностические критерии гоСГХС
Ø Для диагностики гоСГХС и у взрослых, и у детей рекомендовано использовать критерии, предложенные экспертами европейского общества по атеросклерозу (Таблица 8/А3) [222].
ЕОК/ЕОА I С (УУР А, УДД 3)
Согласно данным критериям, диагноз гоСГХС выставляется у детей и взрослых при наличии одного из двух условий.
Таким образом, диагностика СГХС возможна без выполнения молекулярно-генетического исследования по клиническим критериям, однако выявление конкретной мутации существенно облегчает постановку диагноза СГХС и последующее проведение каскадного скрининга, а также позволяет точнее стратифицировать сердечно-сосудистый риск [238].
Выполнение молекулярно-генетического исследования для верификации СГХС показано лицам с суммой баллов 6 и более согласно клиническим критериям DLCN или при постановке диагноза геСГХС согласно критериям Саймона Брума [239, 240].
ЕОК/ЕОА I С (УУРА, УДД 2)
Каскадный скрининг
Каскадный скрининг рекомендован к проведению родственникам первой, второй, и если возможно, третьей степени родства пациента с установленным диагнозом СГХС, а в случае, если у пробанда выявлен патогенный или вероятно-патогенный вариант нуклеотидной последовательности генов LDLR, APOB, PCSK9, — проведение генетического каскадного скрининга у родственников пробанда с целью определения у них наличия или отсутствия данного генетического варианта. При подтверждении наличия патогенных или вероятно-патогенных вариантов у родственника рекомендовано выставление диагноза СГХС, даже если уровень ХС ЛНП ниже диагностических значений согласно клиническим критериям [235, 237].
ЕОК/ЕОА I С (УУРС, УДД 5)
Лечение
Целевые уровни ХС ЛНП
У пациентов очень высокого риска с СГХС рекомендовано достижение целевого уровня ХС ЛНП
ЕОК/ЕОА IIaС (УУР С, УДД 5)
У пациентов очень высокого риска с СГХС и АССЗ рекомендовано достижение целевого уровня ХС ЛНП
ЕОК/ЕОА IС (УУР С, УДД5)
У пациентов высокого риска с СГХС рекомендовано достижение целевого уровня ХС ЛНП
ЕОК/ЕОА IA (УУР С, УДД 5)
Гиполипидемическую терапию рекомендовано инициировать сразу после установления диагноза.
Всем пациентам с СГХС рекомендована стартовая терапия статином в дозах, необходимых для достижения целевого уровня ХС ЛНП [39, 69, 70].
ЕОК/ЕОА IA (УУР В, УДД 1)
Комментарии: дозы статинов для интенсивного и умеренного снижения ХС ЛНП приведены в таблице 4, приложение Б3. При непереносимости высокоинтенсивной терапии статинами следует рассмотреть снижение дозы препарата с последующей переоценкой переносимости.
Пациентам, не достигшим целевого уровня ХС ЛНП на фоне максимально переносимых доз статина, рекомендуется комбинированная терапия статином с эзетимибом предпочтительно в одной таблетке (зарегистрированы розувастатин+эзетимиб и аторвастатин+эзетимиб) [38].
ЕОК/ЕОА IВ (УУР А, УДД 2)
У пациентов с очень высоким риском и недостижением целевого уровня ХС ЛНП на фоне максимально переносимых доз статина в комбинации с эзетимибом рекомендовано добавить алирокумаб**(ЕОК/ЕОА I A), инклисиран**(ЕОК/ЕОА нет) или эволокумаб**(ЕОК/ЕОА I A) с целью вторичной профилактики ССЗ [40, 41, 67, 243].
(УУР А, УДД 2)
Пациентам с непереносимостью любой дозы статина рекомендован прием эзетимиба для достижения целевого уровня ХС ЛНП [71, 72].
ЕОК/ЕОА IIаC (УУР А, УДД 2)
Пациентам с непереносимостью любой дозы статином, которые на фоне приема эзетимиба не достигли целевого уровня ХС ЛНП, рекомендовано добавление к терапии алирокумаба**(ЕОК/ЕОА IIbC), инклисирана**(ЕОК/ЕОА нет) или эволокумаба**(ЕОК/ЕОА IIbC) [71, 72, 73, 243]
ЕОК/ЕОА IIbC (УУР А, УДД 1)
Пациентам очень высокого риска с СГХС, если не достигнут целевой уровень ХС ЛНП на максимально переносимых дозах статина в комбинации с эзетимибом, рекомендовано добавление к терапии алирокумаба** (ЕОК/ЕОА IC), инклисирана** (ЕОК/ЕОА нет) или эволокумаба** (ЕОК/ЕОА IC) [9, 74, 75, 243, 247]
(УУР A, УДД 1)
5.2 ДЛП и сахарный диабет
У пациентов с СД 2-го типа и категории очень высокого риска рекомендовано снижение ХС ЛНП ≥50% и < 1,4 ммоль/л [39, 80, 81].
ЕОК/ЕОА IА (УУР В, УДД 1)
У пациентов с СД 2-го типа и категории высокого риска рекомендовано снижение ХС ЛНП ≥50% и < 1,8 ммоль/л [50, 80, 167].
ЕОК/ЕОА IА (УУР С, УДД 5)
Пациентам с СД 1-го типа и высоким/очень высоким риском рекомендована терапия статином [50, 82].
ЕОК/ЕОА IА (УУР С, УДД 5)
Пациентам с СД, которым начата терапия ингибитором ГМГ-КоА-редуктазы, но целевой уровень ХС ЛНП не достигнут, рекомендована интенсификация терапии [50].
ЕОК/ЕОА IIaС (УУР С, УДД 5)
Пациентам с СД2, на фоне терапии статином, но с уровнем ТГ ≥ 2,3 ммоль/л, рекомендовано добавление фенофибрата** к терапии статиом, предпочтительно в одной таблетке (зарегистрирован розувастатин+фенофибрат) [79, 167].
ЕОК/ЕОА IIa B (УУР В, УДД 2)
Комментарии: длительное наблюдение за больными СД на фоне комбинированной терапии фенофибратом** и статином позволило доказать состоятельность такой стратегии в плане долгосрочного прогноза — выявлено снижение общей и сердечно-сосудистой смертности. На протяжении всех трех временных срезов было получено достоверное снижение количества больших ССО на 34–36% [248].
Пациентам с СД, у которых после интенсификации терапии статином целевой уровень ХС ЛНП не достигнут, рекомендовано статину добавить эзетимиб [38, 83], в том числе статин с эзетимибом в одной таблетке или капсуле (зарегистрированы розувастатин+эзетимиб и аторвастатин+эзетимиб).
ЕОК/ЕОА IА (УУР А, УДД 2)
Рекомендуется назначение других гиполипидемических средств, таких как ингибиторы PCSK9 — алирокумаба**, эволокумаба** или инклисирана** всем пациентам с СД2 высокого и очень высокого сердечно-сосудистого риска с недостаточным снижением ХС ЛНП на фоне приема максимально переносимых доз статинов и эзетимиба для достижения ЦУ ХС ЛНП и снижения риска ССО [50, 249].
ЕОК/ЕОА IА (УУР С, УДД 5)
Пациенткам с СД до наступления менопаузы и планирующим беременность или не принимающим контрацептивы не рекомендована терапия статином [8, 50].
ЕОК/ЕОА IIIC (УУР C, УДД 5)
Пациентам с СД 1-го типа и СД 2-го типа в возрасте ≤30 лет с повреждением органов-мишеней и/или ХС ЛНП>2,5 ммоль/л рекомендована терапия статином [8, 50, 81].
ЕОК/ЕОА IIbC (УУР C, УДД 5)
Комментарии. Согласно Российским рекомендациям по лечению сахарного диабета 2019 года (IX пересмотр), рекомендациям ESC по лечению дислипидемии 2019 г, терапию АССЗ в сочетании с СД 2-го типа следует начинать с ингибиторов натрий-зависимого переносчика глюкозы 2-го типа или с аналогов глюкагоноподобного пептида-1. У пациентов с СД 2-го типа и ССЗ, имеющих очень высокий и высокий сердечно-сосудистый риск, в качестве гипогликемической терапии рекомендованы эмпаглифлозин** для снижения риска новых сердечно-сосудистых событий или дапаглифлозин** для снижения риска госпитализаций по причине сердечной недостаточности [87].
Для ведения пациентов с ССЗ с целью снижения сердечно-сосудистого риска рекомендуются:
Ингибиторы натрийзависимого переносчика глюкозы 2-го типа: эмпаглифлозин**, дапаглифлозин**. Аналоги глюкагоноподобного пептида 1 (аГПП-1): лираглутид, дулаглутид, семаглутид.
Бигуаниды: метформин** (как препарат второго ряда).
Ингибиторы натрийзависимого переносчика глюкозы 2-го типа
По итогам исследования EMPA-REG Outcome было на фоне эмпаглифлозина(**) продемонстрировано снижение частоты достижения первичной конечной точки на 14% (p=0,038), при этом результаты по каждому из компонентов комбинированной точки были различными: общая смертность снизилась на 32% (p<0,001), сердечно-сосудистая смертность — на 38% (p<0.0001) [84].
Аналоги ГПП-1. В 2016 г. опубликованы результаты исследования LEADER, посвященного эффективности и безопасности лираглутида. Данное многоцентровое двойное слепое плацебо-контролируемое исследование проводилось в 410 центрах 32 стран и включало 9340 пациентов, из которых 4668 были рандомизированы в группу лираглутида, 4672 — в группу плацебо. Частота сердечно-сосудистой смерти была ниже в группе лираглутида (4,7%), чем в группе плацебо (6.0%, ОР 0,78, ДИ 0,66–0,93, p=0,007), общей смертности — 8,2% и 9,6%, соответственно, (ОР 0,85, ДИ 0,74-0,97, p=0,02). Было продемонстрировано снижение риска достижения первичной комбинированной тройной конечной точки на 13%, сердечно-сосудистой смерти — на 22%, композитной конечной точки (коронарная реваскуляризация, нестабильная стенокардия, госпитализация по поводу сердечной недостаточности) — на 20%, риска смерти от всех причин — на 15%, увеличение времени до наступления микрососудистого события (нефропатии) — на 22% [85]. Влияние терапии семаглутидом на сердечно-сосудистые исходы изучалось в исследовании SUSTAIN-6. 3297 пациентов с СД 2-го типа и высоким сердечно-сосудистым риском были рандомизированы в группы семаглутида (0,5 или 1 мг 1 раз в неделю) или плацебо в дополнение к стандартной противодиабетической и сердечно-сосудистой терапии. У 83% включенных пациентов было установлено наличие сердечно-сосудистых заболеваний и/или ХБП III–V стадии. Срок наблюдения составил 104 недели. Выявлено уменьшение риска комбинированной тройной конечной точки на фоне приема семаглутида на 26%, инсультов на 38%, при этом препарат не уменьшал частоты общей и сердечно-сосудистой смертности, нефатального ИМ и госпитализации по поводу сердечной недостаточности [86].
Для снижения количества ССО и улучшения прогноза больных СД 2-го типа рекомендуется отдавать приоритет препаратам с подтвержденными сердечно-сосудистыми преимуществами. С учетом имеющихся доказательств благоприятного влияния эмпаглифлозина** и лираглутида на ССО, данные препараты следует рассматривать, наряду с метформином**, в качестве первой линии терапии больных СД 2-го типа высокого и очень высокого риска. При наличии ХСН предпочтение отдается эмпаглифлозину**.
У пациентов с СД 2-го типа и ССЗ, имеющих очень высокий и высокий сердечно-сосудистый риск, в качестве гипогликемической терапии рекомендованы эмпаглифлозин** или дапаглифлозин** для снижения риска новых сердечно-сосудистых событий [87].
ЕОК/ЕОА IА (УУР А, УДД 1)
У пациентов с СД 2-го типа и ССЗ в качестве гипогликемической терапии рекомендован эмпаглифлозин** для снижения риска смерти [88].
ЕОК/ЕОА IB (УУР A, УДД 1)
У пациентов с СД 2-го типа и ССЗ, имеющих очень высокий и высокий сердечно-сосудистый риск, в качестве гипогликемической терапии рекомендован лираглутид для снижения риска как новых ССО, так и риска смерти [85].
ЕОК/ЕОА IB (УУР А, УДД 2)
У пациентов с СД 2-го типа без ССЗ рекомендован метформин** для снижения сердечно-сосудистого риска [89].
ЕОК/ЕОА IIaС (УУР А, УДД 2)
5.3 ДЛП и хроническая болезнь почек
На начальных стадиях ХБП повышены уровни ТГ, а уровни ХС ЛВП снижены. Для ХБП характерен увеличение уровня Лп(a). Пациенты с ХБП 3–5-й стадии имеют высокий или очень высокий сердечно-сосудистый риск [90, 91].
У диализ-независимых пациентов ХБП 3–5-й стадии рекомендуется применение статина или комбинации статин / эзетимиб [92, 93, 94, 95].
ЕОК/ЕОА IА (УУР В, УДД 1)
У пациентов с ХБП 5-й стадии с атеросклеротическим ССЗ, уже получающих статин, эзетимиб, или комбинацию статин / эзетимиб, при начале диализа, рекомендовано продолжить исходную гиполипидемическую терапию [92, 93, 96, 97, 98].
ЕОК/ЕОА IIaC IА (УУР В, УДД 1)
Пациентам с ХБП 1-4 стадии и уровнем ТГ >1,7 ммоль/л рекомендовано рассмотреть назначение омега-3 ПНЖК с целью снижения уровня ТГ [168-170].
ЕОК/ЕОА IIaВ (УУР А, УДД 2)
У пациентов c диализ-зависимой ХБП и не имеющих атеросклеротических ССЗ, не рекомендуется начало терапии статином [99, 100]
ЕОК/ЕОА IIIA (УУР А, УДД 2)
5.4 ДЛП и ОКС/чрескожные коронарные вмешательства
У всех пациентов с ОКС при отсутствии противопоказаний или установленной непереносимости рекомендовано начать или продолжить терапию статином в высоких дозах как можно раньше, вне зависимости от исходных значений ХС ЛНП [101, 102, 103].
ЕОК/ЕОА IА (УУР А, УДД 2)
Всем пациентам через 4–6 недель после ОКС рекомендовано оценить достижение целевых показателей ХС ЛНП (снижение на 50% от исходного и
ЕОК/ЕОА IIaC (УУР А, УДД 1)
Пациентам, через 4–6 недель после ОКС не достигшим целевых уровней ХС ЛНП на фоне максимально переносимых доз статином, рекомендована комбинация статина с эзетимибом [38], в том числе статин с эзетимибом в одной таблетке или капсуле (зарегистрированы розувастатин+эзетимиб и аторвастатин+эзетимиб).
ЕОК/ЕОА IА (УУР А, УДД 2)
Пациентам после ОКС при недостижении целевых уровней ХС ЛНП через 4–6 недель на фоне максимально переносимых доз статином с и без эзетимиба рекомендовано присоединение алирокумаба** или эволокумаба** [40, 41, 250–252].
ЕОК/ЕОА IВ (УУР А, УДД 2)
Пациентам с противопоказаниями к терапии статином или подтвержденной непереносимостью статинов рекомендована терапия эзетимибом [71, 72].
ЕОК/ЕОА IIaC (УУР А, УДД 2)
У пациентов с ОКС, которые при поступлении имеют уровень ХС ЛНП выше целевого, несмотря на терапию максимально переносимыми дозами статина и эзетимибом, рекомендовано раннее назначение (во время госпитализации в связи с коронарным событием) алирокумаба** или эволокумаба** [104, 105].
ЕОК/ЕОА IIaC (УУР А, УДД 2)
Комментарий: если на фоне терапии статинами в максимально переносимых дозах уровень ХС ЛНП остается значительно повышенным (> 2,5 ммоль/л), можно рассмотреть блокаторы PCSK9 без предварительного применения эзетимиба.
5.5 ДЛП у пожилых
У пожилых лиц с АССЗ рекомендована терапия статином так же, как и у более молодых пациентов [106].
ЕОК/ЕОА IА (УУР А, УДД 1)
У пожилых лиц при наличии высокого и очень высокого риска для первичной профилактики рекомендована терапия статином [106].
ЕОК/ЕОА IА (УУР А, УДД 1)
Пациентам старше 75 лет при наличии высокого и очень высокого риска для первичной профилактики рекомендована терапия статином [106].
ЕОК/ЕОА IIbВ (УУР А, УДД 1)
У пожилых пациентов при наличии потенциального риска лекарственного взаимодействия рекомендуется назначать статин в низкой дозе с последующей титрацией до достижения целевого уровня ХС ЛНП [107, 108, 109]. При необходимости достижения более низкого целевого уровня ХС ЛНП у пациентов очень высокого и экстремального риска рассмотреть возможность комбинированной терапии низкими дозами статина и эзетимибом [50].
ЕОК/ЕОА IС (УУР С, УДД 5)
5.6 ДЛП у женщин, при беременности и лактации
Назначение гиполипидемических средств не рекомендуется при планировании беременности, во время беременности и в период грудного вскармливания. Пациенткам с тяжелой СГХС возможно назначение секвестрантов желчных кислот (не адсорбируемых) и/или применение плазмафереза, плазмосорбции [50].
ЕОК/ЕОА нет (УУР С, УДД 5)
У женщин группы высокого риска вне беременности и вне периода грудного вскармливания рекомендуется назначение статинов для первичной профилактики ИБС [39, 42].
ЕОК/ЕОА нет (УУР С, УДД 1)
Женщинам с целью вторичной профилактики вне беременности и вне периода грудного вскармливания рекомендованы статины по тем же показаниям и с теми же целевыми уровнями ХС ЛНП, что и мужчинам [39, 42].
ЕОК/ЕОА нет (УУР С, УДД 1)
Комментарии: использование современных низкодозированных комбинированных гормональных пероральных контрацептивов у женщин в репродуктивном возрасте не приводит к увеличению риска острых коронарных событий [110]. Их применение возможно у женщин после оценки липидных показателей, при нормальном уровне холестерина. При наличии ГХС (уровень ХС ЛНП выше 4 ммоль/л) и/или множественных факторах сердечно-сосудистого риска и/или высоком риске тромбоэмболических осложнений следует рассмотреть альтернативные гормональные пероральные контрацептивы [111]. Заместительная терапия эстрогенами, несмотря на положительное влияние на показатели липидного профиля, не продемонстрировала возможности снижения сердечно-сосудистого риска и не может быть рекомендована для сердечно-сосудистой профилактики у женщин [112].
Прием липидснижающих препаратов при подготовке к беременности, во время беременности и лактации запрещен. У пациенток с тяжелой СГХС во время беременности/лактации следует использовать плазмаферез, плазмосорбцию.
Женщины репродуктивного возраста:
— во время лечения должны пользоваться адекватными методами контрацепции;
— женщины с СГХС должны получить консультацию перед беременностью и инструкции по отмене гиполипидемических средств не позднее, чем за 4 недели до прекращения предохранения от беременности и не должны принимать эти препараты до окончания грудного вскармливания;
— в случае незапланированной беременности женщина с СГХС должна незамедлительно прекратить прием любых гиполипидемических средств и срочно проконсультироваться со своим лечащим врачом;
— в связи с результатами нескольких пилотных клинических исследований о негативном влиянии статинов на фертильную функцию у мужчин можно рекомендовать пациенту с СГХС воздержаться от приема статинов на период планируемого зачатия.
5.7 ДЛП и цереброваскулярная болезнь
Пациентам с перенесенным ишемическим инсультом рекомендована интенсивная липидснижающая терапия для достижения целевого уровня ХС ЛНП менее 1,4 ммоль/л [38, 50, 113, 114, 203, 204, 205].
ЕОК/ЕОА IA (УУР В, УДД 1)
Комментарий: дополнительные преимущества от снижения уровня ХС ЛНП ниже 1,8 ммоль/л были продемонстрированы в исследовании TST (Treat Stroke to Target): у пациентов с ранее перенесенным ИИ выбор такой тактики лечения позволял уменьшать риск развития повторных сердечно-сосудистых событий событий на 22%. Результаты исследования IMPOVE-IT и двух метаанализов показали дополнительное снижение риска развития СС событий при снижении уровня ХС ЛНП
Рекомендуется большинству пациентам с ИИ или ТИА назначение высокоинтенсивной терапии статинами в максимально переносимых дозах для достижения целевого уровня ХС ЛНП [76, 204, 207].
ЕОК/ЕОА I A (УУР В, УДД 1)
Комментарий: под высокоинтенсивной терапией статинами подразумевается назначение аторвастатина** в дозах 40–80 мг/сут или розувастатина в дозах 20–40 мг/сут. При повышении уровня ТГ выше целевого значения (2,3 ммоль/л) назначение статинов также является терапией первой линии.
Рекомендуется пациентам старше 75 лет, перенесшим ИИ или ТИА, начинать умеренно-интенсивную терапию статинами [207, 208, 209].
ЕОК/ЕОА I A (УУР А, УДД 1)
Комментарий: под умеренно интенсивной терапией статинами подразумевают назначение аторвастатина** 10–20 мг/сут, розувастатина 5–10 мг/сут, питавастатина 4 мг.
Рекомендуется пациентам старше 75 лет с ИИ или ТИА, ранее получавшим высокоинтенсивную терапию статинами, продолжить ее, не изменяя режим интенсивности [210, 211].
ЕОК/ЕОА нет (УУР С, УДД 4)
Рекомендуется пациентам с ИИ или ТИА, не достигшим целевых значений ХС ЛНП на фоне терапии максимально переносимыми дозами статинами в течение 4-12 недель, добавление к терапии эзетимиба [203, 212].
ЕОК/ЕОА 1 А (УУР В, УДД 4)
Рекомендуется пациентам с ИИ или ТИА и непереносимостью статинаов назначение эзетимиба с целью достижения целевого значения ХС ЛНП [72, 73].
ЕОК/ЕОА I B (УУР С, УДД 5)
Комментарий: под непереносимостью статинов понимается развитие побочных эффектов после отмены и повторного рестарта терапии, в том числе с назначением другого статина и/или в сниженной дозе.
Рекомендуется пациентам с ИИ или ТИА добавление к проводимой терапии статинами и эзетимибом алирокумаба**, инклисирана** или эволокумаба**, с целью достижения целевого значения ХС ЛНП [40, 206, 250-252].
ЕОК/ЕОА 1 А (УУР A, УДД 1)
Рекомендуется пациентам с ИИ и ТИА оценка эффективности проводимой гиполипидемической терапии, ее безопасности и приверженности пациента к проводимому лечению (включая изменение образа жизни) [213, 214].
ЕОК/ЕОА нет (УУР С, УДД 4)
Комментарий: целесообразно проводить оценку лабораторных параметров (измерение уровня липидов натощак, АЛТ, АСТ) спустя 4–12 недель после начала приема статинов или увеличения их дозы. После достижения целевого уровня ХС ЛНП и ТГ (целевое значение для ТГ — менее 2,3 ммоль/л) рекомендован ежегодный лабораторный контроль (при отсутствии проблем с приверженностью пациента или других конкретных причин более частого мониторинга). Рутинный контроль печеночных ферментов во время лечения статинами не рекомендуется, за исключением наличия симптомов, свидетельствующих о патологии печени.
5.8 ДЛП и клапанные пороки сердца
Пациентам с аортальным стенозом без сопутствующей ИБС не рекомендовано начинать гиполипидемическую терапию с целью замедления прогрессирования аортального стеноза в отсутствие других показаний к такому лечению [115, 116, 117, 118].
Дислипидемия — симптомы и лечение
Что такое дислипидемия? Причины возникновения, диагностику и методы лечения разберем в статье доктора Чернышева Андрея Владимировича, кардиолога со стажем в 34 года.
Над статьей доктора Чернышева Андрея Владимировича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Дислипидемия (ДЛ) — патологический синдром, связанный с нарушением обмена липидов и липопротеидов, т.е. изменением соотношения их концентрации в крови. [1] Он является одним из главных факторов риска атеросклероз зависимых заболеваний.
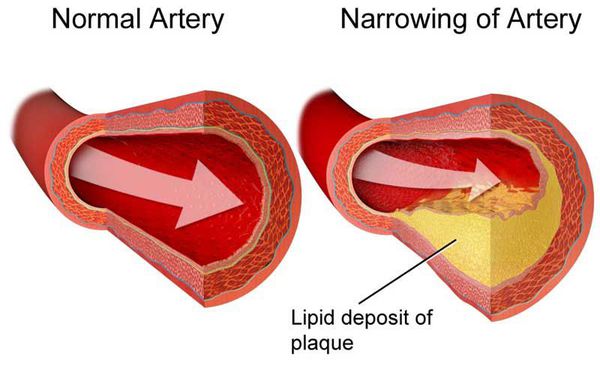
Липиды и липопротеиды — одни из источников энергии, необходимой организму человека. Они представляют собой жироподобные органические соединения. Липиды входят в состав липопротеидов.
Причины, приводящие к развитию дислипидемии, можно разделить на неизменяемые (эндогенные) и изменяемые (экзогенные).
К первым относится возраст, пол, гормональный фон и наследственная предрасположенность.
Группа изменяемых факторов риска ДЛ более многочисленна. К основным причинам относятся:
- нерациональное питание (избыточное потребление калорий, насыщенных жиров, простых углеводов);
- курение табака;
- избыточный вес (висцеральное ожирение);
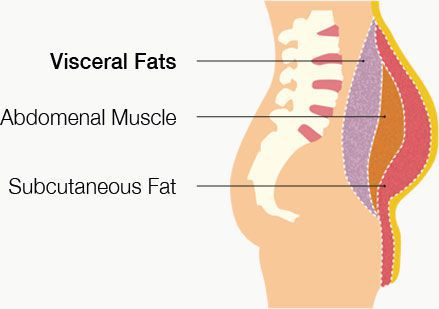
- сахарный диабет;
- злоупотребление алкоголем;
- повышенное артериальное давление;
- длительный стресс;
- малоподвижный образ жизни;
- систематическое физическое перенапряжение;
- хроническое субклиническое воспаление.
Также причинами ДЛ могут быть различные заболевания, патологические синдромы и приём некоторых медикаментов.
От внешних факторов больше зависит содержание в крови таких жировых субстанций, как хиломикроны и триглицериды. До 80% холестерина липопротеинов низкой плотности синтезируется в организме, главным образом, в печени и в меньшей степени зависит от внешних факторов. Семейно-генетический формы ДЛ полностью зависят от наследственных факторов. [1] [9]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы дислипидемии
Так как ДЛ является лабораторным синдромом, то её проявления связаны с атеросклерозом артерий тех органов и тканей, которые они кровоснабжают:
- ишемия головного мозга;
- ишемическая болезнь сердца;
- облитерирующий атеросклероз артерий нижних конечностей и т. д.
Ишемическая болезнь сердца – наиболее распространённое и грозное атеросклероз зависимое заболевание. От него погибает больше людей, чем от всех видов рака. Чаще всего это заболевание проявляется в виде стенокардии или инфаркта миокарда.
Стенокардию раньше называли «грудной жабой», что точно характеризует симптомы заболевания — давящие или сжимающие ощущения за грудиной на высоте физической или эмоциональной нагрузки, продолжающиеся несколько минут и прекращающиеся после прерывания нагрузки или приёма нитроглицерина.
Инфаркт миокарда связан с разрывом атеросклеротической бляшки в сердечной артерии и формированием тромба на бляшке. Это приводит к быстрому перекрытию артерии, острой ишемии, повреждению и некрозу миокарда.
От хронической и острой ишемии может страдать головной мозг, что проявляется головокружением, потерей сознания, выпадением речевой и двигательной функции. Это не что иное, как мозговой инсульт или прединсультное состояние — транзиторная ишемическая атака. При облитерирующем атеросклерозе нижних конечностей происходит снижение кровоснабжение ног. Стоит отметить, что долгое время атеросклероз остаётся бессимптомным, клинические проявления начинаются при сужении артерии на 60-75%.
Семейно-генетические дислипидемии могут проявляться стигматами, такими как ксантомы кожи и ксантелазмы век.
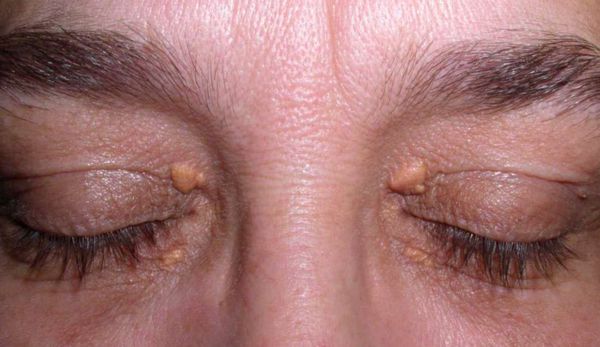
Значительное повышение концентрации триглицеридов крови (более 8 ммоль/л) может приводить к острому панкреатиту, который сопровождается сильной болью в верхнем отделе живота, тошнотой, рвотой, учащённым сердцебиением и общей слабостью.
Патогенез дислипидемии
Основными липидами плазмы крови являются:
- холестерин (ХС) — предшественник желчных кислот, половых гормонов и витамина Д;
- фосфолипиды (ФЛ) — основные структурные компоненты всех клеточных мембран и внешнего слоя липопротеиновых частиц;
- триглицериды (ТГ) — липиды, образующиеся из жирных кислот и глицерина, которые поступают в организм с пищей, затем транспортируются в жировые депо или включаются в состав липопротеинов.
Жирные кислоты (ЖК) плазмы крови — источник энергии и структурный элемент ТГ и ФЛ. Они бывают насыщенными и ненасыщенными. Насыщенные ЖК входят в состав животных жиров. НенасыщенныеЖК составляют растительные жиры и делятся на моно- и полиненасыщенные жирные кислоты. Мононенасыщенные ЖК в большом количестве содержаться в оливковом масле, а полиненасыщенные — в рыбьем жире и других растительных маслах. Считается, что все эти жиры необходимы человеку, их сбалансированное количество должно составлять до 30% суточного каллоража пищи и распределяться примерно на три равные части между моно-, полиненасыщенными и насыщенными ЖК.
Источник https://diseases.medelement.com/disease/4042
Источник https://diseases.medelement.com/disease/%D0%BD%D0%B0%D1%80%D1%83%D1%88%D0%B5%D0%BD%D0%B8%D1%8F-%D0%BB%D0%B8%D0%BF%D0%B8%D0%B4%D0%BD%D0%BE%D0%B3%D0%BE-%D0%BE%D0%B1%D0%BC%D0%B5%D0%BD%D0%B0-%D0%BA%D0%BF-%D1%80%D1%84-2023/17560
Источник https://probolezny.ru/dislipidemiya/