Бесплодие женское и мужское — методы лечения и диагностики
Согласно определению ВОЗ (1993), бесплодным считается брак, в котором, несмотря на регулярную половую жизнь в течение года без применения каких-либо контрацептивных средств, беременность не наступает, при условии, что супруги находятся в детородном возрасте.
Содержание статьи
Cогласно данным эпидемиологических исследований, частота бесплодных пар среди супругов детородного возраста колеблется от 8 до 15%. Различают также первичное и вторичное бесплодие, женское и мужское бесплодие.
Основными причинами женского бесплодия являются:
- трубно-перитонеальный фактор (40-50%);
- эндокринное бесплодие (20-30%);
- эндометриоз (20-30%);
- мужское бесплодие (30-40%);
- иммунологическое бесплодие (3-15%).
Сочетанная форма бесплодия — сочетание мужского и женского бесплодия, встречается до 25% случаев.
Это единый комплекс клинических исследований и анализов, цель которых заключается в выявлении причин бесплодия. Диагностика бесплодия — обязательна для обоих супругов. Это позволяет не только оперативно и точно выявлять истинные причины бесплодия, но и назначать правильное и эффективное лечение. Ведь окончательные выводы относительно нарушений репродуктивных функций мужчины и женщины можно сделать только после всего комплекса диагностических процедур.
Эндокринное бесплодие — это бесплодие, характеризующееся нарушением процесса овуляции. Ановуляция — одна из наиболее частых причин бесплодия. Хроническая ановуляция — гетерогенная группа патологических состояний, характеризующихся нарушением циклических процессов в гипоталамо-гипофизарно-яичниковой системе. Многообразие клинических, биохимических, морфологических нарушений характерно для эндокринного бесплодия.
Клинический спектр эндокринного бесплодия представлен дисфункциональными маточными кровотечениями, олигоменореей, аменореей, при наличии или отсутствии галактореи, гирсутизма, а в ряде случаев — вирилизации. Содержание в крови андрогенов и лютеинизирующий гормон (ЛГ) при ановуляции может быть как нормальным, так и достигать высоких цифр. Размеры яичников также варьируют в широких пределах — от нормальных до увеличенных в несколько раз. Регулярный менструальный цикл наблюдается у 33,2%, нерегулярный — у 23,6 %, аменорея — у 43,2 % из них.
Типичными синдромами, объединяющими такие симптомы как бесплодие, аменорея, олигоменорея и ановуляторные циклы, являются «синдром поликистозных яичников», постпубертатная форма адреногенитального синдрома, различные формы гиперпролактинемии, гиперандрогении, послеродовой нейроэндокринный синдром и другие синдромы. Частота эндокринного бесплодия колеблется от 4 до 40%. Использование современных методов исследования позволяет снизить частоту необъяснимого бесплодия от 7,6 до 4,8%. Недостаточность лютеиновой фазы (НЛФ). Понятие о НЛФ менструального цикла четко не определено, хотя существует довольно давно. НЛФ — это нарушение функции яичников, характеризующееся гипофункцией желтого тела яичника.
Недостаточный синтез прогестерона ведет к недостаточной секреторной трансформации эндометрия, изменению функции маточных труб, нарушению имплантации оплодотворенной яйцеклетки, что клинически проявляется бесплодием либо спонтанным выкидышем в I триместре беременности.
Причины НЛФ менструального цикла:
- Дисфункция гипоталамо-гипофизарной системы, возникшая после физического и психического стресса, травм, нейроинфекции и др. Установлено, что при недостаточности лютеиновой фазы менструального цикла уровень ФСГ ниже, чем у здоровых женщин.
- Гиперандрогения яичникового, надпочечникового или смешанного генеза.
- Функциональная гиперпролактинемия. Недостаточность лютеиновой фазы менструального цикла может развиваться в результате влияния высоких концентраций пролактина на секрецию и освобождение гонадотропных гормонов, а также ингибировать стероидогенез в яичниках. Нередко у женщин с недостаточностью лютеиновой фазы менструального цикла гиперпролактинемия сочетается с гиперадрогенемией.
- Затяжной воспалительный процесс в придатках матки.
- Патология желтого тела, обусловленная биохимическими изменениями в перитонеальной жидкости (повышенное содержание простагландинов и их метаболитов, макрофагов, пероксидазы и др.).
- Гипо- или гипертиреоз.
Диагностика НЛФ (бесплодия)
Диагностика НЛФ основывается на клинических проявлениях и дополнительных методах исследования. Основным симптомом НЛФ может быть бесплодие или скудные кровянистые выделения за 4-5 дней до начала менструации.
При диагностике НЛФ применяют следующие методы:
- Традиционным методом является измерение базальной температуры. При нормальной функции желтого тела продолжительность лютеиновой фазы составляет 11-14 дней независимо от продолжительности менструального цикла. НЛФ характеризуется укорочением второй фазы цикла, и разница температуры в обе фазы цикла составляет менее 0,6 градусов. Этот тест не всегда объективен для суждения об НЛФ, так как при определении уровня прогестерона в плазме крови и биопсии эндометрия может быть явное несоответствие уровня прогестерона и выраженности секреторных изменений в эндометрии.
- Оценка уровня прогестерона в крови, определение экскреции прегнандиола с мочой. Идеальным является определение его уровня в течение второй фазы менструального цикла 3-5 раз. Уровень прогестерона в плазме крови 9-80 нмоль/л и прегнандиола в моче более 3 мг/сут является показателем удовлетворительной функции желтого тела.
- При биопсии эндометрия, проводимой за 2-3 дня до начала менструации, выявляется недостаточность секреторной трансформации эндометрия. Она обнаруживается у половины женщин с бесплодием и типичной двухфазной базальной температурой и примерно у 70 % женщин с атипичной двухфазной кривой базальной температуры. Нормальный уровень прогестерона крови во вторую фазу цикла не является гарантией полноценной фазы секреции, так как может отмечаться нарушение рецепции на уровне эндометрия, поэтому при бесплодии показана биопсия эндометрия.
- УЗ-сканирование роста фолликулов и толщины эндометрия в динамике менструального цикла позволяет предположить НЛФ.
- Лапароскопия, произведенная после овуляции, позволяет наблюдать стигму на месте овулировавшего фолликула, хотя наличие овуляции еще не означает полноценную функцию желтого тела.
Лечение НЛФ менструального цикла
Можно начинать по типу заместительной терапии, а именно — назначать раствор прогестерона во вторую фазу цикла за 10 дней до начала менструации. Беременность при этом отмечена более чем у 50% женщин. Установлено, что норстероиды (норколут, преламут и др.) обладают лютеолитическим эффектом. Хориальный гонадотропин (ХГ) предпочтительно вводить на 2-4-6-й день повышения базальной температуры. Более раннее и позднее введение нецелесообразно: раннее введение может способствовать лютеинизации неовулирующего фолликула, позднее — оказать лютеолитическое действие. Введение ХГ можно сочетать с назначением кломифена либо пергонала, но под контролем уровня эстрадиола крови или УЗ-сканирования.
Комбинированные эстроген-гестагенные препараты назначают в целях reboud-эффекта в течение 2-3 курсов. Кломифен по обычной схеме: с 5-го по 9-й день цикла по 50 мг, при недостаточном эффекте дозу можно увеличить до 100-150 мг/сут. Кломифен с 5-го по 9-й день цикла, ХГ по 2000-3000 ME 184 2-4-6-й день повышения базальной температуры. Пергонал в сочетании с ХГ. При гиперпролактинемии рекомендуется лечение парлоделом по 2,5-7,5 мг/сут. в течение 4-6 циклов. При гиперандрогении назначают дексаметазон — по 0,25-0,5 мг/сут., дексаметазон с кломифеном. При НЛФ, обусловленной латентной гиперпролактинемией и гиперандрогенией, рекомендуется лечение дексаметазоном — по 0,75 мг/сут. в течение 10 дней, затем по 0,5 мг/сут., и парлоделом по 2,5 мг/сут. Имеются сообщения о благотворном влиянии терапии НЛФ люлиберином.
Имеются сообщения о лечении НЛФ с помощью блокаторов простагландинов (индометацин, напроссин). В заключение следует отметить, что НЛФ — это мультифакториальное патологическое состояние, ведущее к бесплодию. Поэтому и лечение его довольно сложно, эффективность лечения повышается при выяснении причины НЛФ и проведении патогенетической терапии. Профилактика заключается в предупреждении тех патологических состояний, которые способствуют развитию НЛФ.
ЛНФ-синдром — cиндром лютеинизации неовулировавшего фолликула
ЛНФ-синдром — это преждевременная лютеинизация предовуляторного фолликула без овуляции, характеризующаяся циклическими изменениями секреции прогестерона и несколько запоздалой секреторной трансформацией эндометрия. Основным клиническим симптомом ЛНФ-синдрома является бесплодие.
Причина ЛНФ-синдрома не установлена. Существует точка зрения, что ЛНФ-синдром может быть случайным явлением и встречается не в каждом цикле и что в его возникновении могут играть роль стресс и гиперпролактинемия. Немаловажную роль в развитии ЛНФ-синдрома играют обменные нарушения в самом яичнике, характеризующиеся нарушением синтеза гормонов, ингибинов, статинов, кининов и пр.
Диагноз ЛНФ-синдрома. Наиболее информативными являются ультразвуковая эхография в течение менструального цикла и лапароскопия, производимая во вторую фазу цикла. Лапароскопия: лютеинизированный неовулировавший фолликул характеризуется наличием геморрагического тела без овуляционной стигмы.
Лечение ЛНФ-синдрома. Специального лечения ЛНФ-синдрома не существует, так как этиология и патогенез не установлены. Беременность у больных с ЛНФ наступает одинаково часто на фоне лечения кломифеном и без него.
Лечение ановуляции
В настоящее время существует пять основных методов лечения ановуляции:
- стимуляция овуляции при гиперпролактинемии достигается назначением парлодела (по 1,25-2,5 мг/сут.); после нормализации уровня пролактина назначают кломифен, ХГ, пергонал;
- при дисфункции гипоталамо-гипофизарной системы с ановуляцией, низким уровнем ЛГ, положительным гестагеновым тестом применяют кломифен, ХГ, пергонал;
- при выпадении отдельных функций гипоталамо-гипофизарной системы с низким уровнем эстрогенов, отрицательным гестагеновым тестом проводят терапию ХГ, пергоналом; лишь при реактивности гипофиза предпринимают попытку использования релизинг гормон (РГ), ЛГ;
- при гиперандрогенемии надпочечникового генеза требуется назначение кортикостероидов в сочетании с кломифеном, ХГ или пергоналом;
- при яичниковой гиперандрогенемии с высоким уровнем экскреции эстрогенов, ЛГ и поликистозом яичников используют гестагены в сочетании с кломифеном или с пергоналом и ХГ, а также РГ, ЛГ и его агонисты,позволяющие стимулировать созревание фолликулов в яичниках.
Кломифен и беременность
Анализ результатов терапии эндокринного бесплодия показывает, что частота наступления беременностей после стимуляции овуляции кломифеном (клостильбегитом) варьирует в широких пределах — 30-40 % наблюдений. Овуляция возникает значительно чаще (70-90%), чем беременность. Это свидетельствует о неблагоприятном влиянии препарата на репродуктивную систему, выражающемся в снижении способности транспортировать или удерживать яйцеклетку, сперматозоиды или эмбрион на ранних стадиях развития. Потенциально антиэстрогенный эффект кломифена может проявляться на уровне шейки матки (снижение секреции шеечной слизи) и на уровне эндометрия, что затрудняет имплантацию плодного яйца. Стимуляция овуляции с помощью кломифена может приводить и к недостаточности лютеиновой фазы менструального цикла.
Прерывание беременности после стимуляции овуляции кломифеном наступает у 24-38,7% женщин. Многоплодная беременность наступает в 8-13 % наблюдений. Поздний токсикоз беременных наблюдается у 21,9% женщин, несвоевременное излитие околоплодных вод — у 36,6 %, аномалии родовой деятельности — у 24,6 %, гипоксия плода — у 22,6 %. Следовательно, и частота оперативных вмешательств довольно высокая — 24,6 % . При комбинированном применении кломифена и гонадотропинов частота наступления беременности увеличивается до 30-70 %, а частота самопроизвольных выкидышей снижается до 14% . Комбинированное применение кломифена с дексаметазоном при гиперандрогении способствует наступлению беременности у 40-60% женщин.
Нарушение функции маточных труб
К нарушению функции маточных труб приводят многочисленные причины: хронический психологический стресс по поводу бесплодия, нарушение синтеза половых гормонов и особенно их соотношения, простагландинов, нарушение глюкокортикоидной функции коры надпочечников и симпатико-адреналиновой системы, увеличение метаболитов простациклина и тромбоксана.
Выраженные нарушения сократительной активности маточных труб отмечаются на фоне гиперандрогении, причем при субклинической форме надпочечниковой гиперандрогении они выражены больше, чем при смешанной яичниково-надпочечниковой гиперандрогении. Доказательством этому является тот факт, что у 54 % женщин трубная беременность наступает на фоне различных гормональных дисфункций, причем у 40 % из них установлена надпочечниковая гиперандрогения. Безусловно, воспалительные процессы в маточных трубах и в области малого таза отражаются на функциональной активности маточных труб.
Непроходимость маточных труб
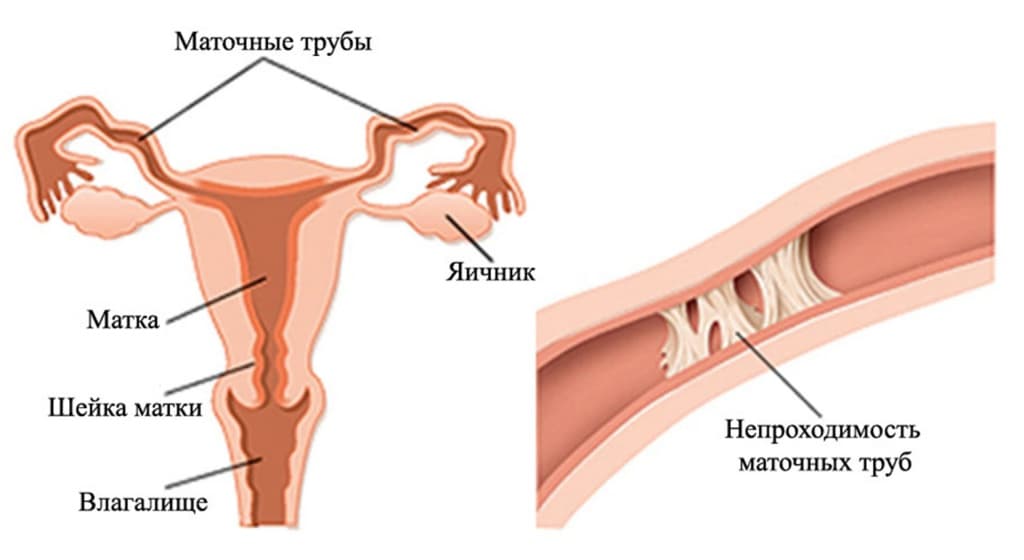
Органические поражения маточных труб сопровождаются их непроходимостью. Причинами непроходимости маточных труб могут быть: воспалительные заболевания половых органов, пельвио- или общий перитонит, аппендицит с последующей аппендэктомией; оперативные вмешательства на внутренних половых органах (миомэктомия, резекция яичников, перевязка маточных труб и др.); послеродовые осложнения — воспалительные и травматические; полипы, эндометриоз маточных труб и другие формы наружного эндометриоза; аппендэктомия.
Диагностика трубного бесплодия
Прежде всего, в диагностике трубного бесплодия имеет значение анамнез: указания на хронические воспалительные заболевания половых и других органов и систем (хронический тонзиллит, колит, пиелонефрит, аппендицит), особенности течения послеабортных, послеродовых, послеоперационных периодов; наличие «синдрома тазовых болей», боли при половом сношении, альгодисменорея; частота половых сношений, смена партнеров, воспалительные заболевания у партнеров, характер болей.
Среди методов специального исследования в диагностике трубного бесплодия применяют бактериологическое, кольпоскопию, гистеросальпингографию, рентгенокимографию, кимографическую пертубацию, радио-изотопное сканирование, лапароскопию, микробиопсию маточных труб и др.
Гистеросальпингография (ГСГ) является одним из основных методов диагностики при подозрении на непроходимость маточных труб; ГСГ может дать относительную информацию и о спаечном процессе в малом тазу. Предпочтение отдают проведению ГСГ водными растворами и в первую фазу цикла. Во вторую фазу менструального цикла иногда выраженные секреторные изменения в эндометрии могут явиться препятствием для прохождения контрастного вещества. Временная блокада прохождения контрастного вещества в интерстициальной части маточной трубы может быть вызвана слизистой пробкой, сгустком фибрина, аллергическим отеком слизистой оболочки.
Наиболее информативным методом в диагностике трубного бесплодия является лапароскопия, которую проводят при сомнительных данных ГСГ, а также при бесплодии неясного генеза. Лапароскопию выполняют через 1-3 мес. после ГСГ и через 6 мес. при нормальных данных ГСГ.
В диагностике перитонеальной формы бесплодия важную роль играют данные анамнеза, указания на перенесенные воспалительные заболевания, оперативные вмешательства на органах малого таза и брюшной полости. Особого внимания заслуживают частые инвазивные процедуры: ГСГ, гидротубации, кимопертубации, диагностические выскабливания. Признаки спаечного процесса (ограничение подвижности и изменение положения матки, укорочение сводов влагалища, тяжистость в области придатков матки) позволяют заподозрить перитонеальную форму бесплодия.
S. Hulka (1978) разработал классификацию, основанную на степени вовлечения в спаечный процесс придатков. При I и II степени распространения спаечного процесса обнаруживают пленчатые, легко разрываемые сращения вокруг маточных труб и яичников. При III и IV степени распространения спаечного процесса в малом тазу спайки чаще бывают плотными, они снабжены сосудами, трудно поддаются разделению; в патологический процесс вовлечены матка, кишечник, сальник. Таким образом, диагностическая ценность двуручного гинекологического исследования, кимографической пертубации, ГСГ высока лишь при выраженных спаечных процессах в малом тазу. Для диагностики менее выраженных процессов необходима лапароскопия.
Лечение трубного бесплодия
Лечение функционального трубного бесплодия (без анатомических изменений) предполагает использование психотерапии, аутосуггестии, седативных средств, транквилизаторов, спазмолитических препаратов, блокаторов простагландинов (напроссин, индометацин) в предовуляторные дни цикла, коррекцию гормональных нарушений. Широкое применение при лечении трубного бесплодия нашла бальнеотерапия — сероводородные ванны и преформированные физические факторы — ультразвук в импульсном режиме, электростимуляция маточных труб.
Лечение трубного бесплодия при органических поражениях маточных труб довольно сложное. Применяют как консервативное, так и оперативное лечение. Консервативная терапия, применяемая при лечении хронического воспаления придатков матки, недостаточно эффективна. При длительном консервативном лечении трубного бесплодия развиваются грубые анатомо-функциональные нарушения в трубах: дистрофические изменения, срастание складок слизистой оболочки, развитие соединительной ткани в слизистом и мышечном слое; нарушается рецепторный аппарат, чувствительность которого к гормонам и без того снижена вследствие хронического воспаления, что обусловливает нарушение процесса стероидогенеза.
При отсутствии эффекта от комплексной консервативной терапии трубного бесплодия в течение 1,5-2 лет показано применение хирургических, в частности, микрохирургических методов лечения.
Успех микрохирургических пластических операций при лечении трубного бесплодия во многом зависит от правильного послеоперационного ведения больных, которое должно включать рассасывающую терапию — электрофорез цинка и меди, магнитотерапию, ультразвук, ферментные препараты, прямую электростимуляцию маточных труб после сальпингостомии, а также ранние гидротубации без гидрокортизона. После операции рекомендуется контрацепция в течение 3-4 мес. В случае необходимости проводят гормональную коррекцию, а также терапию, направленную на восстановление сократительной активности маточных труб.
В последние годы, благодаря внедрению в гинекологию микрохирургии, частота наступления беременности после пластических операций на маточных трубах возросла до 30-60%. Некоторые авторы рекомендуют после таких операций проводить раннюю лапароскопию (через 6-30 дней) с целью лизиса послеоперационных спаек.
Довольно перспективной при лечении трубного бесплодия является оперативная лапароскопия, при которой возможно выполнение сальпингоовариолизиса, коагуляции эндометриоидных гетеротопий и других вмешательств.
Перитонеальная форма бесплодия
При лечении перитонеальной формы бесплодия оптимальной является противовоспалительная терапия (продигиозан, антибактериальные препараты, физические факторы). При наличии операционного лапароскопа во время исследования производят разделение и коагуляцию спаек. Применение эндоскопической хирургии способствовало наступлению беремененности у 31 % женщин, страдающих перитонеальной формой бесплодия.
При трубном бесплодии, обусловленном органическими изменениями, следует шире и на ранних стадиях использовать экстракорпоральное оплодотворение и перенос эмбриона в матку.
Профилактика трубного бесплодия предусматривает профилактику и своевременное лечение воспалительных заболеваний половых органов супругов, рациональное ведение родов и послеродового периода, своевременную диагностику и лечение аппендицита. Профилактика перитонеальной формы бесплодия включает предупреждение и лечение воспалительных заболеваний органов малого таза, рациональное ведение послеоперационного периода и раннюю реабилитацию после оперативных вмешательств на органах малого таза и брюшной полости, ограничение числа гидротубации и широкое использование водорастворимых веществ для производства ГСГ.
Аменорея маточная
Причинами маточной формы аменореи могут быть повторные диагностические выскабливания слизистой оболочки матки; послеродовые и послеоперационные осложнения; воздействие химических прижигающих веществ; эндометриты различной этиологии.
Диагностика маточной формы аменореи основывается на следующих факторах:
субъективные ощущения циклических изменений в организме при сохраненной функции яичников;
обследование по тестам функциональной диагностики и определение уровней Е2 и прогестерона указывает на сохранение функции яичников;
гормональные пробы с прогестероном, комбинированными эстроген-гестагенными препаратами в циклическом режиме отрицательные;
при гистерографии и УЗИ слизистая оболочка матки истончена или имеются внутриматочные синехии;
гистероскопия позволяет уточнить расположение и характер синехий.
Лечение маточной формы аменореи
Заключается в разрушении синехий под контролем гистероскопии сразу же после окончания очередной менструации с назначением циклической гормонотерапии на 2-3 менструальных цикла. После отмены гормонотерапии проводится контрольная ГСГ. В последние годы мы отказались от введения ВМС, которые сами по себе могут поддерживать вялотекущий эндометрит и способствовать образованию синехий. Прогноз при маточной форме аменореи довольно сложный и зависит от степени и глубины поражения базального слоя эндометрия.
Цервикальная форма бесплодия
Играет важную роль в транспорте сперматозоидов. Цервикальная слизь шейки матки представляет собой вязкоэластичный полужидкий гель, состоящий из матрицы нерастворимого гликопротеина (муцина) и воды, содержащей растворимые компоненты. Под влиянием стероидов матрица слизи подвергается структурным изменениям, вызывающим в свою очередь, изменения ее реологических свойств. Цервикальная слизь предотвращает проникновение в матку микроорганизмов и жидкостей; сперматозоиды могут мигрировать через слизь в полость матки, в основном, только в середине менструального цикла. В другие периоды цикла реологические свойства слизи таковы, что миграция сперматозоидов затруднена или невозможна. Предполагают, что структурная особенность гликопротеинов слизи определяет возможность миграции сперматозоидов или ее подавление.
В день овуляции средний диаметр межструктурных каналов в норме составляет 3,21 мкм, при бесплодии — 1,4 мкм; средний диаметр головки сперматозоида 2,5-3 мкм. Размер межструктурных каналов зависит от толщины нитей, которая при бесплодии значительно увеличена. Возможно, это связано с увеличением концентрации в слизи белка плазмы крови, обладающего адгезивными свойствами. При цервикальной форме бесплодия нарушена и геометрия слизи: чаще встречается перекрест нитей слизи. Выявленные изменения объясняют степень гидратации, так как содержание воды увеличивается в фазу овуляции до 98 % по сравнению с 92-94 % в другие фазы менструального цикла. Следовательно, изменение структуры слизи может быть причиной развития цервикального фактора бесплодия. Причины цервикальной формы бесплодия в шеечной слизи: воспалительные изменения; гормональные нарушения, особенно выраженная гипоэстрогения; наличие антител к сперматозоидам; анатомические изменения шейки матки (врожденные или приобретенные — после абортов, родов, операций).
Лечение цервикальной формы бесплодия:
нормализация функций яичников;
барьерная терапия при наличии антител к сперматозоидам предполагает использование презерватива в течение 6 мес. либо применяется внутриматочная инсеминация;
при анатомических изменениях показаны реконструктивно-пластические операции.
Иммуннитет и бесплодие
Бесплодие, обусловленное иммунологическими факторами, относится к числу наименее изученных, частота его составляет около 2%. Это бесплодие обусловлено образованием антиспермальных антител, которые возникают как у мужчин, так и у женщин, причем у последних значительно реже. Известно примерно 40 антигенов эякулята мужчин, к которым образуются антитела. Основными реакциями антиспермального иммунитета являются образование тканевых гуморальных антител и фагоцитоз сперматозоидов. Чаще всего и наиболее активно происходит образование антител в шейке матки, реже — в эндометрии и трубах. Шейка матки является основным звеном так называемого локального иммунитета. В ней образуются иммуноглобулины IgA, кроме того, иммуноглобулины классов IgA, IgJ, IgM абсорбируются из плазмы. Установлено, что концентрация иммуноглобулинов в шейке матки меняется в течение менструального цикла, уменьшаясь в период овуляции. Антитела к антиспермальным антигенам обладают преципитирующими, агглютинирующими, иммуномобилизующими свойствами.
Диагностика иммунного фактора бесплодия основана на результатах посткоитального теста. Наиболее часто для лечения иммунного фактора бесплодия используется внутриматочное осеменение — эффективность метода до 40 %. Применяют механический метод контрацепции в течение не менее 6 мес, исключающий контакт с половыми органами женщины (презерватив). Эффективность до 60 %. Применение глюкокортикоидных препаратов для торможения антителообразования распространения не получило в связи с нежелательными реакциями организма. Эффективность этого вида терапии — до 20 %. Рекомендуется также применение антибиотиков, поскольку скрытопротекающая инфекция способствует образованию антиспермальных антител.
Психогенное бесплодие
У подавляющего большинства женщин с бесплодием выявляются различные нарушения психоэмоциональной сферы: чувство неполноценности, одиночества, истерические состояния в период очередной менструации. Комплекс этих симптомов составляет «симптом ожидания беременности». Нередко беременность наступает в тот момент, когда женщина решает вопрос о прекращении лечения. При изучении психологического статуса у 100 супружеских пар, лечившихся по поводу бесплодия, установили, что у женщин с прервавшейся беременностью отмечена неполная семья в связи с необоснованной критической оценкой супруга, постоянными воспоминаниями о прежних партнерах, высокой производственной загруженностью. У родивших женщин это наблюдалось реже. Показано наблюдение этой группы женщин у невропатолога, психоневролога.
«Синдром гиперстимуляции яичников» (СГЯ)
Комплекс патологических симптомов, возникающих на фоне применения стимуляторов овуляции, характеризующийся значительным увеличением яичников, иногда разрывом их и кровотечением; наличием выпота в брюшной и плевральной полостях, возникновением тромбоэмболии магистральных сосудов, многоплодной беременностью и пр. В последние годы, в связи с широким распространением лечения бесплодия методом экстракорпорального оплодотворения, включающего как первый этап — стимуляцию суперовуляции, синдром гиперстимуляции яичников привлекает все большее внимание.
Классификация синдрома гиперстимуляции яичников:
1. Легкая форма СГЯ:
1-я степень — клиническая симптоматика отсутствует, содержание эстрадиола в плазме более 150 мкг, в моче прегнадиола выше 10 мг;
2-я степень — к этим биохимическим изменениям присоединяется увеличение яичников до 5 см в диаметре.
2. Форма средней тяжести СГЯ:
3-я степень — боли, чувство тяжести внизу живота и изменения, описанные во 2-й степени;
4-я степень — присоединяется тошнота, рвота, понос, размеры яичников — более 5 см в диаметре.
3. Тяжелая форма СГЯ:
5-я степень — к описанным симптомам присоединяется асцит, гидроторакс, яичники более 12 см в диаметре;
6-я степень — состояние крайне тяжелое, помимо асцита и гидроторакса развивается гиперкоагуляция, уменьшается перфузия почек, осложняющаяся олигурией и почечной недостаточностью; яичники резко увеличены, отмечают их разрывы и перекрут.
При анализе СГЯ отмечают, что при стимуляции кломифеном указанный синдром протекает в более легкой форме, применение гонадотропных препаратов в 4 раза чаще приводит к развитию синдрома; установлена также прямая связь между дозой и длительностью применения гонадотропных препаратов. Чаще всего тяжелые формы синдрома гиперстимуляции яичников наблюдают при применении агонистов РГ ЛГ.
Симптомы гиперстимуляции яичников нарастают через 3-8 дней после введения препаратов хорионического гонадотропина — триггера индуцируемой овуляции. Отмечено также, что при наступлении беременности СГЯ протекает тяжелее. Это позволило предположить особую роль хорионического гонадотропина в развитии СГЯ. Как было отмечено выше, клинические проявления легкой формы отсутствуют. При СГЯ средней тяжести требуется госпитализация в связи с болями в животе, слабостью, диспептическими явлениями. При тяжелой форме госпитализация обязательна, поскольку больные требуют интенсивной терапии в связи с наличием одышки, тахикардии, олигурии, падением артериального давления, нередко развитием тромбоэмболии и флеботромбоза. Начиная с легкой формы для СГЯ характерно увеличение размеров яичников. При легкой форме размеры их достигают 5 см в диаметре, при средней тяжести — до 12 см, при тяжелой — превосходят 12 см.
Лечение гиперстимуляции яичников. При легкой форме СГЯ во время лечения необходимо динамическое ультразвуковое наблюдение за размерами яичников, желательно определение эстрадиола плазмы.
При СГЯ средней тяжести помимо наблюдения, назначают глюкокортикоидные, антигистаминные, антипростагландиновые препараты. Рекомендуется активированный уголь. Как правило, симптомы гиперстимуляции яичников проходят через 3-6 недель от начала их проявления, при наступлении беременности могут длиться несколько дольше. Тяжелая форма СГЯ требует интенсивного лечения.
В связи с тем, что в основе патогенеза синдрома гиперстимуляции яичников лежит острый переход жидкой части крови в брюшную, плевральную полости и перикард, тактика лечения должна быть направлена на восстановление и поддержание объема циркулирующей крови. Показано внутривенное капельное введение растворов, способствующих удержанию жидкости в кровяном русле (плазма, протеин, альбумин). Одновременно, для стимуляции диуреза в случаях олиго- или анурии, показано использование низкомолекулярных декстранов, способствующих изменению реологических свойств крови. Из них наиболее показаны реополиглюкин и поливинилпирролидон. В качестве трансфузионных сред, способствующих восстановлению водно-электролитного баланса, целесообразно применение гемодеза, неокомпенсана и других растворов. Для снижения проницаемости капилляров показано применение кортикостероидных, антипростагландиновых и антигистаминных препаратов.
В случае тромбоэмболии или резкого повышения гемокоагуляции целесообразна терапия антикоагулянтами. При прогрессирующем асците рекомендуется аспирация жидкости через задний свод влагалища. Процедура проводится под ультразвуковым контролем, во избежание повреждения увеличенного в размерах яичника.
Консервативную терапию следует проводить под контролем определения электролитов, белка, остаточного азота и мочевины, альдостерона, гематокрита и коагулограммы крови; учета гемодинамических показателей, количества введенной и выделенной жидкости и массы тела.
Показанием к хирургическому лечению являются симптомы внутреннего кровотечения вследствие разрыва яичника. Объем оперативного вмешательства должен быть щадящим — с максимальным сохранением яичниковой ткани.
Прогноз при синдроме гиперстимуляции яичников легкой и средней тяжести — благоприятный. Симптомы заболевания, как правило, исчезают через 3-6 недель от начала их проявления. Тяжелая форма СГЯ угрожает жизни и здоровью женщины.
Для профилактики СГЯ следует проводить тщательный отбор больных, подлежащих стимуляции овуляции, с учетом исходного уровня эстрогенов мочи или крови, а также величины яичников. Дозы гонадотропинов и кломифена должны подбираться индивидуально. Лечение следует начинать с небольших доз, по мере необходимости постепенно повышая их. Крайне важным является тщательное ежедневное наблюдение за общим состоянием больных, размерами яичников в период лечения и в течение 2-3 недель после его отмены. При лечении гонадотропинами желателен ежедневный контроль за уровнем эстрогенов в плазме крови, а также УЗИ, позволяющее следить за величиной яичников и величиной фолликула.
Профилактика гиперстимуляции яичников
Основными мерами профилактики СГЯ являются:
прекращение стимуляции при выраженной тенденции к развитию СГЯ или снижение дозы гонадотропных препаратов;
отмена введения овуляторной дозы хорионического гонадотропина или поддерживающих доз; аспирация максимально возможного числа фолликулов и кист, возникающих в процессе стимуляции;
отмена процедуры транспорта эмбриона, криоконсервация его и перенос в полость матки в очередном менструальном цикле.
У женщин с синдромом поликистозных яичников и получавших в предыдущих циклах препараты хорионического гонадотропина, а также при наступлении беременности риск развития СГЯ значительно выше. Чаще возникает СГЯ у женщин с высоким уровнем эстрадиола крови перед началом стимуляции суперовуляции, а также у женщин, у которых после стимуляции при эхоскопическом контроле в яичниках обнаруживают множество кистозных образований.
Методы диагностики бесплодия у женщин:
1. Клинические: сбор анамнеза, общее медицинское обследование, гинекологическое исследование;
2. Лабораторно – диагностические:
Тесты функциональной диагностики позволяют оценить уровень эстрогенной насыщенности организма женщины (проводится врачом).
Инфекционное обследование методом ПЦР (урогенитальный соскоб) и ИФА (кровь) (хламидии, микоплазма гениталис, микоплазма гоминис, уреаплазма, гонорея, трихомонада, герпес, цитомегаловирус) и бактериологическое исследование вагинального секрета.
Гормональное обследование крайне необходимо для определения функционального состояния репродуктивной системы и выяснения причин бесплодия.
Ультразвуковое исследование является эффективным, безопасным и не инвазивным методом. Диагностическая ценность этого метода высока, он позволяет выявить образования матки, яичников, внутриматочную патологию, патологию эндометрия, динамику фолликулогенеза и овуляцию. Рекомендуется как обязательный метод обследования при бесплодии.
УЗИ щитовидной железы.
Эндоскопические методы. Лапароскопия и гистероскопия являются наиболее информативными методами обследования, при проведении которых возможно не только точно оценить состояние органов малого таза, полости матки и выявить патологические изменения, но и устранить их.
Методы диагностики мужского бесплодия включают:
- спермограмма;
- цитология секрета простаты и семенных пузырьков;
- исследование на хламидиоз, уреаплазмоз, микоплазмоз, цитомегаловирус, вирус простого герпеса;
- бактериологический анализ спермы;
- определение антиспермальных антител;
- УЗИ органов малого таза;
- УЗИ щитовидной железы;
- термография органов мошонки;
- гормональный скрининг;
- медико-генетическое исследование;
- рентгенологические методы (исследование черепа, флебография почек); тестикулярная биопсия.
Лечение бесплодия методом вспомогательных репродуктивных технологий
Вспомогательные репродуктивные технологии (ВРТ) — это методы преодоления бесплодия, при которых отдельные или все этапы зачатия и раннего развития эмбрионов осуществляются вне организма женщины.
ВРТ включают:
- экстракорпоральное оплодотворение,
- инъекция сперматозоида в цитоплазму ооцита, рассечение оболочки эмбриона (хетчинг),
- донорство спермы,
- донорство ооцитов,
- донорство эмбрионов,
- перенос гамет и эмбрионов в маточную трубу,
- суррогатное материнство,
- криоконсервация гамет, эмбрионов, ткани яичника,
- преимплантационная диагностика,
- получение сперматозоидов для ИКСИ,
- искусственная инсеминация.
Оформите заявку на сайте, мы свяжемся с вами в ближайшее время и ответим на все интересующие вопросы.
Лечение мужского бесплодия в Санкт-Петербурге

Лечение бесплодия у мужчин – процесс, направленный на восстановление фертильных функций. Статистически численность мужской инфертильности растет с каждым годом, делая проблему весьма актуальной.
Что такое мужское бесплодие?
Мужское бесплодие – патология, представляющая собой невозможность мужчины зачать ребенка при регулярной половой жизни без использования методов предохранения. В зависимости от причины, вызвавшей это состояние, инфертильность может требовать лечения или устранения факторов, мешающих работе репродуктивной системе.
Причины мужской инфертильности
- Вредные привычки: алкоголь, курение, прием наркотических препаратов или стероидов негативно отражается на качестве спермы мужчины.
- Неправильное питание, недостаток тех или иных питательных веществ, элементов и витаминов могут нарушать процесс образования сперматозоидов.
- Прием препаратов, способных влиять на сперму может оказывать временный побочный эффект в виде бесплодия, но порой последствия медикаментозного лечения могут продолжаться годами после завершения терапии, лишая мужчину возможности стать отцом.
- Перегрев яичек, то есть длительное пребывание этих органов при температуре выше 34 градусов. Такое происходит при частом и длительном посещении бань и саун, работе с ноутбуком, поставленным на колени, ношении тесного синтетического белья.
- Соматические патологии:
- венерические инфекции;
- эндокринные заболевания;
- сердечнососудистые патологии;
- нефрологические болезни;
- импотенция;
- аутоиммунные процессы;
- анатомические аномалии.
Лечение инфертильности

Лечение бесплодия у мужчин в Санкт-Петербурге можно провести в многопрофильном центре «Запад-Восток». В клинике осуществляется лечение, которое соединило в себе новейшие разработки западных ученых и опыт восточных целителей.
Первым делом мужчина проходит вегетативный тест – уникальное исследование, определяющие места расположения патологий на его теле. Это дает понять, что является причиной бесплодия, а, следовательно, дает возможность устранить эту причину. Помимо этого, в лаборатории клинике можно сделать спермограмму и сдать кровь на определение гормональных отклонений.
Непосредственная терапия мужской инфертильности представляет собой метод акупунктуры, то есть воздействие на биологически активные точки при помощи специальных игл. Стимулируя точку, врач фактически стимулирует деятельность органа. То есть, в конкретном случае происходит активная выработка здоровых сперматозоидов, способных оплодотворить яйцеклетку.
При генетических заболеваниях или анатомических аномалиях врачи используют иные методы терапии: от курса гормональных препаратов до хирургического вмешательства.
В том случае, если организм мужчины здоров, для восстановления качества спермы ему необходимо просто создать благоприятные условия для фертильности:
- вести здоровый образ жизни;
- правильно сбалансировано питаться;
- избегать нагревания паховой области и яичек;
- избегать застоя крови в области таза;
- проводить терапию имеющихся заболеваний.
Все процедуры, направленные на лечение мужского бесплодия, проводятся опытными дипломированными андрологами и урологами, имеющими большой опыт медицинской практике, а также рефлексотерапевтами, имеющими большой положительный опыт лечения инфертильности у мужчин.
Стоимость лечения
Цена лечения мужского бесплодия с помощью акупунктуры составляет 2000 рублей за 1 сеанс. Общая стоимость терапии зависит от того, в каком объеме назначены процедуры. В среднем, для достижения результата необходимо от 4 до 10 сеансов рефлексотерапии. Для пациентов регулярно действуют скидки и акции, позволяющие позаботиться о своем здоровье за разумные деньги.
Записаться на прием или узнать информацию о диагностике, лечении и стоимости можно, позвонив по телефонам +7 (812) 309-92-14, +7 (921) 766-65-48, или заполнив специальный бланк виртуальной заявки.
Лечение мужского бесплодия
Мужским бесплодием называют репродуктивную дисфункцию. Патология может быть врожденной или приобретенной. В патогенезе лежит нарушение работы тестикул, отсутствие или малое количество сперматозоидов, неспособность их достичь яйцеклетки из-за обструкции семенных протоков.
Лечение мужского бесплодия в клинике “Радуга”
“Радуга” – современный медицинский центр, расположенный в Санкт-Петербурге, оснащенный новейшим диагностическим и терапевтическим оборудованием. Здесь работают андрологи и урологи высшей категории, которые внимательно относятся к проблемам пациента.
После полноценного обследования грамотный андролог в тандеме с урологом или другими специалистами, назначит эффективную программу лечения. Она состоит из нескольких методик, которые быстро купируют факторы, приведшие к репродуктивной дисфункции, предотвращают развитие осложнений и восстанавливают мужское здоровье.
Уролог-андролог, врач высшей категории

Диагностика
Врачи в первую очередь назначают спермограмму. Анализ показывает:
- Количество эякулянта и сперматозоидов в нем.
- Качество нормальных мужских половых клеток.
- Соотношение сперматозоидов нормального строения с клетками нарушенной структуры.
- Жизнеспособность, скорость и зрелость сперматозоидов.
Если количество эякулянта мало или выявлены некачественные половые клетки, врач ставит предположительный диагноз – гипофункция яичек. Незрелость сперматозоидов указывает на частые половые контакты.
Если в сперме при микроскопии обнаружен повышенный объем лейкоцитов, врачи назначают дополнительные анализы крови и мочи, чтобы исключить воспалительный процесс в уретральном тракте.
Анализ крови на гормоны укажет на функцию половых и других желез. Также важно проверить работу, строение, структуру и другие характеристики половых органов. Для этого назначают УЗИ, рентгенографию, КТ или МРТ.
Внутренние поверхности половых органов проверяют с помощью эндоскопии. Обследованию подлежат и другие внутренние системы, например щитовидная железа, которая контролирует выработку гормонов других эндокринных органов.
Особенности лечения мужского бесплодия
Терапия мужского бесплодия зависит от выявленных причин патологии. Если предпосылками репродуктивной дисфункции стали инфекции половых органов, урологи назначают противовоспалительные препараты и лекарственные средства против воспаления и для восстановления нормального кровотока. Если обнаружены эндокринные нарушения, к лечению подключают эндокринолога.
При выявленной дисфункции тестикул, показан прием гормонов. Также назначают специальную диету и витаминные комплексы.
Могут применяться вспомогательные методики физиотерапии:
- Магнитотерапия.
- УВЧ.
- Лечение ультразвуковыми волнами.
- Электрофорез с медикаментами.
- Рефлексотерапия.
При некоторых проблемах действенный способ поддержки репродуктивной функции – массаж предстательной железы.
Хирургическое вмешательство применяется, если нарушения появились при варикоцеле, орхипексии, пахово-мошоночных грыжах.
Как долго лечится мужское бесплодие?
Инфекционные патологии и их осложнения требуют длительного периода терапии: от 3 до 6 месяцев. После оперативного вмешательства, если удается купировать причину репродуктивной дисфункции, дополнительного лечения не нужно.
Гормонозаместительная терапия проводится под контролем врачей в течение 6-8 месяцев.
Профилактика и рекомендации врачей
Врачи советуют не заниматься самолечением любых патологий. Ответственное отношение к собственному здоровью позволит предотвратить развитие мужского бесплодия, поэтому следует:
- Избегать переохлаждений, перегрева, травм в области паха.
- Соблюдать предписания урологов и других врачей по лечению органов мочеполовой системы.
- Нормализовать интимную жизнь: выбрать постоянного партнера, отказаться от частых половых актов.
- Не принимать медикаменты без назначения врачей.
- Не злоупотреблять алкоголем, курением.
- Проходить регулярные обследования.
Умеренная физическая активность, отсутствие стрессов, правильное сбалансированное питание – залог здоровья мужчины.
Стоимость
Выгодные цены на услугу «Мужское бесплодие» представлены в медицинском центре Радуга, расположенном в Санкт-Петербурге. Опытные врачи центра ставят своей первоочередной задачей восстановление здоровья пациента без назначения лишних процедур, увеличивающих расходы на лечение. Мы предлагаем доступную стоимость на квалифицированную медицинскую помощь.
Консультация андролога
1800 руб.Лабораторный пр. 20, корп. 3
ул. Композиторов, д. 4
Можно доверять! Текст проверен врачом и носит общий информационный характер, не заменяет консультацию специалиста. Для рекомендаций по диагностике и лечению необходима консультация врача.
Источник https://www.gosmed.ru/lechebnaya-deyatelnost/spravochnik-zabolevaniy/ginekologiya-bolezny/besplodie/
Источник https://ktvm-spb.ru/uslugi/urologiya/lechenie-besplodiya-u-muzhchin.html
Источник https://radugaclinic.ru/muzhskoe-besplodie/