Сепсис
Сепсис – инфекционный процесс, характеризующийся наличием гнойного воспалительного очага в области «входных ворот», последующими заражением крови и генерализацией инфекции. Из первичного очага происходит попадание бактерий в кровяное русло (бактеремия), а через него — в различные органы и ткани (микробная эмболия). В ответ на инфекционный процесс развивается системная воспалительная реакция, идут лимфопролиферативные процессы (происходит увеличение селезенки и лимфатических узлов) и формируется полиорганная недостаточность (нарушение функций многих или даже всех органов).

Суперфуды в косметике: сочные коктейли для здоровья кожи и волос
Симптомы
Жалобы при заражении крови складываются из симптомов общей интоксикации организма и проявлений болезни, обусловленных локализацией вторичных очагов инфекции. Интоксикация проявляется тяжелой лихорадкой с ознобом, выраженной слабостью и общим плохим самочувствием, полным отсутствием аппетита, бледностью кожи, потливостью, частым сердцебиением, снижением артериального давления и выраженной одышкой в покое. Характерно поражение всех органов с развитием полиорганной недостаточности: сердца, легких, почек, надпочечников, печени и мозга.
Под тяжелым сепсисом понимают сочетание сепсиса с органной дисфункцией, т.е. поражением органов, которое сопровождается выраженной гипотензией (падением артериального давления). Основные предъявляемые жалобы при этом неспецифичны и зависят от степени вовлечения различных органов. Отмечаются повышение температуры тела, озноб, потливость, общее недомогание, кашель, одышка, аритмия, боли в животе, кровоточивость десен, носовые кровотечения, тошнота и рвота (при развитии гастроэнтерита), уменьшение выделения мочи (при тяжелом сепсисе).
Формы
По клиническому течению сепсис классифицируют на молниеносный (1-2 суток), острый (5-10 суток без ремиссии), подострый (2-12 недель), хронический (более 3-х месяцев).
По наличию или отсутствию первичного очага: криптогенный или первичный (первичный очаг и входные ворота инфекции не найдены) и вторичный, когда определен первичный очаг или входные ворота инфекции.
По особенностям клинической картины различают септицемию (сепсис без метастазов) и септикопиемия – сепсис с гнойными метастазами.
В зависимости от возбудителя инфекции, выделяют аэробный, анаэробный, вирусный, грибковый и смешанный сепсис.
Причины
Возбудителями сепсиса, как правило, являются стрептококки и стафилококки, реже – кишечная палочка и пневмококк, неферментирующие грамотрицательные бактерии (Pseudomonas aeruginosa и Acinetobacter spp.), а также Klebsiella pneumoniae и продуценты бета-лактамаз расширенного спектра, Enterobacter cloacae, грибы рода Candida. Обычно в организме существует первичный очаг хронической инфекции. Это может быть и нагноившаяся рана, и больной зуб, и хронический простатит, а также постоперационные осложнения (хирургический сепсис) и другие очаги. У 30% пациентов с бактериемией и полиорганной недостаточностью источник инфекции определить не удается.
Методы диагностики
Диагностика сепсиса основана на жалобах, данных анамнеза, клинического осмотра, обязательного применения лабораторных и инструментальных методов обследования. Диагностика направлена на определение клинической формы заболевания, выявления этиологического фактора, тяжести состояния и возникающих осложнений.
Диагноз сепсиса ставят на основании сочетания ряда признаков: температура тела выше 38,5 °С или ниже 36 °С; количество лейкоцитов (белых клеток крови) более 12. 000 в мм³ или менее 3.500 в мм³; установлен гнойный очаг; получен положительный посев крови на патогенные микроорганизмы.
Дополнительно должен присутствовать как минимум один из следующих факторов:
- артериальная гипотония (систолическое артериальное давление ниже 80 мм рт. ст.) в течение более 2 часов;
- необходимость применения инотропных препаратов для поддержания среднего артериального давления выше 85 мм рт. ст.;
- общее периферическое сосудистое сопротивление ниже нормы;
- метаболический ацидоз (снижение уровня бикарбоната (HCO3−), обычно сопровождающееся компенсаторным понижением парциального давления углекислого газа).
Одним из ранних признаков сепсиса может быть гипергликемия (повышение уровня сахара крови) выше 7,7 ммоль/л при условии отсутствия в анамнезе сахарного диабета.
Из данных анамнеза можно выяснить наличие в прошлом операционных вмешательств, различных воспалительных процессов – кариес, цистит (воспаление мочевого пузыря), простатит (воспаление простаты), фурункулы, абсцессы (ограниченное капсулой скопление гноя в тканях), ангина, гнойный отит, синуситы (воспаление околоносовых пазух), пневмонии и другие болезни; аборт.
При объективном осмотре: тахикардия (учащенное сердцебиение), снижение артериального давления, одышка, мраморность кожи. Выявляются кровоизлияния в слизистые и под кожу – геморрагическая сыпь (у трети пациентов), кровоизлияния в конъюнктиву, желтушность склер и кожных покровов, увеличение лимфоузлов, увеличение селезенки и печени.
Биохимическими маркерами сепсиса являются прокальцитонин, пресепсин и С-реактивный белок (повышение уровня более 24 мг/л). Повышение уровня прокальцитонина выше 2 нг/мл является подтверждением наличия сепсиса, а содержание более 10 нг/мл свидетельствует о тяжелом бактериальном сепсисе, септическом шоке и высоком риске летального исхода.
В биохимическом анализе крови отмечаются гипербилирубинемия (повышение уровня билирубина), увеличение содержания креатинина и мочевины (продуктов распада белков). Концентрация С-реактивного белка повышается более, чем в 2 раза (пик 12-24 часа). Определяется увеличение содержания интерлейкинов (веществ, ответственных за воспалительные реакции): IL6, IL10.
Одним из перспективных тестов в диагностике сепсиса является определение в крови LPS-связывающего белка (белок, связывающий липополисахариды (компоненты клеточной стенки) бактерий), концентрация которого при сепсисе повышается в 10 раз. Для определения бактериальных эндотоксинов в крови (липополисахаридов) применяется LAL–тест.
В клиническом анализе крови отмечается лейкоцитоз (повышенное содержание лейкоцитов) со сдвигом лейкоцитартной формулы влево, ускорение скорости оседания эритроцитов (СОЭ), признаки гипохромной анемии (снижение гемоглобина и эритроцитов, цветового показателя), тромбоцитопения (снижение уровня тромбоцитов).
Проводится микробиологическое исследование — посев на среды содержимого гнойного очага с целью идентификации микроорганизмов и проведения теста на антибиотикочувствительность. Исследование нужно проводить до начала антибиотикотерапии.
Инструментальная диагностика применяется в случаях необходимости для выявления первичного очага инфекции при наличии осложнений различных органов и систем (ультразвуковое исследование, рентгенография, компьютерная томография).
Основные используемые лабораторные исследования:
- Клинический анализ крови (лейкоцитарная формула, СОЭ).
- Биохимический анализ крови (включая С-реактивный белок).
- Прокальцитонин.
- Коагулограмма (определение свертываемости крови).
- Кислотно-основное равновесие (КОС), включая лактат.
- Общий анализ мочи с микроскопией осадка.
- Анализ крови на стерильность, посев на наличие возбудителей (синегнойная палочка, золотистый стафилококк, пневмококк, патогенные штаммы кишечной палочки, протейная инфекция, клебсиеллы, грибы).
Дополнительные используемые лабораторные исследования:
- Интерлейкин 6 (ИЛ-6, маркер воспаления).
- Фактор некроза опухоли-альфа (ФНО-альфа, маркер воспаления).
- LPS-связывающий белок (компонент острой фазы воспаления).
- Определение содержания CD14 (маркер воспаления).
- LAL-тест (метод определения содержания эндотоксинов).
- Пресепсин (ранний маркер развития сепсиса).
Основные используемые инструментальные исследования:
- ЭКГ.
- УЗИ брюшной полости и почек.
- Рентгенография грудной клетки.
- КТ, МРТ органов брюшной полости, грудной клетки и других органов по показаниям.
Лечение
Лечение сепсиса включает в себя интенсивную дезинтоксикационную (инфузионную) терапию, массивную антибиотикотерапию ударными дозами и противогрибковую терапию. В некоторых случаях требуется переливание компонентов крови. Такое лечение должно проводиться только в условиях реанимации.
Сепсис — крайне грозное состояние, и прогноз при любом виде и форме сепсиса всегда серьезен. Главное — своевременно поставить диагноз и начать лечение как можно раньше, это повышает вероятность благополучного исхода. Сложность в диагностике и своевременном лечении сепсиса состоит в наличии большого количества стертых форм, когда клиническая картина скрыта.
Осложнения
Грозные осложнения — развитие полиорганной недостаточности (нарушение функции печени, почек, легких), развитие ДВС-синдрома (нарушение свертываемости крови вследствие повышенного тромбообразования), менингит (воспаление спинного мозга), сердечная недостаточность.
Профилактика
Профилактика сепсиса заключается в необходимости своевременного и адекватного, лечения очагов инфекции, в частности, своевременное и адекватное назначение антибиотиков.
Какие вопросы следует задать врачу
Какие обследования необходимы для подтверждения диагноза?
Можно ли вылечиться от сепсиса?
Советы пациенту
При подозрении на сепсис необходимо незамедлительно обратиться к врачу, так как лечение проводится в условиях отделения интенсивной терапии
Сепсис (заражение крови)
Сепсис (заражение крови) представляет собой патологический процесс, в основе которого реакция организма на патогенные факторы различной природы в виде генерализованного (системного) воспаления, сочетающего с остро возникшими симптомами системной дисфункции (полиорганной недостаточности) и/или микробной диссеминацией.
Зачастую заражение крови называется бактериальной инфекцией крови. Сепсис — инфекционно индуцированный синдром, проявляющийся в виде системного воспалительного ответа организма на эндотоксиновую агрессию. При этом бактериемия (наличие в крови живых бактерий) является важным, но не обязательным условием развития сепсиса. Отличием сепсиса от инфекции является не соответствующий норме ответ организма человека на инфекцию в сочетании с угрожающей жизни органной дисфункцией. То есть, возникновение сепсиса обусловлено не только свойствами возбудителя инфекции, но и состоянием макроорганизма — его неспособностью к локализации инфекционного агента, обусловленного недостаточностью иммунитета.
Актуальность проблем сепсиса обусловлена ростом его распространенности, высоким уровнем заболеваемости и летальности, что относит сепсис к важным медико-социальным проблемам. Данные эпидемиологических исследований в индустриально развитых странах свидетельствуют, что частота сепсиса варьирует в пределах 50-100 случаев/100 тыс. населения, а уровень смертности остается стабильно высоким (по данным разных авторов — от 15 до 75%) в зависимости от стадии сепсиса, его возбудителя, лечения (рис. ниже). Ведущей причиной смерти при сепсисе является прогрессирующая органная дисфункция.

Смертность при разных типах сепсиса
Существует ряд предпосылок, способствующих высокому риску развития сепсиса, в частности:
- Развитие и широкое внедрение в медицинскую практику инвазивных медицинских технологий/процедур, ассоциированных с контаминированностью оборудования и широким использованием внутрисосудистых устройств.
- Рост количества штаммов микроорганизмов устойчивых к антибиотикам, что обусловлено бесконтрольным/необоснованным применением препаратов широкого спектра действия.
Течение сепсиса в большинстве случаев проходит стадийно (рис. ниже), в соответствии с чем выделяют:
- Сепсис — как системный воспалительный ответ на инфекцию.
- Тяжелый сепсис — как сепсис с признаками гипоперфузии и органной дисфункции хотя бы одной из систем: дыхательной, сердечно-сосудистой, гемостаза, мочевыделительной, печени, центральной нервной системы.
- Септический шок — тяжелый сепсис с наличием полиорганной дисфункции (дисфункция по 2 и более системам/органам).
К группам высоким риском развития сепсиса относятся хирургические, онкологические, ожоговые больные, пациенты с иммунодефицитными состояниями, роженицы, недоношенные дети с малым весом, дети с хромосомными заболеваниями и врожденными пороками развития, длительно находящиеся в стационаре.
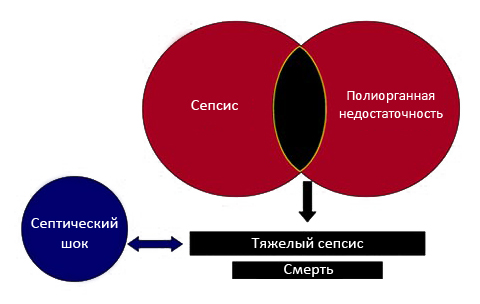
Также развитию сепсиса способствует длительная катетеризация сосудов, искусственная вентиляция легких, проведение длительной иммуносупрессивной терапии, длительный прием глюкокортикостероидных средств, хирургические вмешательства с высокой травматизацией тканей, прием инъекционных наркотиков.
Риск возникновения сепсиса определяется и локализацией первичного очага инфекции — брюшная полость, легкие, мочевыделительная система, раневая поверхность и др. Отмечается относительно высокая инцидентность сепсиса у пожилых пациентов, мужчин и среди детей раннего возраста.
Патогенез
Патогенез развития сепсиса достаточно сложен для краткого изложения и специфичен, в связи с чем перечислим лишь его основные патогенетические звенья:
- длительно сохраняющаяся (постоянная/дискретная) бактериемия/микробная токсемия, обусловленные гнойно-септическими заболеваниями;
- развитие эндогенной интоксикации (эндо/ауто-токсикоз) биологически активными веществами;
- системный деструктивный васкулит;
- нарастание процессов гиперкоагуляции с развитием коагулопатии, ДВС-синдрома;
- развитие выраженной иммунной недостаточности, обусловленной нарушением процессов регуляции иммунореактивности, формированием состояния иммунодепрессии с дезинтеграцией иммунной системы в целом;
- развитие и проявления полиорганной недостаточности.
Таким образом, с позиций современной науки — сепсисологии, развитие органно-системных повреждений обусловлено распространением из первичного очага инфекционного воспаления провоспалительных медиаторов с последующей их активацией в других органах/тканях под влиянием макрофагов и выделением эндогенных субстанций.
При неспособности регулирующих систем организма поддержать гомеостаз, начинает доминировать деструктивное действие цитокинов и других медиаторов, что вызывает нарушение функции и проницаемости эндотелия капилляров, развитие ДВС-синдрома и моно/полиорганной дисфункции.
Наблюдается нарушение метаболизма из-за выраженной интоксикации, нарастание процессов катаболизма (гипергликемия, гипоальбуминемия, диспротеинемия, гиповитаминоз, анемия и др.).
Классификация
Существует большое количество классификаций сепсиса в основу которых положены те или иные факторы/принципы. Рассмотрим лишь основные. Различают первичный (криптогенный сепсис) и вторичный сепсис.
Криптогенный сепсис встречается относительно редко. Как правило, криптогенный вид сепсиса связывают с аутоинфекцией (кариозными зубами, хроническим тонзиллитом или другой дремлющей инфекцией).
Вторичный сепсис является частой формой и развивается на фоне наличия гнойного очага в организме хозяина: гнойной раны, гнойного заболевания, оперативного вмешательства. Вторичный септический процесс в свою очередь, в зависимости от входных ворот инфекции подразделяется на:
- Одонтогенный сепсис– как правило, одонтогенный сепсис обусловлен различными заболеваниями со стороны зубочелюстной системы: гранулемами, кариесом, апикальным периодонтитом, околочелюстными флегмонами, периоститом, остеомиелитом челюстей и др.
- Хирургический сепсис – развивается при заносе инфекционного возбудителя в кровь из послеоперационной раны. Хирургический сепсис — один из наиболее часто встречаемых видов.
- Абдоминальный сепсис — как следствие первоначального развития деструктивного процесса в разных органах брюшной полости или забрюшинного пространства. Абдоминальный сепсис часто развивается при гнойно-некротическом деструктивном панкреатите.
- Акушерско-гинекологический сепсис — как следствие осложненных родов и абортов.
- Уросепсис – входными воротами при котором являются органы мочеполовой сферы. Уросепсис может развиваться при пиелонефритах, мочекаменной болезни и др.
- Ангиогенный сепсис — с локализацией первичного очага в сердце. Ангиогенный сепсис обусловлен абсцессами сердца, инфекционным эндокардитом.
- Неонатальный сепсис — это сепсис у новорожденных детей (ранний и поздний неонатальный сепсис).
- Плевро-легочный сепсис — развивается на фоне различных гнойных заболеваний легких: пневмонии, абсцесса легких, эмпиемы плевры и др.
- Отогенный — обусловлен воспалительными заболеваниями среднего уха.
- Кожный сепсис — источником инфекции являются гнойные заболевания кожи: ожоги, фурункулы, абсцессы, инфицированные раны и др.
По клиническому течению выделяют:
- молниеносный сепсис с генерализацией воспалительного процесса в течение 12-24 часов и летальным исходом в течение 1-2 суток;
- острый — клиническая симптоматика проявляются в течение нескольких дней и продолжительностью до 4 недель;
- подострый с продолжительностью 6-12 недель;
- рецидивирующий сепсис —протекает в виде периодических обострений и ремиссий, длительностью до 6 месяцев;
- хронический сепсис — может протекать на протяжении ряда лет; хронический сепсис протекает со слабо выраженными периодическими обострениями и длительными ремиссиями.
По анатомо-клиническим признакам:
- Септицемия — сепсис крови с отсутствием в тканях/органах гнойных очагов-метастазов.
- Септикопиемия — воспаление крови с диссеминацией возбудителей, формированием вторичных метастатических гнойных очагов со стойкой бактериемией. По фазам течения сепсиса: фазы напряжения, катаболическая, анаболическая и реабилитационная.
По этиологическому фактору различают бактериальный (пневмококковый, стафилококковый, стрептококковый и др.), вирусный, грибковый, вызванный простейшими и др.
Причины сепсиса
Сепсис — полиэтиологическое заболевание, которое могут вызывать различные патогенные/условно-патогенные микроорганизмы. К основным возбудителям сепсиса относятся:
- энтеробактерии — кишечная палочка (Escherichia coli), синегнойная палочка (Pseudomonas spp.), клебсиелла (Klebsiella spp.) и др.;
- грамположительные кокки — стафилококки (Staphylococcus aureus, Enterococcus spp., Staphylococcus epidermidis), стрептококки (Streptococcus A и B spp.);
- пневмококки (Streptococcus pneumoniae);
- неспорообразующие анаэробы (пептострептококки, пептококки и др.);
- вирусы (аденовирусная, энтеровирусная инфекция и инфекция, вызываемая респираторно-синцитиальным вирусом);
На рисунке ниже приведена этиологическая структура возбудителей сепсиса:
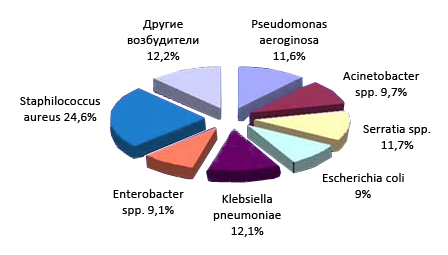
Этиологическая структура нозокомиальных инфекций крови
Во многих случаях причины заражения крови обусловлены смешанной — бактериально-вирусной инфекцией (микробными ассоциациями). Как правило, это гнойно-септические инфекции, вызываемые госпитальными штаммами (внутрибольничная инфекция), обладающих наряду с высокой вирулентностью выраженной полирезистентностью к целому ряду антибактериальных препаратов.
В развитии тяжелых госпитальных инфекций, все большее значение имеют грибы (Candida spp). Согласно современным данным сепсис, вызванный грамотрицательной микрофлорой, сопряжен с развитием септического шока и сопровождается более высокой смертностью, чем сепсис, обусловленный грамположительной микрофлорой (стрептококковый сепсис или пневмококковый сепсис). Также осложняют течение сепсиса и ухудшают его исход микст-формы микроорганизмов. Возбудители могут как заноситься в кровь из очагов первичной гнойной инфекции, так и попадать в кровь из окружающей среды.
Важнейшие причины (факторы), приводящие к срыву устойчивости организма к инфекционным агентам и развитию сепсиса:
- качественные и количественные свойства инфекционного возбудителя: вирулентность, массивность, генерализация процесса в организме через кровь/лимфу;
- наличие септического очага в организме человека, связанного периодически/постоянно с кровяным или лимфатическим руслом, развитие иммунодефицита.
Симптомы сепсиса
Какие симптомы при заражении крови у человека? Как таковых патогномоничных симптомов для сепсиса нет. Клиническими критериями сепсиса у взрослых, как варианта ССВО, являются:
- температура тела выше 38 °C или меньше 36 °C;
- частота дыхания 20 вдохов в минуту и более; 90 ударов в минуту и более; менее 4000 в 1 мкл;
- лейкоцитоз более 12000 в 1 мкл.
Симптоматика сепсиса чрезвычайно полиморфна и зависит от этиологии и возбудителя, локализации первичного очага инфекции, формы и тяжести течения заболевания. Основные симптомы сепсиса у взрослых обусловлены общей интоксикацией, локализацией метастазов и выраженностью полиорганных нарушений.
В случаях наиболее часто встречающейся острой форме сепсиса симптомы у взрослых, как правило, проявляются:
- Нарушением общего состояния и функции нервной системы, что проявляется раздражительностью, бессонницей, головной болью, помрачением/потерей сознания. Характерна повышенная потливость и периодически наступающие ознобы. Температура тела в большинстве случаев держится на высоком уровне со значительными колебаниями на протяжении дня, вечером, особенно в случаях наличия метастазов. Характерно истощение больного, у большинства происходит существенное снижение массы тела. На коже в ряде случаев появляется геморрагическая сыпь. При этом при пневмококковом сепсисе характерно появление на коже грудной клетки мелкоточечной сыпи; при стафилококковом сепсисе геморрагическая сыпь появляется на ладонной поверхности пальцев. При менингококцемии полиморфная геморрагическая сыпь появляется на лице, туловище, конечностях. Отмечается нарушения со стороны системы пищеварения: сухой, обложенный язык, отсутствие аппетита, могут присутствовать тошнота и рвота, реже упорные септические поносы.
- Практически у всех больных симптомы заражения крови проявляются поражением дыхательной системы, клинические проявления которого могут широко варьировать, начиная от влажных хрипов при аускультации и одышки до развития выраженных нарушений газообменных/негазообменных функций легких (респираторный дистресс-синдром).
- Признаки сепсиса у взрослых проявляются и нарушениями со стороны сердечно-сосудистой системы в виде не соответствующей повышению температуры тела тахикардии, уменьшении наполнения пульса, снижении артериального/венозного давления. Возможны сосудистые и трофические расстройства в виде отеков, пролежней, тромбозов, тромбофлебитов, лимфангитов. В ряде случаев сепсис может осложниться кардиомиопатией, токсическим миокардитом, развитием острой сердечно-сосудистой недостаточности.
- Ухудшением функции печени, зачастую с появлением желтухи и развитием явлений гепатита, увеличением селезенки.
- Нарушением функция почек. Отмечается микрогематурия, снижение относительной плотности мочи, альбуминурия, цилиндрурия, часто развивается олигурия (анурия).
- Со стороны крови первые признаки: лейкоцитоз со сдвигом лейкоцитарной формулы влево, анемия, ускоренная СОЭ, токсическая зернистость нейтрофилов, диспротеинемия, гипербиллирубинемия, увеличение содержания креатинина и мочевины.
Следует отметить, что первые признаки заражения крови при остром течении могут развиваться бурно и проявляется за несколько часов/суток в отличие от хронического сепсиса, для которого характерно вялое течение с малозаметными изменениями, которые протекают длительно. Для рецидивирующего сепсиса характерна периодическая смена обострений с выраженными клиническими проявлениями и ремиссий, когда заметной симптоматики сепсиса выявить не удается.
Ниже на рисунке приведены фото больных сепсисом:
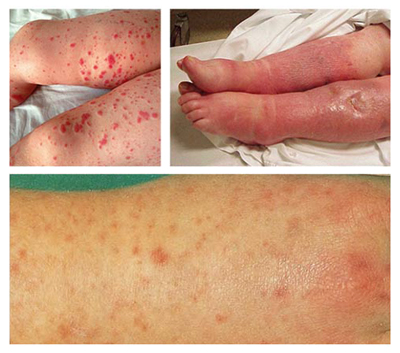
Следует отметить, что наличие клинических проявлений без проведения комплекса лабораторных исследований не позволяет распознать и однозначно поставить диагноз «сепсис».
Также при сепсисе происходят характерные изменения и в первичном очаге инфекции — замедляется заживление ран, грануляции приобретают бледную окраску, становятся вялыми, кровоточащими, а дно раны покрывается участками некроза и грязно-сероватым налетом. Отделяемое из раны приобретает зловонный запах и мутный цвет.
В случаях образования метастатических очагов в различных органах и тканях, происходит наслоение дополнительной специфической симптоматики, характерной для гнойно-септического процесса конкретной локализации. Так в результате заноса инфекции в легкие развивается клиническая симптоматика абсцессов легкого, гнойного плеврита, пневмонии.
При метастазах в почки присутствует клинические симптомы пиелитов, паранефритов. При поражении головного мозга возникают абсцессы головного мозга и гнойный менингит. Появление метастатических очагов в опорно-двигательной системе проявляется симптомами остеомиелита/артрита. При метастазах в сердце — эндокардит/перикардит, в органы брюшной полости (абсцессы печени), подкожно-жировую клетчатку или мышцы — абсцессы мягких тканей и т.д.
Анализы и диагностика сепсиса

Клинико-диагностическая концепция сепсиса традиционно включает в диагностические критерии сепсиса наличие у пациента инфекционного очага и 2 и более из 4 признаков синдрома системного воспалительного ответа — ССВР (шкала SOFA), которая включает:
- температуру тела — более 38 °C или менее 36 °C;
- частоту дыхания — более 20 вдохов в минуту;
- сердечный ритм — более 90 ударов в минуту;
- количество лейкоцитов — более 12000 на 1 мкл или менее 4000 на 1 мкл;
- наличие в крови более 10% незрелых форм лейкоцитов.
Диагноз «сепсис» ставится при наличии ≥ 2 критериев и наличии установленного/предполагаемого инфекционного очага. Вместе с тем в ряде случаев (в частности, на фоне неинфекционного системного воспалительного ответа) эти критерии становятся низкоспецифичными и малоинформативными. Следует отметить, что микробиологическое исследование биологических сред, хотя и определяется как «золотой стандарт» обследования осложнений гнойно-септических инфекций, тем не менее, без клинико-лабораторного подтверждения считается лишь транзиторной бактериемией.
Современные алгоритмы диагностики сепсиса включают использование лабораторных маркеров, которые позволяют связать наличие в организме инфекции, оценить уровень воспалительной реакции и наличие сепсиса. К основным маркерам относятся:
- Прокальцитониновый тест (ПКТ). Уровень прокальцитонина является одним из маркеров системного воспаления (ССВР), при этом, его концентрация при тяжелых бактериальных инфекциях повышается, что позволяет дифференцировать бактериальное воспаление от не бактериального, оценивать тяжесть больного и эффективность терапевтических мероприятий. Уровень прокальцитонина в норме не превышает показатель 0,5 нг/мл. Его увеличение интервале 0,5 2,0 нг/мл сепсис не исключает, однако может свидетельствовать об обширном высвобождении провоспалительных цитокинов, обусловленном обширной травмой, ожогом большой площади тела, хирургическом вмешательстве с обширной травматизацией тканей и др. При показателе прокальцитонина на уровне, превышающим 2 нг/мл с высокой долей вероятности можно предположить развитие сепсиса, а при 10 нг/мл и более – тяжелый сепсис/септический шок (рис. ниже).
- Пресепсин маркер (P-SEP). Пресепсин-маркер относится к более чувствительным и специфическим диагностическим маркерам в диагностике сепсиса. При этом, концентрация P-SEP в плазме у инфицированных пациентов значительно выше, чем у неинфицированных. Этот биомаркер можно использовать не только для ранней диагностики сепсиса, но и для адекватной оценки его тяжести и дальнейшего прогноза. Важно и то, что при развитии сепсиса увеличение концентраций P-SEP происходит значительно быстрее, чем других маркеров сепсиса (в течение 1,5–2,0 часов после появления системного ответа организма на инфекцию).
- С-реактивный белок (СРБ). Не является специфическим маркером сепсиса. Показатель С-реактивного белка, превышающий два стандартных отклонений от среднего значения, свидетельствует о наличии воспаления.
- Интерлейкин-6 (ИЛ-6). Не специфический маркер. Его продукция существенно повышается на фоне острых воспалительных реакций различной этиологии. Мониторинг уровня ИЛ-6 в сыворотке крови важен для оценки выраженности ССВР, сепсиса и септического шока, является важнейшим ранним маркером неонатального сепсиса. Как правило, его показатели положительно коррелирует с показателями других лабораторных тестов (СРБ, Р-SEP) и тяжестью клинических проявлений.
- Маркер neutrophil CD64. Наличие на поверхности нейтрофилов гликопротеина CD64 является достоверным признаком инфекции и сепсиса с показателями чувствительности и специфичности соответственно 85 и 76% (рис. ниже).
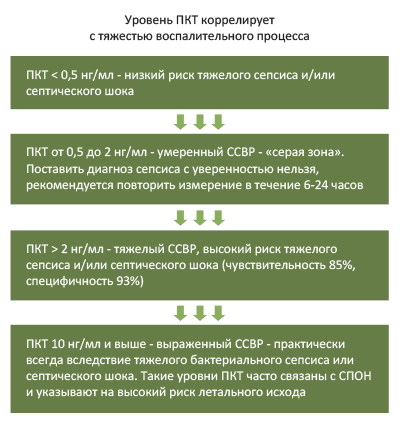
Зависимость уровня ПКТ от тяжести воспалительного процесса
Для поиска источника инфекции могут использоваться различные инструментальные методы: рентгенографию, компьютерную томографию, УЗИ, пункцию предполагаемого абсцесса и др.
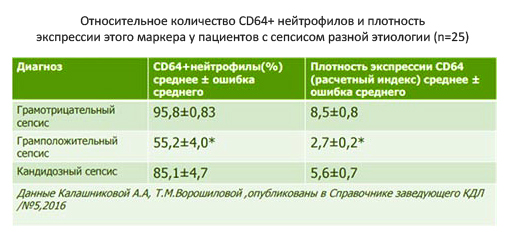
Следует отметить, что ни один из маркеров не может использоваться в отдельности и лишь комплексная оценка всех показателей в динамике в совокупности с клиническими проявлениями, данными объективного обследования (частота сердечных сокращений АД, мониторинг кислородного статуса, данными анализа крови, включающий лейкоцитарную формулу, показатели, креатинина, электролитов), бактериологическим посевом биологических жидкостей/биоптата и инструментальными исследованиями позволяет поставить диагноз.
Лечение сепсиса
Лечится ли заражение крови? Безусловно, лечится, однако эффективность лечения сепсиса определяется целым рядом фактором, в том числе и быстротой начала эмпирической антибактериальной терапии.
Как лечить сепсис? Прежде всего, пациенты с септическим шоком должны быть переведены в отделении интенсивной терапии с почасовым контролем за параметрами центральной гемодинамики, уровнем глюкозы, электролитов и лактата в крови, пульсометрией, газовым составом артериальной крови, функцией почек.
Даже при наличии незначительного первичного очага в виде гнойной раны не следует забывать о риске развития сепсиса и заниматься санацией очага самостоятельно, посещая форум о сепсисе (септический форум), где даются непрофессиональные рекомендации. Адекватное удаление инородных тел и дренирование гнойного экссудата должно осуществляться лишь в лечебном учреждении. Лечение заражение крови базируется на комплексе мероприятий и алгоритмы лечение сепсиса направлены на:
- эрадикацию микроорганизмов из кровотока;
- стабилизацию состояния пациента;
- осуществление неотложных мер в очаге инфекции (санация источника инфекции).
Эрадикация микроорганизмов из кровотока осуществляется назначением антибиотикотерапии, включающей, как минимум, два класса антибиотиков с широким спектром действия для воздействия на максимально широкий спектр патогенов, в том числе бактерий, грибов и вирусов.
Антибиотикотерапия. Назначение эмпирической внутривенной антибактериальной терапии — обязательное условие эффективности лечения и должно быть начато в течение 1 часа после выявления первых симптомов сепсиса или сразу после идентификации возбудителя. Для этиотропной терапии рекомендуется комбинированная терапия 2 или даже 3 антимикробными препаратами, например цефалоспорины в комбинации с аминогликозидами и препаратами с антианаэробной активностью или, например, монотерапия карбапенемами (имипенем, Меропенем). Однако, после комбинированной терапии переход на монотерапию возможен только после получения однозначных и достоверных результатов микробиологического исследования.
При назначении эмпирической терапии необходимо ориентироваться на вероятность присутствия той или иной группы патогенов (наиболее вероятный спектр возбудителей). Так, при высокой вероятности развития внебольничного грамположительного сепсиса рекомендуется назначать бета-лактамные антибиотики с выраженной антистафилококковой активностью (Цефазолин, Оксациллин), а при высокой вероятности развития грамположительного внутрибольничного сепсиса – гликолипидные антибиотики (Ванкомицин).
В случаях подозрения на сепсис, вызванный анаэробной инфекцией, назначается Клиндамицин или Метронидазол. Следует не забывать, что неадекватная антибиотикотерапия более чем в 2 раза превышает летальности пациентов, чем больных, получающих адекватную терапию. Длительность антибиотикотерапии решается индивидуально, составляя в среднем 10-12 дней, однако, может быть продолжена до достижения стойкой положительной динамики, стабилизации гемодинамики и купирования клинических симптомов инфекции.
Меры по стабилизации состояния пациента включают:
- В случаях нарушениях сознания — восстановление проходимости дыхательных путей. Для устранения гипокапнии и поддержания адекватного насыщения крови кислородом проводится интубация и искусственная вентиляция легких, являющаяся обязательной при развитии респираторного дистресс-синдрома, внутричерепной гипертензии.
- При снижении АД и наличии микроциркуляторных нарушений требуется быстрое восстановление объема циркулирующей крови. При этом, кровинфузионная терапия для каждого пациента должна быть индивидуальной. В большинстве случаев при необходимости восполнения внутрисосудистого объема, оптимальным выбором являются коллоиды (растворы гидроксиэтилкрахмалов: Стабизол, Гекодез, Рефортан, Хаэс-Стерил, Полигидроксиэтилкрахмал, Инфукол и др.), в то время как кристаллоиды (солевые растворы К, Mg аспарагинат, раствор Гартмана, Рингера, Мафусол) показаны преимущественно для коррекции внесосудистого дефицита жидкости. Инфузия жидкости осуществляется в объеме 500–1000 мл кристаллоидов/300–500 мл коллоидов в течение 30 мин и если АД или мочеотделение не увеличились и признаков перегрузки сосудистого русла отсутствуют инфузия повторяется. Установлено, что адекватная ранняя инфузионная терапия способствует повышению выживаемости больных с сепсисом.
- Вазопрессоры. Введение вазопрессоров начинают в случаях неэффективности инфузионной терапии (не восстанавливается перфузия органов) и АД. К препаратам выбора относятся Норадреналин и Допамин. Возможно использование вазопрессина у пациентов резистентным к высоким дозам вазопрессоров.
- Инотропы. Показаны при низком сердечном индексе (Добутамин).
- Введение других групп препаратов (кортикостероидов, иммуноглобулинов, антикоагулянтов, анальгетиков) решаются в каждом конкретном случае. У пациентов с сепсисом при остром повреждении почек показано применение методов заместительной почечной терапии.
Меры в очаге инфекции
Экстренная санация источника микробной контаминации проводится лишь после проведения всего комплекса адекватных реанимационных мероприятий. Включает обследование пациента для установления локализации источника инфекции и радикальное удаление поврежденных/некротизированных тканей, дренирование абсцессов и санацию септического очага инфекции. При этом, важно качество санации инфекционного очага (адекватное дренирование, лаваж), поскольку любые методы терапии, в том числе и антибиотики не будут эффективными при наличии гнойного содержимого (гной в крови и содержимом раны).
Механическое промывание является даже более важным, чем местное назначение антисептиков/антибиотиков. В случаях необходимости (невзирая на тяжесть состояния пациента) должно проводиться своевременное хирургическое вмешательство (санация/дренирование брюшной полости, лапаротомия, спленэктомия и др.), поскольку альтернативы хирургической тактике не существует, невзирая даже на риск развития СШ. В любом случае в очаге гноя быть не должно.
Санация в целом не ограничивается хирургической санацией, а предполагает и другие методы, например, санацию трахеобронхиального дерева с помощью фибробронхоскопии при септической пневмонии. Лишь следуя принципу тщательной санации септического очага можно предотвратить прогресс системного воспаления и повысить прогноз выживаемости.
Доктора

Абдуллина Эльза Альбертовна

Обухов Алексей Сергеевич

Хаменская Валерия Валерьевна
Лекарства
Процедуры и операции
Дренирование, лаваж очага инфекции. Оперативное вмешательство по показаниям (санация/дренирование брюшной полости, лапаротомия, спленэктомия и др.) направленное на ликвидацию, как первичного очага, так и метастатических гнойных очагов.
Сепсис у детей
Сепсис является одной из основных причин летальности у детей. Особую актуальность представляет сепсис новорожденных, частота развития которого у доношенных новорожденных составляет 0,2%, а у недоношенных малышей — 1,5%. Большое значение в повышении восприимчивости к инфекции и развитию сепсиса имеет иммунологическая недостаточность у ребенка в период новорожденности, что обусловлено недостаточным количеством антител, передающихся от матери трансплацентарным путем и быстрым снижением их уровня.
Соответственно организм ребенка не в состоянии вызвать высокий своевременный каскадный иммунный ответ на инфекцию. К тому же, у ребенка имеет место выраженная дефектность бактерицидных субстанций макрофагов/нейтрофилов. Из факторов, способствующих иммунологической недостаточности новорожденных особое значение имеет наличие гипотрофии (врожденной/приобретенной) и искусственное вскармливание. К важнейшим предпосылкам развития сепсиса относятся:
- инфицирование ребенка госпитальными бактериальными штаммами;
- развитие дисбактериоза на фоне сопутствующих суперинфекций и неадекватной антибактериальной терапии.
Выделяют ранний и поздний сепсис у новорожденных детей. Ранний неонатальный сепсис – это сепсис, развившийся у детей в первые три дня жизни. Для него характерно внутриутробное инфицирование или раннее постнатальное заражение, в связи с чем, у новорожденных детей первичный гнойный очаг отсутствует, а наиболее частой формой его проявления является так называемая «внутриутробная пневмония». Источником инфекции, как правило, являются патогены, колонизирующие родовые пути матери, реже наблюдается и трансплацентарное инфицирование.
Если клиническая манифестация сепсиса (симптомы) проявляется в более поздние сроки, его относят к позднему неонатальному сепсису, при котором инфицирование ребенка происходит постнатально. Обычно присутствует первичный очаг инфекции и чаще регистрируется септикопиемия (наличие септикопиемических или метастатических, гнойно-воспалительных очагов).
Факторы риска бактериального инфицирования плода/новорожденного и генерализации бактериальной инфекции:
- Заболевания у беременной инфекционно-воспалительного генеза: кольпит, пиелонефрит, аднексит.
- Наличие инфекции у роженицы: мастит, эндометрит.
- Длительный безводный период в родах (более 6 часов).
- Инфицирование амниона («грязные» воды).
- Внебольничные роды, наследственные заболевания, пороки развития.
- Тяжелая асфиксия на фоне внутриутробной хронической гипоксии.
- Недоношенность с выраженным при рождении дефицитом массы тела.
- Ятрогенные факторы: хирургические вмешательств, аппаратная ИВЛ (интубация трахеи) длительностью более 3 суток, частая катетеризация периферических вен, длительность внутривенных инфузий.
Симптомы сепсиса у детей могут значительно варьировать. Основными клиническими признаками полиорганной недостаточности являются:
- Со стороны ЦНС: возбуждение/угнетение, судороги.
- Со стороны сердечно-сосудистой систем: бради/тахикардия, нитевидный пульс, глухость сердечных тонов, гипо/гипертензия.
- Со стороны дыхательной системы: апноэ/тахипноэ, втяжение уступчивых мест на грудной клетке.
- Со стороны ЖКТ: диарея, парез кишечника, отказ от сосания, патологическая потеря массы.
- Со стороны мочевыделительной системы: олиго-/анурия.
- Кожные покровы: бледность, сыпь, отечность, серая/желтушная окраска, склерема, цианоз, симптом «белого пятна».
У детей старше 7 дней при наличие очага инфекции и хотя бы двух признаков полиорганной недостаточности позволяет предположить сепсис даже в случаях отсутствии в крови высева микроорганизмов, а в отделениях для недоношенных детей — в диагностике сепсиса принят угрозометрический подход. При наличии серьезного инфекционно-воспалительного очага в сочетании с 1-2 признаками ПОН или системной воспалительной реакции дается заключение о высокой угрозе развития сепсиса и начинает проводиться терапия как уже при начавшемся сепсисе.
Лечение сепсиса новорожденных сочетает этиотропную терапию с патогенетической коррекцией иммунных, метаболических и органных нарушений. Стартовая антибактериальная терапия включает цефалоспорин 3-го поколения в комбинации с аминогликозидами или монотерапию карбапенемом. После уточнения возбудителя: цефалоспорин 4-го поколения (Цефепим) в комбинации с резервным аминогликозидом, например Амикацин; монотерапия — Ванкомицин. При недостаточной эффективности — антибиотики глубокого резерва (Циластатин, Имипинем). По жизненным показаниям может назначаться фторхинолон (Ципрофлоксацин).
В терапии сепсиса у детей актуально применение иммунокорригирующих средств — препаратами с доказанной безопасностью и клинической эффективностью. Иммунозаместительная терапия предусматривает введение иммуноглобулинов, интерферона человеческого лейкоцитарного, рекомбинантных интерферонов (Виферон, Неоцитотект, Пентаглобин).
Важными компонентами лечения сепсиса у новорожденных является:
- коррекция дисбактериоза (эубиотики, пребиотики);
- метаболических/гемодинамических и расстройств;
- коррекция гипер/гипо-коагуляции;
- организация рационального (приоритет грудного) вскармливания ребенка;
- частичное парентеральное питание;
- лечение сопутствующих заболеваний.
При беременности
Среди различных инфекционных осложнений распространенность сепсиса в акушерско-гинекологической практике варьирует в пределах 0,2–0,3%. Послеродовой сепсис наиболее часто (в 90% случаев), возникает на фоне эндометрита и послеродовых септических заболеваний, значительно реже — в случаях наличия мастита, раневой инфекции, инфекции мочевых путей, постинъекционного абсцесса и др.
Ведущими факторами риска сепсиса являются: мертворождение, многоплодие, хроническая сердечная/печеночная недостаточности, ВИЧ-инфекция, инфекции генитального тракта/нижних мочевыводящих путей, инфекции дыхательных путей (пневмонии, грипп), внутрибольничные инфекции, осложненное течение родов (длительный безводный промежуток, обусловленный несвоевременным излитием околоплодных вод, задержка продуктов зачатия, пролонгированные роды, хориоамнионит, многократные влагалищные исследования, акушерские операции в родах — кесарево сечение, патологическая кровопотеря, травматизация тканей родовых путей), а также гнойно-септические заболевания в послеродовом периоде: параметрит, аднексит, тромбофлебит, послеродовый эндометрит и др.
Выраженность симптомов зависит от формы клинического течения. Клиническая симптоматика манифестирует, как правило, на второй-третий день после родов признаками общей интоксикации (слабостью, потерей аппетита, тахикардией, одышкой, реже рвотой и диареей), сукровично-гнойными выделениями и температурой до 39-40 °C с большим разбросом суточной температуры и периодическими ознобами. Больные жалуются на боли в животе/молочных железах, могут отмечаться генерализованные высыпания.
При молниеносном развитии акушерского сепсиса симптоматика нарастает в течение суток, а в случаях развития острого сепсиса клиническая картина манифестирует в течение 3-4 дней. При подострой форме симптомы менее выражены, процесс развивается на протяжении 1-2 недель. Хронический сепсис характеризуется вялым течением на протяжении многих месяцев со слабо выраженной симптоматикой (головокружениями, головной болью и сонливостью, субфебрилитетом, повышенным потоотделением, иногда диареей).
Рецидивирующая форма характерна для септикопиемии и протекает с периодами обострений и ремиссии. Ухудшение состояния обусловлено образованием вторичных гнойных метастазов. При отсутствии своевременного и адекватного лечения развивается тяжёлая форма сепсиса с шоковым синдромом с сильно выраженной интоксикацией организма.
В ранней («теплой») фазе акушерского сепсиса отмечается прогрессирующая слабость, головокружение, субфебрильная температура, тахикардия, гиперемированность кожных покровов. Иногда отмечается спутанность сознания, психозы, галлюцинации, возбуждение. Длительность этой стадии варьирует от 5-8 часов до суток.
Поздняя («холодная») фаза характеризуется брадикардией, падением температуры ниже нормы, затруднением дыхания. Возбуждение и беспокойство сменяется адинамией, затемнением сознания. Развивается олигурия, кожа покрывается липким холодным потом и приобретает землистый оттенок, иногда появляется желтуха.
Лечение акушерского сепсиса проводится согласно руководства МЗ N 15-4/10/2-728 и включает санацию первичного очага инфекции с одновременным проведением эмпирической антибактериальной, детоксикационной, инфузионно-трансфузионной, иммуномодулирующей, общеукрепляющей, десенсибилизирующей, симптоматической терапии, направленной на коррекцию нарушений функции жизненно важных органов и гемостаза.
При назначении антибиотиков необходимо учитывать клинические проявления, обсемененность первичного очага инфекции и вероятный вид возбудителя сепсиса. Как правило, антибиотики используются в максимально допустимой терапевтической дозировке.
Диета при сепсисе
Сепсис относится к категории заболеваний с быстро развивающейся трофической недостаточностью, что делает нутриционную поддержку в виде (энтерального/парентерального питания) важнейшим методом в интенсивной терапии заболевания, позволяющего активно противостоять резко нарастающему истощению пациентов. Метод нутриционной поддержки определяется исходным трофологическим статусом, функциональным состоянием ЖКТ и сохранностью глотательной функции.
При развитии септического шока активная алиментация до его разрешения не проводится, выполняются лишь мероприятия по энтеральной поддержке, основными положениями которой являются:
- Предпочтение во всех случаях необходимо отдавать естественному питанию в сочетании с дополнительным приемом перорально биологически ценных сбалансированных питательных смесей (ЭПС), содержащих не менее 6–10 г белка/100 мл и энергии 200 ккал/100 мл и пищевые волокна (Фортикер, Нутридринк компакт протеин, Эншур-2, Суппортан и др.), которые могут назначаться в качестве дополнительного питание к лечебному рациону (по 200 мл 2–3 раз/сут в виде отдельного приема).
- При невозможности питания больного естественным путем, а также в случаях резкого снижения объема алиментации и сохранности пищеварительной функции назначается зондовое питание с предпочтением назогастрального доступа (через нос) введения питательных смесей. При необходимости зондового питания сроком более 4 недель показано наложение стомы. Для зондового питания рекомендуются стандартные полимерные гиперкалорические, готовые к употреблению жидкие питательные смеси: Нутризон Энергия, Нутризон, Нутрикомп Энергия, Фрезубин Энергия, Нутризон Энергия с пищевыми волокнами, Суппортан и др.
- В основе назначения искусственного питания (парентерального/зондового) лежат показания, когда больные по разным причинам не могут питаться в достаточном количестве естественным путем или не могут/не должны/не хотят получать пероральное питание. Парентеральное питание назначается лишь в условиях невозможности использования энтерального доступа, а также невозможности обеспечения достаточной алиментации другими доступными методами.
Профилактика
Профилактика сепсиса в целом включает:
- Устранение/своевременное адекватное лечение очагов гнойной инфекции (ран, ожогов, локальных инфекционно-воспалительных процессов).
- Тщательное соблюдении требований асептики/антисептики при выполнении операций и лечебно-диагностических манипуляций.
- Сокращения времени пребывания пациентов в стационаре и выявление пациентов высокого риска развития сепсиса.
- Предупреждение развития госпитальной инфекции, что достигается регулярными дезинфекционными мероприятиями, мониторингом внутрибольничной флоры в каждом конкретном отделении лечебного учреждения, определением чувствительности микрофлоры к антибиотикам, эффективной политикой применения антибактериальных препаратов.
- Проведение вакцинации против менингококковой, пневмококковой инфекции и др.
Профилактические мероприятия послеродового сепсиса включают:
- Своевременное лечение воспалительных/гнойно-септических заболеваний.
- Борьбу с внебольничными вмешательствами (криминальными абортами, домашними родами, внутриматочными/вагинальными манипуляциями).
- Рациональную превентивную антибиотикотерапию при проведении оперативных вмешательств.
Профилактические мероприятия сепсиса новорожденных включают:
- Своевременное выявление и санацию инфекций мочеполовой сферы беременной, тщательный полноценный гигиенических уход за новорожденным, естественное вскармливание новорожденного.
- Соблюдение противоэпидемических мероприятий в отделениях новорожденных родильных домов.
Последствия сепсиса крови и осложнения
Последствия заражение крови зависят от формы сепсиса, наличия местатических очагов, проводимого лечения и включают нарушения функции сердечно сосудистой и дыхательной системы, почечные осложнения, нарушения в системе свертывания крови, расстройства метаболизма, неврологические осложнения, токсическое поражение ЦНС и другие.
Прогноз
Общая смертность пациентов, у которых развился септический шок, варьирует в пределах 40-50%. Как правило, высокие показатели смертности обусловлены несвоевременностью начала интенсивной терапии (более 6 часов после предположительного диагноза). В большинстве случаев септический шок в сочетании с выраженной полиорганной недостаточностью приводит к необратимым изменениям в организме и смерти.
Список источников
- Козлов В. К. Сепсис: этиология, иммунопатогенез, концепция современной иммунотерапии. СПб: Диалект, 2008. 296 с.
- Володин И.И., Антонов А.Г., Байбарина Е.Н. Сепсис новорожденных и доказательная медицинская практика — новый подход и повышение качества помощи // Педиатрия. 2003. № 5. С. 56-59.
- Савельев В. С., Гельфанд Б. Р. Сепсис: классификация, клинико-диагностическая концепция, лечение. М.: ООО Издательство «Медицинское информационное агентство», 2013. 360 с.
- Руднов В. А., Кулабухов В. В. Сепсис-3: Обновленные ключевые положения, потенциальные проблемы и дальнейшие практические шаги. Вестник анестезиологии и реаниматологии. 2016; 13 (4): 4–11.
- Международное руководство по управлению сепсисом и септическим шоком (Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016)

Автор-составитель: Владимир Конев — врач, медицинский журналист Специальность: Эпидемиология, Гигиена, Инфекционные заболевания подробнее
Образование: Окончил Свердловское медицинское училище (1968 ‑ 1971 гг.) по специальности «Фельдшер». Окончил Донецкий медицинский институт (1975 ‑ 1981 гг.) по специальности «Врач эпидемиолог, гигиенист». Проходил аспирантуру в Центральном НИИ эпидемиологии г. Москва (1986 ‑ 1989 гг.). Ученая степень ‑ кандидат медицинских наук (степень присуждена в 1989 году, защита ‑ Центральный НИИ эпидемиологии г. Москва). Пройдены многочисленные курсы повышения квалификации по эпидемиологии и инфекционным заболеваниям.
Опыт работы: Работа заведующим отделением дезинфекции и стерилизации 1981 ‑ 1992 гг. Работа заведующим отделением особо опасных инфекций 1992 ‑ 2010 гг. Преподавательская деятельность в Мединституте 2010 ‑ 2013 гг.
Комментарии
Интересно почитать. Уже достаточно лет работаю в медицине и конечно же сталкивалась в своей практике с сепсисом и септическим шоком. А недавно коллеги рассказали про ссво критерии калькулятор. Он определяет тяжесть сепсиса и септического шока. Очень удобным мне показался. Вводишь необходимые показатели и получаешь результат
Абсцесс печени
Streptococcus agalactiae 10 в 3 степени
Синдром Титце, симптомы, лечение
Норма МНО при приеме Варфарина
Аноргазмия у женщин
Цена на Иммуноглобулин человеческий нормальный
Болезнь Хаммена Рича
Синдром позиционного сдавления
Похожие болезни
Геморрагический васкулит
Синдром Жильбера
Геморрагический синдром
Болезнь Виллебранда
ВКонтакте
Статьи по теме
Эритематозная гастропатия антрального отдела желудка
Расщепление личности, 10 букв
Грибок на лице, симптомы, фото
Золотистый стафилококк в носу, симптомы
Последние комментарии
Оля: Если бы полиоксидоний не входил в стандарты лечения я бы сказала, что его действие .
Оля: Индинол против дисплазии назначают. А он БАД. Я им лечить папиллома вирусную инфекцию не .
Саша: При хронической усталости меня очень выручил Вазобрал. Подруга мне его посоветовала. Я .
Полина: Уважаемые производители и продавцы Вы понимаете , что Вы творите с ценами .Больные Вас .




Все представленные на сайте материалы предназначены исключительно для образовательных целей и не предназначены для медицинских консультаций, диагностики или лечения. Администрация сайта, редакторы и авторы статей не несут ответственности за любые последствия и убытки, которые могут возникнуть при использовании материалов сайта.
ООО «Медсторона — медицинские технологии» ОГРН 1182375072802
Все права защищены © 2011-2023
Антибиотики нового поколения: за и против

Антибиотики – это вещества биологического или полусинтетического происхождения. Применяются в лечебной практике для борьбы с болезнетворными микробами, вирусами. До появления этих медпрепаратов статус неизлечимых болезней был у брюшного тифа, дизентерии, пневмонии, туберкулеза. Сегодня лечение заболеваний инфекционного характера возможно с применением 1-6 поколения антибиотиков.
На этот момент фармакологическая индустрия выпускает более 2000 разновидностей лекарственных средств подобного типа. Медики описали действие около 600 позиций, а во врачебной практике используются порядка 120-160 препаратов.
Важно! При любом заболевании принимать антибиотики рекомендуется после консультации с врачом. В противном случае может развиться антибиотикорезистентность (снижение чувствительности патогенных микроорганизмов к антибактериальным средствам).
Классификация антибиотиков
Все антибактериальные средства можно разделить на 5 категорий по характеристикам и спектру применения. Рассмотрим эту классификацию подробнее:
- Бактерицидные – активные вещества препаратов полностью уничтожают бактерии, вирусы. После приема таких сильных лекарств вся болезнетворная микрофлора в организме человека погибает.
- Бактериостатические – подавляют рост или распространение вирусов. Таким образом, клетки остаются «живыми», не образуя патогенной флоры.
Спектр действия
Различают антибактериальные средства:
- Широкого диапазона воздействия – их назначают при болезнях инфекционного характера с невыясненной причиной недомогания. Это бактерицидные медпрепараты, поскольку уничтожают всю патогенную флору.
- Узкого диапазона воздействия – уничтожают грамположительные бактерии (энтерококки, листерии). После их приема погибают также грамотрицательные возбудители инфекционных болезней: кишечной палочки, сальмонеллы, протей и т.д. К этой группе относятся также противотуберкулезные, противоопухолевые, противогрибковые средства.

По составу
Антибактериальные препараты делят на 6 групп:
- Пенициллины – первые антимикробные препараты, полученные ещё в 1928 году из биологического вещества (грибы Penicillium). Долго оставались самым популярным медикаментом для лечения инфекционных болезней.
- Цефалоспорины – относятся к группе самых сильных противомикробных средств обширного диапазона применения. Полностью уничтожают патогенную флору, хорошо переносятся человеком.
- Макролиды – это название группы антимикробных средств узкого диапазона. Не уничтожают больную клетку, а только останавливают её рост. В эту категорию входят такие препараты: эритромицин, спирамицин, азитромицин.
- Тетрациклины – хорошие препараты для лечения инфекционных заболеваний дыхательных, а также мочевыводящих путей.
- Фторхинолоны – противомикробные средства обширного диапазона воздействия. Уничтожают полностью патогенные микроорганизмы. В продаже можно встретить медпрепараты 1-2 поколения. Обычно врачи их приписывают для борьбы с синегнойной палочкой.
- Аминогликозиды – противомикробные лекарства с большой областью применения. Популярные лекарства этой группы – стрептомицин (терапия туберкулеза, чумы) и гентамицин – используются как мазь, глазные капли, инъекции при офтальмологических инфекциях.
Поколения препаратов. У передовых антимикробных препаратов насчитывается уже шесть генераций. Например, пенициллин был первым средством природного происхождения, тогда как третья или шестая генерация – это уже улучшенная версия, которая включает в состав сильнейшие ингибиторы. Зависимость прямая: чем новее генерация, тем эффективнее воздействие препаратов на патогенную микрофлору.
По способу приема. Пероральные – принимают через рот. Это различные сиропы, таблетки, растворимые капсулы, суспензии. Парентеральные – вводятся внутривенно или внутримышечно. Они быстрее дают эффект, чем пероральные лекарства. Ректальные препараты вводятся в прямую кишку.
Важно! Принимать антибиотики допускается только после консультации с врачом, иначе разовьется антибиотикорезистентность.

Антибактериальные средства нового поколения
Отличие последних генераций антибиотиков от их ранних версий в более совершенной формуле действующего вещества. Активные компоненты точечно устраняют только патологические реакции в клетке. Например, кишечные антибиотики нового поколения не нарушают микрофлору ЖКТ. При этом они борются с целой «армией» возбудителей инфекций.
Новейшие антибактериальные препараты делятся на пять групп:
- Тетрациклиновая – тетрациклин.
- Аминогликозиды – стрептомицин.
- Пенициллиновый ряд – амоксициллин и другие.
- Амфениколы – хлорамфеникол.
- Карбапенемовая группа – меропенем, имипенем, инваз.
Рассмотрим несколько известных противомикробных средств импортного и российского производства.
Амоксициллин – импортный противомикробный препарат из группы пенициллинов. Используется во врачебной практике для лечения бактериальной инфекции. Эффективен при кишечных инфекциях, гайморите, ангине, болезни Лайма, дизентерии, сепсисе.
Авелокс – медпрепарат последней генерации из группы фторхинолонов. Отличается сильнейшим воздействием на бактериальные и атипичные возбудители. Не вредит почкам и ЖКТ. Используется при острых, хронических заболеваниях.
Цефалоспорины – антибиотики третьего поколения. К этой группе относят Цефтибутен, Цефтриаксон и другие. Используются для лечения пиелонефрита, пневмонии. В целом это безопасные средства с малым количеством побочных действий. Однако их нужно принимать только после консультации с врачом. Медпрепаратов много, а какой именно выбрать – порекомендует специалист.
Дорипрекс – импортный противомикробный препарат синтетического происхождения. Показал хорошие результаты при лечении пневмонии, запущенных интраабдоминальных инфекций, пиелонефритах.
Инваз – антибактериальное средство из группы карбапенемов. Выпускается в ампулах для парентерального способа применения. Показывает быстрый эффект при лечении бактериальных расстройств кожи, мягких тканей, инфекциях мочевыводящих путей, пневмонии, септицемиях.
Аугметин – полусинтетический пенициллин третьей генерации с добавлением усиливающих ингибиторов. Педиатрами признается лучшим комплексным медпрепаратом для лечения детских гайморита, бронхита, тонзиллита и других инфекций дыхательных путей.
Цефамандол – антибактериальное средство российского производства. Относится к группе цефалоспоринов третьего поколения. Используется для лечения кишечных инфекций, возбудителей инфекций половых органов. Как противомикробное средство обширного диапазона воздействия применяется при простудных заболеваниях.

Лучшие антибактериальные препараты широкого диапазона действия
Противомикробные средства новой генерации обычно синтезируют из природного сырья и стабилизируют в лабораториях. Это помогает усилить эффект лекарства на патогенную микрофлору.
Какие препараты самые сильные? Врачи относят к таким антибактериальные средства широкого спектра воздействия. Приведем ниже краткий список препаратов по названиям:
- – относится к группе аминопенициллинов. Действует мягко, используется для лечения инфекционных заболеваний. С осторожностью и только после консультации с врачом препарат можно применять при беременности, а также в периоды кормления грудью. Выпускается в таблетках или в сыпучей форме для перорального приема, а также в порошках для инъекций. – популярный противомикробный препарат для лечения инфекций ЖКТ, мочеполовой системы, болезней дыхательный путей – ангины, бронхита, пневмонии. Воздействует на печень и почки, поэтому его не приписывают пациентам с повышенной чувствительностью к макролидам.
- ЦЕФОПЕРАЗОН – относится к группе цефалоспоринов. Приписывается врачами для лечения инфекций мочевыводящих путей, простатита, кожных расстройств, болезней дыхательных путей. Хороший препарат для восстановления после гинекологических, ортопедических и абдоминальных операций. Выпускается в форме для парентерального приема – инъекции. – тетрациклин последней генерации. Применяется для обширного лечения инфекций ЖКТ, простудных заболеваний, простатита. Действует мягко, не вызывая дисбактериоза. – средство, которое назначают для лечения остеомиелита, сепсиса, стафилококковых инфекций. Оказывает сильнейшее воздействие на патогенные клетки, поэтому имеет длинный ряд побочных эффектов. Среди них – гипотония, слабость, головокружение. Нельзя применять при беременности, а также пациентам с печеночно-почечной недостаточностью. – макролид четвертой генерации. Основное вещество – рокситромицин. Приписывают при урогенитальных инфекциях, болезнях ЖКТ и верхних дыхательных путей. Выпускается в таблетках.
- ЦЕФИКСИМ – по названию это средство из группы цефалоспоринов. Оказывает бактерицидное воздействие на патогенные клетки. Помогает при инфекциях ЖКТ, простатите, также лечит простудные заболевания. Достаточно токсичен, поэтому его нельзя принимать при проблемах с почками или печенью. – последняя группа цефалоспоринов. Медпрепарат показан для лечения гинекологических, урологических, простудных заболеваний. Отлично справляется с воспалительными процессами, подавляет патогенную микрофлору.
Резюме
Мы рассмотрели российские и импортные антибиотики широкого спектра действия, кратко описали классификацию препаратов. Ответим на вопрос: какие антибактериальные средства выбрать?
Важно понимать, противомикробные лекарства для обширного применения обладают токсичностью, поэтому негативно влияют на микрофлору. Кроме того, бактерии мутируют, а значит препараты теряют свою эффективность. Поэтому антибактериальные средства с новейшей структурой будут в приоритете, чем их ранние аналоги.
Самолечение антибиотиками опасно для здоровья. При инфекционном заболевании первым делом нужно обратиться к врачу. Специалист установит причину болезни и назначит эффективные антибактериальные средства. Самолечение «наугад» приводит к развитию антибиотикорезистентности.
Источник https://medaboutme.ru/zdorove/spravochnik/bolezni/sepsis/
Источник https://medside.ru/sepsis-zarazhenie-krovi
Источник https://366.ru/articles/antibiotiki-novogo-pokolenija-za-i-protiv/