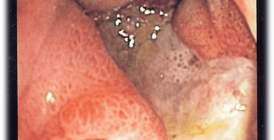
Некротический энтероколит у новорожденного
Некротический энтероколит – неспецифическое воспалительное заболевание неустановленной этиологии с мультифакторным патогенезом, объясняющим развитие НЭК как результат гипоперфузии незрелой слизистой кишечника новорожденного, перенесшего перинатальную гипоксию и, как следствие, изменение кровотока в системе мезентериальных сосудов.
Частота развития НЭК у новорожденных составляет 0,3–3 на 1 000 живорожденных, обратно пропорциональна массе тела и гестационному возрасту новорожденного (чем меньше МТ и ГВ, тем чаще НЭК). У доношенных новорожденных частота НЭК 0,05 на 1 000 живорожденных [4-8]
Соотношение кодов МКБ-10 и МКБ-9
| Коды МКБ-10 | Коды МКБ-9 | ||
| Р77 | Некротический энтероколит новорожденного | 45.30 | Локальное иссечение тонкой кишки |
| 45.41 | Иссечение пораженного участка или ткани толстой кишки | ||
| 48.30 | Локальное иссечение или деструкция пораженного участка или ткани прямой кишки | ||
| 44.41 | Ушивание язвы желудка | ||
| 44.42 | Ушивание язвы двенадцатиперстной кишки | ||
| 43.61 | Резекция желудка | ||
| 43.70 | Субтотальная резекция желудка | ||
| 46.991 | Устранение непроходимости кишечника | ||
Дата разработки/пересмотра протокола: 2016 год.
Пользователи протокола: неонатологи, неонатальные хирурги, детские хирурги.
Категория пациентов: новорожденные.
Шкала уровня доказательности:
Соотношение между степенью убедительности доказательств и видом научных исследований
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или Высококачественное (++) когортных или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с не высоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с не высоким риском систематической ошибки (+), результаты, которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование или мнение экспертов. |

Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
— 800 RUB / 5500 KZT / 27 BYN — 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
Классификация
| Стадия | Общие симптомы | Абдоминальные симптомы | Рентгенологическая картина |
| IА (подозрение на НЭК) | Нестабильность температуры, апноэ, брадикардия, вялость. | Незначительное вздутие живота, рвота, скрытая кровь в стуле | Норма или некоторое вздутие петель кишечника |
| IБ (предполагаемый НЭК) | То-же | То-же + примесь ярко- красной крови в стуле | То-же |
| IIА (определенный НЭК, легкая форма, обратимая стадия) | То-же + незначительный метаболический ацидоз и склонность к тромбоцитопении | То-же + парез кишечника, болезненность при пальпации живота | Расширение петель кишечника, множественные уровни жидкости, пневматоз кишечной стенки |
| IIБ (определенный НЭК, среднетяжелая форма, необратимая стадия) | То-же + метаболический ацидоз и тромбоцитопения | То-же + выраженное вздутие и напряжение живота, с (или без) отеком передней брюшной стенки | То-же с (или без) газом в v.porta, с (или без) асцитом |
| IIIА (прогрессирующий НЭК, тяжелая форма) | То-же + смешанный ацидоз, артериальная гипотензия, брадикардия, повторные апноэ, нейтропения, анурия, коагуляционные нарушения | То-же + симптомы перитонита, гиперемия передней брюшной стенки, кровавый стул, парез кишечника, болезненность при пальпации живота | То-же + всегда газ в v.porta и выраженный асцит |
| IIIБ (прогрессирующий НЭК, перфорация) | То-же + декомпенсированный ДВС синдром | Разлитой перитонит, резкое вздутие живота, кровавый стул, парез кишечника, резкая болезненность при пальпации живота | То-же + пневмоперитонеум |
Диагностика (амбулатория)
ДИАГНОСТИКА НА АМБУЛАТОРНОМ УРОВНЕ
Диагностика на амбулаторном этапе не проводится, так как НЭК диагностируется после рождения у недоношенных детей во время их нахождения в стационаре, и там же проводится их лечение.
Диагностика (стационар)
ДИАГНОСТИКА НА СТАЦИОНАРНОМ УРОВНЕ
Диагностические критерии на стационарном уровне: клиническая картина варьирует в широких пределах, состояние ребенка может ухудшиться внезапно или же клиническая картина некротического энтероколита может нарастать в течение нескольких дней. Необходимо рассмотреть вероятность развития некротического энтероколита при наличии следующих симптомов и признаков:
Неспецифичные:
· непереносимость кормления;
· вздутие живота;
· наличие «скрытой» крови.
Специфичные:
· вздутие живота, сопровождающееся болезненностью;
· отек передней стенки живота;
· отсутствие или снижение перистальтики;
· аспират из желудка с желчью;
· наличие крови в стуле.
Системные:
· нестабильная температура;
· апное;
· стойкий ацидоз, тромбоцитопения, анемия, нейтропения;
· нарушения со стороны кардиоваскулярной системы: артериальная гипотензия, олигоурия, шок, симптом «белого пятна» > 3 сек и т.д.
Жалобы:
· отказ и непереносимость молока;
· вздутие живота;
· наличие крови в стуле;
· отсутствие стула;
· срыгивание с/без примесью желчи.
Анамнез: наличие факторов риска [33-36]:
Гестационный возраст: недоношенность.
· новорожденные < 30 недель: некротический энтероколит часто происходит при отсутствии явных нарушений кровообращений кишечника;
· нарушение кровотока: антенатально диагностированный обратный кровоток в пупочной артерии или отсутствие этого кровотока;
· энтеральное питание, молочными смесями;
· ЗВУР с нулевым или ретроградным диастолическим кровотоком в артерии пуповины/маточной артерии;
· гемолитическая болезнь новорожденных (особенно после заменного переливания крови);
· врожденные пороки сердца;
· интранатальная асфиксия тяжелая и средней тяжести;
· клинико-анамнестические данные, свидетельствующие о повышенном риске развития бактериальной инфекции у плода и новорожденного.
Профилактика развития некротического энтероколита:
· предпочтительно применение грудного нативного молока [26,27];
· снижение риска ишемии кишечной стенки – коррекция гиповолемии, гипоксии и гипотензии;
· контроль за объемом вводимой жидкости;
· адекватное энтеральное питание с учетом гестационного возраста, раннее трофическое питание [28];
· снижение травматизации слизистых оболочек ЖКТ (пероральные гиперосмолярные растворы и лекарственные препараты, активная аспирация содержимого из желудка);
· колонизация кишечника с использованием препаратов – пробиотиков[29];
· антенатальная стероидная профилактика.
Физикальное обследование:
Системные признаки (появляется при последних стадиях некротического энтероколита):
· беспокойное/вялое состояние ребенка;
· летаргия;
· бледность/серость кожных покровов;
· холодные конечности;
· тахикардия/брадикардия;
· артериальная гипотензия;
· симптом «белого пятна» более 3 сек.;
· респираторные нарушения;
· нестабильная температура тела;
· олиго/анурия.
Локальные признаки:
· вздутие и/или болезненность живота;
· наличие отека на передней стенке живота;
· отсутствие/снижение перистальтики;
· гепатоспленомегалия;
· срыгивание с примесью желчи;
· наличие крови в стуле.
Лабораторные исследования:
· общий анализ крови – анемия, нейтропения и тромбоцитопения;
· биохимический анализ крови – гипонатриемия, гипоальбуминемия, высокий уровень СРБ;
· газовый состав крови – смешанный или метаболический ацидоз, гипоксия и гипокарбонатемия, высокий уровень лактата.
Инструментальные исследования:
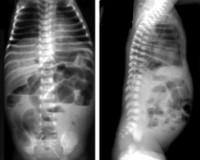
Рентгенологическое исследование брюшной полости:
· дилатация и утолщение стенок кишечника;
· стойкая, ригидная дилатация кишечника;
· наличие уровня воздуха и жидкости;
· пневматоз (интрамуральный газ) кишечника – один из основных рентгенологических признаков некротического энтероколита;
· пневмоперитонеум: особенно в левой половине купола диафрагмы;
· наличие портального газа;
· отсутствие газа в кишечниках.
УЗИ органов брюшной полости:
· некроз кишечника;
· свободная жидкость в брюшной полости;
· газ в портальной системе печени.
Диагностический алгоритм:
Перечень основных диагностических мероприятий
[24]:
· общий анализ крови (лейкоцитоз со сдвигом лейкоцитарной формулы влево, возможна лейкопения либо норма, тромбоцитопения);
· определение газов крови (рН, рСО2, pO2, ВЕ, НСО3);
· определение электролитов (калий, натрий, кальций, хлор);
· биохимический анализ крови (СРБ, глюкоза, общий белок, альбумины, триглецириды, билирубин, креатинин, мочевина);
· коагулограмма – при наличии кровотечении могут быть обнаружены нарушения свертываемости.
· бактериологическое исследование крови на стерильность (выделение чистой культуры);
· определение чувствительности к противомикробным препаратам выделенных культур;
· определение скрытой крови в кале – при подозрении на некротический энтероколит;
· обзорная рентгенография органов брюшной полости в вертикальном положении в первый день каждые 6-8 часов, в последующие дни – по показаниям;
Перечень дополнительных диагностических мероприятий:
· нейросонография;
· определение прокальцитонина;
· ультразвуковая диагностика комплексная (печень, желчный пузырь, поджелудочная железа, селезенка);
· ЭхоКГ;
· коагулограмма (тромбиновое время, АЧТВ, фибриноген) – по показаниям;
· определение группы крови;
определение резус – фактора;
Дифференциальный диагноз
| Диагноз | Обоснование для дифференциальной диагностики | Обследования | Критерии исключения диагноза |
| Мекониальный илеус | Снижения моторики кишечника | · Неонатальный скрининг на муковисцидоз: иммунореактивный трипсин > 40 нг/мл; · Потовый тест: хлориды пота > 60 ммоль/л; · ДНК-тест мутации гена СБТЯ; На R – ОБП: резко расширенные кишечные петли + участки кишечных петель обычного диаметра. В газовых скоплениях в нижних отделах живота видны гранулярные уплотнения. | С первых суток жизни отсутствие или скудное, однократное отхождение плотного мекония. На 2-е сутки появляется рвота, становится неукротимой с примесью желчи, затем «каловая»; характерен вздутый живот, видимая кишечная перистальтика. Возможны осложнения: заворот кишечника, перфорация с развитием мекониевого перитонита. |
| Пороки ЖКТ: Высокая врожденная непроходимость (атрезия, стеноз 12 – перстной кишки) | Снижения моторики желудка и непроходимость тонкого кишечника | R – ОБП в вертикальном положении: два газовых пузыря и два уровня жидкости – в желудке и в расширенном нисходящем отделе 12 – перстной кишки выше места стеноза. На боковых рентгенограммах 2 горизонтальных уровня, расположенных на разной высоте. При полной непроходимости кишечника в нижележащих отделах газ не определяется. | С первых часов жизни нечастая обильная рвота с желчью. Быстрое развитие эксикоза. Вздутие живота в эпигастрии и западение в остальных отделах. Меконий отходит малыми порциями первые 5 — 6 суток, в последующие дни стула нет. |
| Врожденное нарушение фиксации кишечника (синдром Ледда, изолированный заворот среднего отдела кишечника) | Непроходимость кишечного тракта | На обзорной R – ОБП: наличие множества уровней жидкости в верхних отделах, затемнение в нижних отделах живота (симптом «немой зоны») Ирригография при синдроме Ледда: очень высокое стояние слепой кишки, сигмовидная кишка лежит медиально, поперечная ободочная кишка укорочена, ниже обычного положения. | С первых суток жизни ребенок беспокойный, рвота с примесью желчи. Прогрессивно нарастает эксикоз и токсикоз. Стул содержит много слизистых пробок, при синдроме Ледда отсутствие мекониевого стула. Живот равномерно вздут, усиленная перистальтика кишечника. |
| Низкая врожденная частичная кишечная непроходимость (острая форма болезни Гиршпрунга ) | Снижения моторики кишечника в следствии недоношенности или динамической кишечной непроходимости при сепсисе | На обзорной R – ОБП: раздутые и расширенные петли толстой кишки, высокое стояние купола диафрагмы. При ирригографии по ходу толстой кишки видна суженная зона и супрастенотическое расширение вышележащих отделов. На боковых рентгенограммах задержка опорожнения кишечника. | Позднее отхождение мекония на 2-3-й день после рождения, быстро нарастает интоксикация, эксикоз, рвота, прогрессирующее вздутие живота, задержка стула, усиленная кишечная перистальтика. |
Лечение
Препараты (действующие вещества), применяющиеся при лечении
| Ампициллин (Ampicillin) |
| Ванкомицин (Vancomycin) |
| Витамин K (Vitamin K ) |
| Гентамицин (Gentamicin) |
| Гепарин натрия (Heparin sodium) |
| Декстроза (Dextrose) |
| Диазепам (Diazepam) |
| Добутамин (Dobutamine) |
| Допамин (Dopamine) |
| Жировые эмульсии для парентерального питания (Fat emulsions for parenteral nutrition) |
| Калия хлорид (Potassium chloride) |
| Кальция глюконат (Calcium gluconate) |
| Клиндамицин (Clindamycin) |
| Комплекс аминокислот для парентерального питания (Complex of amino acids for parenteral nutrition) |
| Кофеин (Caffeine) |
| Магния сульфат (Magnesium sulfate) |
| Метронидазол (Metronidazole) |
| Морфин (Morphine) |
| Натрия хлорид (Sodium chloride) |
| Норэпинефрин (Norepinephrine) |
| Тримеперидин (Trimeperidine) |
| Фентанил (Fentanyl) |
| Флуконазол (Fluconazole) |
| Эпинефрин (Epinephrine) |
Группы препаратов согласно АТХ, применяющиеся при лечении
| (A11) Витамины |
Лечение (амбулатория)
ЛЕЧЕНИЕ НА АМБУЛАТОРНОМ УРОВНЕ
Лечение на амбулаторном этапе не проводится, так как НЭК диагностируется после рождения у недоношенных детей во время их нахождения в стационаре, и там же проводится их лечение.
Лечение (стационар)
ЛЕЧЕНИЕ НА СТАЦИОНАРНОМ УРОВНЕ
Тактика лечения [32–34]: Тактика лечения некротического энтероколита зависит от стадии заболевания и степени выраженности симптомов, она складывается из консервативного и хирургического этапов.
При I, II стадиях некротического энтероколита показано консервативное лечение:
− исключить любую энтеральную нагрузку;
− дренирование желудка;
− инфузионная терапия и парентеральное питание из расчета физиологической потребности ребенка по весу и сроку гестации;
− коррекция объема инфузионных растворов в случае увеличения патологических потерь по желудочному зонду и со стулом;
− антикоагулянтная терапия (профилактика тромбообразования) проводится под контролем результатов ТЭГ;
− антибактериальная терапия по индивидуальным показаниям.
При IIIА стадии в зависимости от результата проведенного консервативного лечения рассматривается необходимость хирургического вмешательства.
При IIIВ стадии – хирургическое вмешательство.
Немедикаментозное лечение
Соблюдение строгого лечебно-охранительного режима:
При подозрении на НЭК немедленно:
− прекратить энтеральное кормление;
− установить назогастральный зонд (F6-10) для обеспечения свободного оттока содержимого желудка – декомпрессия кишечника;
− удалить пупочный венозный и артериальный катетер;
− термоконтроль, профилактика боли, излишнего психомоторного возбуждения, не допускать шума, громких разговоров, яркого света в палате и др.
Респираторная терапия
− поддержание оптимальной оксигенации рО2 (при дотации кислорода – SpO2 необходимо поддерживать в пределах 90-95%);
− поддержание оптимальной вентиляции (рСО2);
Медикаментозное лечение:
Инфузионная терапия и поддержание гемодинамики [25]:
− у недоношенных новорожденных начинать внутривенное введение жидкости по 70-80 мл/кг в день с поддержанием в инкубаторе повышенной влажности (60-80%) для снижения неощутимых потерь жидкости и развития гиповолемии;
− у недоношенных объем инфузии и электролитов должен рассчитываться индивидуально, допуская 2,4-4% потери массы тела в день (15% в общем) в первые пять дней;
− прием натрия должен быть ограничен в первые несколько дней жизни и начать после начала диуреза с внимательным мониторингом баланса жидкости, уровней электролитов и массы тела;
− объем инфузионной терапии определяется признаками гиповолемии и сниженного сердечного выброса: снижение артериального давления, симптом белого пятна (более 3-х секунд), холодные конечности, тахикардия/брадикардия, олигоурия, нарастание ацидоза и гипернатриемия;
− наличие отеков не является противопоказанием к ограничению объема инфузии, так как они обусловлены повышенной проницаемостью сосудов, потери жидкости в третье пространство и в ЖКТ, вследствие чего ОЦК может оставаться сниженным;
− полное парентеральное питание (TPN) следует начинать с первого дня, во избежание замедления роста, и быстро увеличивать объем, по мере переносимости (см. приложение 1).
С целью поддержания гемодинамики назначаются кардиотонические препараты: дофамин, добутамин (дозы и кратность препаратов см. в перечне медикаментозное лечение). В случае неэффективности традиционного лечения артериальной гипотензии, может также использоваться гидрокортизон.
При снижении уровня электролитов в сыворотке крови внутривенно вводится натрий 1-2 мэкв/кг/сутки, калий 1-3 ммоль/кг/сутки, кальций 2 ммоль/кг/сутки.
Антибактериальная терапия [24].
Следует начинать с антибиотиков активных в отношении как грамотрицательных, так и грамположительных бактерий (группы пенициллинового ряда, амногликозиды, цефалоспорины, гликопептиды) (согласно клинического протокола диагностики и лечения «Бактериальный сепсис новорожденных»), а также, назначить антибиотик, активный в отношении анаэробов (например, линкозамиды или противопротозойные препараты) новорожденным старше 1 недели. При появлении или усиления признаков НЭК на фоне антибактериальной терапии 1-го ряда, а также на фоне установленного центрального катетера, антибактериальная терапия усиливается назначением антибиотиков дополнительно: цефалоспорины и гликопептиды.
Продолжительность антибактериальной терапии зависит от состояния ребенка и результатов обследований:
· стадия I А – антибактериальная терапия продолжается в течении 3 – х суток, затем необходимо оценить состояние ребенка и результаты обследований;
· стадия IВ и IIА – антибактериальная терапия продолжается в течении 10 суток;
· стадия III – антибактериальная терапия продолжается более 10 суток и зависит от состояния ребенка.
С целью снижения риска инвазивной грибковой инфекции у новорожденных детей с массой тела при рождении менее 1000 г или с гестационным возрастом ≤ 27 недель рекомендовано противогрибковая профилактика флуконазолом или нистатином.
Коррекция гемостаза:
− при ДВС – синдроме проводится переливание свежезамороженной плазмы 10-15 мл/кг;
− при тромбоцитопении < 30×10 /л назначается тромбоцитарная масса 10-15 мл/кг;
− при коагулопатии, связанной с дефицитом витамина К1: введение витамина К1 внутримышечно недоношенным детям в дозе 0,5 мг, доношенным – 1 мг.
Лечение болевого синдрома проводится наркотическими анальгетиками:
Контроль болевого синдрома проводится по шкале оценки боли (таблица – №3)
Адаптированная шкала оценки боли у новорождённого N—PASS
| Критерии оценки | Норма | Боль/возбуждение | |
| Плач, раздражительность | 0 Плачет не много, спокойный | 1 Иногда раздражительный, плачет, но можно успокоить | 2 Громко плачет или плачет тихо, но постоянно |
| Поведение | 0 Соответствует гестационному возрасту | 1 Спит не спокойно, но можно успокоить | 2 Постоянно бодрствует или минимально возбуждён (без седации) |
| Выражение лица | 0 Расслаблен | 1 Иногда болезненное | 2 Постоянно болезненное |
| Мышечный тонус | 0 Расслаблены кисти и стопы, тонус нормальный | 1 Иногда пальцы сжаты или их держит веером, тело напряжено | 2 Пальцы постоянно сжаты или веером, тело напряжено |
| Жизненно важные функции (ЧСС, ЧД, АД, SрO2) | 0 На уровне базовых значений или соответствуют норме | 1 >10-20%, SрO2 до76-85%, во время стимуляции восстанавливаются быстро | 2 >20%, SрO2 |
Слабая боль – 0 – 3 балла, обезболивание нефармакологическое;
Средняя боль – 4 – 6 балла, обезболивание нефармакологическое + фармакологическое;
Сильная боль – 7 – 10 балла, обезболивание фармакологическое.
Перечень основных лекарственных средств:
Перечень дополнительных лекарственных средств:
| Препараты | Разовая доза | Кратность введения | УД |
| Препараты для парентерального питания | |||
| Аминокислоты | раствор для инфузий 3 – 4 г/кг/сут | Постоянно, до полного перехода на энтеральное кормление | D [24,25] |
| Жировые эмульсии | эмульсия для инфузии 3 – 4 г/кг/сут | D [24,25] | |
| Водорастворимые и жирорастворимые витамины: | 1 мл/кг 4 мл/кг | D [24,25, 30,31] | |
| Декстроза 10%, 40%, | раствор для инъекций 6–12 мг/кг/мин | D [24,25, 30,31] | |
| Раствор кальций глюконата 10% | раствор для инъекций 1–2 ммоль/кг | D [24,25, 30,31] | |
| Раствор натрий хлорида 0,9%, 5%. | зависит от уровня Na в крови | D [24,25, 30,31] | |
| Раствор магний сульфата 25%. | 0,2 мл/кг/сут | D [24,25, 30,31] | |
| Раствор калий хлорида 7,5% | 1 ммоль/кг | D [24,25, 30,31] | |
| Гепарин натрия | раствор для инъекций, 1 Ед. гепарина на 1 мл раствора для парентерального питания | D [24,25, 30,31] | |
| Седативные препараты | |||
| Диазепам | раствор для инъекций 0,5% в/в болюсно по 0,1 – 0,25 мг/кг | каждые 6 часов | D [24,25, 30,31] |
| Наркотические анальгетики | |||
| Тримеперидин | раствор для инъекций 1% – в/в болюсно 0,05 – 0,2 мг/кг, в/в капельно 0,1 –0,2мг/кг/час | D [24,25, 30,31] | |
| Фентанил | раствор для в/в и в/м введения 0,005% – в/в болюсно до 5–10 мкг/кг, в/в капельно 1 –5мкг/кг/ч; | D [24,25, 30,31] | |
| Морфина гидрохлорид | раствор для инъекций 1%* – в/в болюсно 0,05–0,2 мг/кг, в/в капельно 0,1–0,15 мг/кг/ч. | D [24,25, 30,31] | |
| Дыхательный аналептик | |||
| Кофеин цитрат | раствор для инъекций, стартовая доза 20 мг/кг/сут | Поддерживающая доза 5 мг/кг/сут | |
| Профилактика и лечение геморрагической болезни новорожденных | |||
| Витамин К | Раствор для инъекций 1 мг/кг | Однократно в динамике в зависимости от наличия показаний | D [24,25] |
Хирургическое вмешательство, с указанием показаний для оперативного вмешательства:
· дренирование брюшной полости;
· локальная резекция измененного участка кишки с созданием двойной энтеро/колостомы.
Выбор вида операции зависит от состояния ребенка и массы тела:
· если масса тела ребенка < 1500 гр. или состояние ребенка не стабильное – необходимо рассмотреть временное использование перитонеального дренажа. При выполнении этой процедуры в пределах отделения реанимации и интенсивной терапии новорожденных, необходимо обеспечить адекватное обезболивание. Дальнейшая тактика введения зависит от ответа на постановку дренажа;
· если масса тела ребенка > 1500 гр. или состояние ребенка стабильное – необходимо рассмотреть проведения лапаротомии;
Показания к хирургическому лечению:
· прогрессивное ухудшение общего состояния;
· наличие опухолевидного образования в брюшной полости;
· воспалительные изменения брюшной стенки;
· лабораторные показатели: остро возникшая тромбоцитопения, нарушения коагулограмме, тяжелая гипонатриемия, стойкий метаболический ацидоз;
· рентгенологические признаки в виде статичной петли кишки, асцит, газ в портальной вене, пневмоперитонеум;
NB! Пневомоперитонеум или наличие доказательств перфорации кишечника – является абсолютным показанием для оперативного лечения.
Перед проведением операции следует оценить свертывающую систему крови и восполнить объем циркулирующей крови.
Другие виды лечения: нет.
Показания для консультации специалистов:
· консультация узких специалистов – по показаниям.
Показания для перевода в отделение интенсивной терапии и реанимации:
· при наличии признаков кардио – респираторной недостаточности;
· потребности в высоких концентрациях кислорода, аппаратной ИВЛ, кардиотонических препаратах.
Индикаторы эффективности лечения и безопасности методов диагностики и лечения, описанных в протоколе:
· усвоение энтерального питания;
· активное сосание;
· нормальная температура тела;
· прибавка массы тела (15-20 г/кг в сутки);
· мягкий живот, безболезненный при пальпации;
· стул без патологических примесей и изменений.
Дальнейшее ведение:
Через 21 – 28 дней проводится рентгенологическое обследование отключенных отделов кишечника. При хорошей их проходимости все стомы закрывают одновременно. Если проходимость в каком–либо отделе нарушена (обычно в результате рубцовых изменений), этот отдел оставляют отключенным, но во время операции проводят пластику зоны рубцового сужения кишки или экономную резекцию измененного участка с наложением анастомоза. После повторного рентгенологического обследования через 14 – 16 дней после операции этот отдел кишки «включают» в пищеварение – закрывают стому.
На амбулаторном этапе
Приблизительный план обследования недоношенных детей после выписки из стационара (по рекомендации ФГБУ НЦ АГиП им. В.И.Кулакова г. Москва, Россия)
| Недоношенные дети с очень низкой (1000-1500 гр) и экстремально низкой (менее 1000 гр) массой тела при рождении с НЭК. Кратность обследования в течение 1 года жизни | |
| Педиатр | 12 р/год (ежемесячно) |
| Гастроэнтеролог детский | 6 р/ год |
| Невролог | 6 р/год |
| Хирург | 12 р/год (ежемесячно) |
| Реабилитолог | 1 раз |
| ОАК | 4р/год |
| ОАМ | по назначению педиатра |
| НСГ + доплер | 2 р/год |
| УЗИ брюшной полости+ доплер, | 3 р/год |
| УЗИ почек + доплер | 3 р/год |
| УЗИ сердца + доплер | 2 р/год (+ по показаниям) |
| ЭЭГ | 2 р/год (+по показаниям) |
| Биохимический анализ крови | по назначению специалистов |
| Гормональный профиль | по назначению эндокринолога/педиатра |
| кал на капрограмму | 2 раза в год |
Медицинская реабилитация
Проводится новорожденным, выжившим с тяжелой формой НЭК.
· реабилитационное лечение детей, перенесших НЭК – очень сложный и трудоемкий процесс, который не ограничивается ликвидацией проблем, связанных с поражением кишечника, и включает мероприятия, направленные на нормализацию всех функций организма, и обеспечение ребенку приемлемого качества жизни, поскольку почти все пациенты с НЭК имеют еще и целый комплекс других видов патологии, прежде всего, о неврологических нарушениях и ретролентальной фиброплазии, бронхо-легочной дисплпзии характерных для недоношенных детей. Поэтому пациенты с НЭК должны регулярно осматриваться неврологом, окулистом, пульмонологом. Пациенты с кишечной стомой у детского хирурга.
· введение прикорма детям, перенесшим НЭК, так же должно учитывать степень незрелости и сопутствующие состояния. Пищевые добавки (соки, желток) и прикормы (каши, овощное пюре) вводят: недоношенным массой >2кг – на 1–2 недели раньше, а при массе
Госпитализация
Показания для плановой госпитализации: нет.
Показания для экстренной госпитализации: в случае выявления больного ребенка с НЭК 1 – 2 степени в родовспомогательной организации 1–го или 2–го уровня – обеспечить экстренный перевод в родовспомогательную организацию 3-го уровня, при 3 – 4 степени в хирургическое отделение (неонатальные хирургические коики) детских медицинских организации.
Информация
Источники и литература
- Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗСР РК, 2016
- 1) Stoll BJ. Epidemiology of necrotising enterocolitis. Clin Perinatol 1994;21: 205-218; 2) Kosloske AM. Epidemiology of necrotising enterocolitis. Acta Paediatr Suppl 1994; 396: 2-7; 3) Reber KM, Nankervis CA, Nowicki PT. Newborn intestinal circulation. Physiology and pathophysiology. Clinics Perinatol 2002; 29(1): 23-89; 4) Beeby PJ, Jeffery H. Risk factors for necrotising enterocolitis: the influence of gestational age. Arch Dis Child 1992; 67: 432-5; 5) Snyder CL, Gittes GK, Murphy JP, Sharp RJ, Ashcraft KW, Amoury RA. Survival after necrotizing enterocolitis in infants weighing less than 1,000g. 25 years’ experience at a single institution. J Pediatr Surg 1997; 32(3): 434-7; 6) Bernstein IM, Horbar JD, Badger GJ, Ohlsson A, Golan A. Morbidity and mortality among very low birth weight neonates with intrauterine growth restriction. The Vermont Oxford; 7) Network. Am J Obstet Gynecol 2000; 182(1): 198-206. Bolisetty S, Lui K, Oei J, Wojtulewicz J. A regional study of underlying congenital diseases in term neonates with necrotizing enterocolitis. Acta Paediatr. 2000; 89: 1226–30. Ng S. Necrotizing enterocolitis in the full-term neonate. J Paediatr Child Health 2001; 37: 1–4;
 Walsh MC, Kliegman RM. Necrotizing enterocolitis: treatment based on staging criteria. Pediatric Clinics of North America 1986; 33:179-201; 9) McElhinney DB, Hedrick HL, Bush DM, Periera GR, Stafford PW, Gaynor WJ, Spray TL, Wernovsky G. Necrotising Enterocolitis in neonates with congenital heart disease: risk factors and outcomes Pediatrics 2000; 106(5): 1080-1087; 10) Malcolm G, Ellwood D, Devondale K, Beilby R, Henderson-Smart. Absent or reversed end diastolic flow velocity in the umbilical artery and necrotising enterocolitis: a case control study. Arch Dis Child 1991; 66: 805-7; 11) Bhatt AB, Tank PD, Barmade KB, Damania KR. Abnormal Doppler flow velocimetry in the growth restricted fetus as a predictor of necrotising enterocolitis. J Postgrad Med 2002; 48(3): 182-5; 12) Osborn DA, Evans N, Kluckow M. Hemodynamic and antecedent risk factors of early and late periventricular/intraventricular hemorrhage in premature infants. Pediatrics 2003;112(1.1): 33-9; 13) Lucas A, Cole TJ Breast milk and necrotising enterocolitis Lancet 1990; 336: 1519-23; 14) Shandler RJ, Shulman RJ, Lau C. Feeding strategies for premature infants: randomized trial of gastrointestinal priming and tube feeding method. Pediatrics 1999B; 103: 293-297; 15) Shandler RJ, Shulman RJ, Lau C. Feeding strategies for premature infants: beneficial outcomes of feeding fortified human milk versus preterm formula. Pediatrics 1999F; 103: 1150- 1157; 16) Chan KL, Saing H, Yung RWH, Yeung YP, Tsoi NS. A study of pre-antibiotic bacteriology in 125 patients with necrotising enterocolitis. Acta Paediatr Suppl 1994; 396: 45-8; 17) Faix RG, Polley TZ, Grasela TH. A randomized, controlled trial of parenteral clindamycin in neonatal necrotizing enterocolitis. J Pediatr. 1988; 112: 271-7; 18) Barrington KJ. Umbilical artery catheters in the newborn: effects of position of the catheter tip (Cochrane Review). In: The Cochrane Library, Issue 2, 2002. Oxford: Update Software; 19) Harding JE. Pang J. Knight DB. Liggins GC. Do antenatal corticosteroids help in the setting of preterm rupture of membranes? American Journal of Obstetrics & Gynecology. 2001; 184(2): 131-9; 20) Black VD, Rumack CM, Lubchenko LO, Koops BL. Gastrointestinal injury in polycythaemic term infants, Pediatrics 1985; 76: 225-231; 21) Caplan MS, Hedlund E, Adler L, Lickerman M, Hsueh W. The platelet-activating factor receptor antagonist WEB 2170 prevents neonatal necrotising enterocolitis in rats. J Pediatr Gastroenterol. Nutr 1997; 24: 296-301; 22) Ford H, Watkins S, Reblock K, Row M. The role of inflammatory cytokines and nitric oxide in pathogenesis of necrotising enterocolitis. J Pediatr Surg 2001; 36: 799-803. 23) Shin CE, Falcone RA Jr, Stuart L, Erwin CR, Warner BW. Diminished epidermal growth factor levels in infants with necrotizing enterocolitis. J Pediatr Surg 2000; 35: 173-6; 24) Dr R Thomas (SpR Paeds), Miss S Singh (Paed Surg Staff), Pam Duffin (Practice Development Nurse, Neonatal Unit), (NNUH) Grade). Revised by – Mr Ashish Minocha, Consultant Paediatric & Neonatal Surgeon, (NNUH) Joint Trust Guidelines for the Management of Necrotising Enterocolitis in Neonates & Infants, 27/05/2015; 25) European Consensus Guidelines on the Management of Neonatal Respiratory Distress Syndrome in Preterm Infants – 2013 Update David G. Sweet a Virgilio Carnielli c Gorm Greisen d Mikko Hallman e Eren Ozek f Richard Plavka g Ola D. Saugstad h Umberto Simeoni i Christian P. Speer j Maximo Vento k Henry L. Halliday 2011. 26) Sullivan S, Schanler RJ, Kim JH et al. An exclusively human milk-based diet is associated with a lower rate of necrotizing enterocolitis than a diet of human milk and bovine milk-based products. J Pediatr. 2010;156(4):562–567. 27) Schurr P, Perkins EM. The relationship between feeding and necrotizing enterocolitis in very low birth weight infants. Neonatal Netw 2008; 27:397-407. 28) Ramani M, Ambalavanan N. Feeding practices and necrotizing enterocolitis. Clin Perinatol 2013; 40:1-10. 29) Awad H, Mokhtar H, Imam SS et al. Comparison between killed and living probiotic usage versus placebo for the prevention of necrotizing enterocolitis and sepsis in neonates. Pak J Biol Sci 2010; 13:253-262. 30) Thompson AM, Bizzarro MJ.. Necrotizing enterocolitis in newborns: pathogenesis, prevention and management. Drugs. 2008;68(9):1227-38. 31) Al-Sabbagh A, Moss S, Subhedar N. Neonatal necrotising enterocolitis and perinatal exposure to co-amoxyclav. Arch Dis Child Fetal Neonatal Ed. 2004 Mar; 89(2): F187 32) Gastroenterology and nutrition/ed.by Josef Neu: Neonatology Questions and Controversies. Elsevier Saunders. 2008, 281-291. 33) Gastroenterology and nutrition/ed.by Josef Neu: Neonatology Questions and Controversies. Elsevier Saunders. 2012, 217-225. 34) Neonatology: A Practical Approach to Neonatal Diseases/ ed. by G.Buonocore, R.Bracci, M.Weindling – Springer-Verlag Italia. – 2012, 1348 p. 35) Neonatology: A Practical Approach to Neonatal Diseases/ ed. by G.Buonocore, R.Bracci, M.Weindling – Springer-Verlag Italia. – 2012, 1348 p. 36) Wendy H. Y, Amuchou Singh Soraisham, Vibhuti S. S et al. Incidence and timing of presentation of necrotizing enterocolitis in preterm infants. Pediatrics 2012; 129:298-304.
Walsh MC, Kliegman RM. Necrotizing enterocolitis: treatment based on staging criteria. Pediatric Clinics of North America 1986; 33:179-201; 9) McElhinney DB, Hedrick HL, Bush DM, Periera GR, Stafford PW, Gaynor WJ, Spray TL, Wernovsky G. Necrotising Enterocolitis in neonates with congenital heart disease: risk factors and outcomes Pediatrics 2000; 106(5): 1080-1087; 10) Malcolm G, Ellwood D, Devondale K, Beilby R, Henderson-Smart. Absent or reversed end diastolic flow velocity in the umbilical artery and necrotising enterocolitis: a case control study. Arch Dis Child 1991; 66: 805-7; 11) Bhatt AB, Tank PD, Barmade KB, Damania KR. Abnormal Doppler flow velocimetry in the growth restricted fetus as a predictor of necrotising enterocolitis. J Postgrad Med 2002; 48(3): 182-5; 12) Osborn DA, Evans N, Kluckow M. Hemodynamic and antecedent risk factors of early and late periventricular/intraventricular hemorrhage in premature infants. Pediatrics 2003;112(1.1): 33-9; 13) Lucas A, Cole TJ Breast milk and necrotising enterocolitis Lancet 1990; 336: 1519-23; 14) Shandler RJ, Shulman RJ, Lau C. Feeding strategies for premature infants: randomized trial of gastrointestinal priming and tube feeding method. Pediatrics 1999B; 103: 293-297; 15) Shandler RJ, Shulman RJ, Lau C. Feeding strategies for premature infants: beneficial outcomes of feeding fortified human milk versus preterm formula. Pediatrics 1999F; 103: 1150- 1157; 16) Chan KL, Saing H, Yung RWH, Yeung YP, Tsoi NS. A study of pre-antibiotic bacteriology in 125 patients with necrotising enterocolitis. Acta Paediatr Suppl 1994; 396: 45-8; 17) Faix RG, Polley TZ, Grasela TH. A randomized, controlled trial of parenteral clindamycin in neonatal necrotizing enterocolitis. J Pediatr. 1988; 112: 271-7; 18) Barrington KJ. Umbilical artery catheters in the newborn: effects of position of the catheter tip (Cochrane Review). In: The Cochrane Library, Issue 2, 2002. Oxford: Update Software; 19) Harding JE. Pang J. Knight DB. Liggins GC. Do antenatal corticosteroids help in the setting of preterm rupture of membranes? American Journal of Obstetrics & Gynecology. 2001; 184(2): 131-9; 20) Black VD, Rumack CM, Lubchenko LO, Koops BL. Gastrointestinal injury in polycythaemic term infants, Pediatrics 1985; 76: 225-231; 21) Caplan MS, Hedlund E, Adler L, Lickerman M, Hsueh W. The platelet-activating factor receptor antagonist WEB 2170 prevents neonatal necrotising enterocolitis in rats. J Pediatr Gastroenterol. Nutr 1997; 24: 296-301; 22) Ford H, Watkins S, Reblock K, Row M. The role of inflammatory cytokines and nitric oxide in pathogenesis of necrotising enterocolitis. J Pediatr Surg 2001; 36: 799-803. 23) Shin CE, Falcone RA Jr, Stuart L, Erwin CR, Warner BW. Diminished epidermal growth factor levels in infants with necrotizing enterocolitis. J Pediatr Surg 2000; 35: 173-6; 24) Dr R Thomas (SpR Paeds), Miss S Singh (Paed Surg Staff), Pam Duffin (Practice Development Nurse, Neonatal Unit), (NNUH) Grade). Revised by – Mr Ashish Minocha, Consultant Paediatric & Neonatal Surgeon, (NNUH) Joint Trust Guidelines for the Management of Necrotising Enterocolitis in Neonates & Infants, 27/05/2015; 25) European Consensus Guidelines on the Management of Neonatal Respiratory Distress Syndrome in Preterm Infants – 2013 Update David G. Sweet a Virgilio Carnielli c Gorm Greisen d Mikko Hallman e Eren Ozek f Richard Plavka g Ola D. Saugstad h Umberto Simeoni i Christian P. Speer j Maximo Vento k Henry L. Halliday 2011. 26) Sullivan S, Schanler RJ, Kim JH et al. An exclusively human milk-based diet is associated with a lower rate of necrotizing enterocolitis than a diet of human milk and bovine milk-based products. J Pediatr. 2010;156(4):562–567. 27) Schurr P, Perkins EM. The relationship between feeding and necrotizing enterocolitis in very low birth weight infants. Neonatal Netw 2008; 27:397-407. 28) Ramani M, Ambalavanan N. Feeding practices and necrotizing enterocolitis. Clin Perinatol 2013; 40:1-10. 29) Awad H, Mokhtar H, Imam SS et al. Comparison between killed and living probiotic usage versus placebo for the prevention of necrotizing enterocolitis and sepsis in neonates. Pak J Biol Sci 2010; 13:253-262. 30) Thompson AM, Bizzarro MJ.. Necrotizing enterocolitis in newborns: pathogenesis, prevention and management. Drugs. 2008;68(9):1227-38. 31) Al-Sabbagh A, Moss S, Subhedar N. Neonatal necrotising enterocolitis and perinatal exposure to co-amoxyclav. Arch Dis Child Fetal Neonatal Ed. 2004 Mar; 89(2): F187 32) Gastroenterology and nutrition/ed.by Josef Neu: Neonatology Questions and Controversies. Elsevier Saunders. 2008, 281-291. 33) Gastroenterology and nutrition/ed.by Josef Neu: Neonatology Questions and Controversies. Elsevier Saunders. 2012, 217-225. 34) Neonatology: A Practical Approach to Neonatal Diseases/ ed. by G.Buonocore, R.Bracci, M.Weindling – Springer-Verlag Italia. – 2012, 1348 p. 35) Neonatology: A Practical Approach to Neonatal Diseases/ ed. by G.Buonocore, R.Bracci, M.Weindling – Springer-Verlag Italia. – 2012, 1348 p. 36) Wendy H. Y, Amuchou Singh Soraisham, Vibhuti S. S et al. Incidence and timing of presentation of necrotizing enterocolitis in preterm infants. Pediatrics 2012; 129:298-304.
Информация
СОКРАЩЕНИЯ, ИСПОЛЬЗУЕМЫЕ В ПРОТОКОЛЕ
ЗВУР задержка внутриутробного развития ИВЛ искусственная вентиляция легких НЭК некротизирующий энтероколит ППП полное парентеральное питание ТЭГ тромбоэластограмма УД уровень доказательности ЧД частота дыхания ЭхоКГ эхокардиография FiO2 fraction of inspired oxygen – фракция вдыхаемого кислорода NB обратить внимание PaCO2 partial pressure of carbon dioxide in arterial blood – парциальное давление диоксида углерода в артериальной крови PaO2 partial pressure of oxygen in arterial blood — парциальное давление кислорода в артериальной крови SpO2 the saturation level of oxygen in hemoglobin – насыщение гемоглобина кислородом в артериальной крови, определенный методом пульсоксиметрии TPN total intravenous nutrition Список разработчиков протокола с указанием квалификационных данных:
1) Чувакова Тамара Курмангалиевна – доктор медицинских наук, профессор, врач высшей категории, ведущий научный сотрудник ФКФ «University Medical Center» АО «Национальный Научный центр материнства и детства».
2) Карин Бектурган Тынымбаевич – главный внештатный неонатолог МЗ и СР РК, врач неонатолог старший ординатор сотрудник ФКФ «University Medical Center» АО «Национальный Научный центр материнства и детства».
3) Ерекешов Асылжан Абубакирович – кандидат медицинских наук, ассоциированный профессор, главный внештатный неонатальный хирург МЗ СР РК заведующий отделением хирургии новорожденных ГКП на ПХВ «Перинатальный центр №1» г. Астаны.
4) Тулеутаева Райхан Есенжановна – кандидат медицинских наук, заведующая кафедрой фармакологии и доказательной медицины РГП на ПХВ ГМУ. г Семей, член «Ассоциации врачей терапевтического профиля».Указание на отсутствие конфликта интересов: нет.
Список рецензентов:
Аскаров Мейрамбек Аскарович – доктор медицинских наук, профессор, заведующий кафедрой детской хирургии РГП на ПХВ «КГМУ».Указание условий пересмотра протокола: Пересмотр протокола через 3 года после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.
Протокол
полного парэнтерального питания (TPN).· TPN начинают детям рожденным с m < 1500 г или новорожденным, которые не могут получить энтеральное питание, обеспечивающее им 80-90 ккал/кг.сут. к концу 1 недели жизни;
· TPN необходимо назначать и в ранние сроки после хирургического лечения (3-5сутки);
· для назначения TPN необходимо добиться полной стабилизации состояния больного (коррекция метаболических нарушений и КОС, стабилизация гемодинамики, отмена планового наркотического обезболивания);
· основной принцип TPN – сбалансированность всех компонентов (белков, жиров, углеводов, микроэлементов, витаминов);
· глюкоза назначается с 10 г/кг/сут. и, увеличивая ежедневную дозу на 2г/кг/сут., доводят ее до 20г/кг/сут. к 6 дню TPN, что обеспечивает ребенку 80 ккал/кг/сут.Для оценки степени усвоения глюкозы – дважды в сутки определяется ее уровень в крови. В случае повышения уровня сахара либо вводится инсулин в дозе 0,25-0,5 ед/кг/сут., либо снижается концентрация раствора;
· аминокислоты – наиболее адекватным препаратом для проведения TPN Оптимальной начальной дозой аминокислот является 0,5-1,5 г/кг/сут., к 4 дню она увеличивается до 3 г/кг/сут. и сохраняется на этом уровне в течение всего периода TPN. Оценкой качества усвоения аминокислот является ежедневное определение уровня остаточного азота, общего белка, КОС, мочевины. Соотношение между белковыми и небелковыми калориями должно быть не менее 101, поскольку при нарушении этого баланса аминокислоты не используются для синтеза белка, а утилизируются организмом в процессе глюконеогенеза с образованием мочевины;
· при проведении ППП (TPN) необходимо предусмотреть раннее введение белков, начиная с 3,5 г/кг/день и жиров c 3,0 г/кг/день для поддержания должного количества калорий под контролем биохимических показателей. Такой подход улучшает выживаемость новорожденных;
· липиды – не следует назначать в первую неделю жизни при синдроме дыхательных расстройств или при активном инфекционном процессе. До начала введения липидов абсолютно необходимо определить уровень трансаминазы, билирубина и триглицеридов. Скорость инфузии липидов не должна превышать 1,6 мл/кг /час. Стартовой дозой липидов является 0,5 г/кг/сут., максимальная -3г/кг/сут., что обеспечивает ребенку 27 Ккал/кг/сут. Необходимое условие для эффективного использования липидов – ежедневное определение АЛТ, АСТ, триглицеридов. Уровень триглицеридов не должен превышать 3-3,5 ммоль/л (N – 1,7 ммоль/л), так как при высоком содержании жирных кислот в плазме значительно повышается их поглощение печенью и окисление в процессе синтеза триглицеридов, что приводит к кетоацидозу. Повышение уровня триглициридов более 150 мгдл является маркером развивающегося кетоацидоза. Кроме того, при недостатке фосфатов и холина нейтральный жир откладывается в печени, вызывая жировую инфильтрацию, а в наиболее тяжелых случаях — жировую дистрофию;
· витамины, электролиты, микроэлементы — даются с первых суток лечения.NB! Период энтерального голода в группе детей, получающих консервативное лечение, которое оказывается эффективным, недлительный, редко превышает 7-8 дней. Энтеральное кормление возобновляется с того момента, как у ребенка восстанавливается пассаж по кишечнику, исчезает вздутие живота, появляется стойкая тенденция к улучшению или нормализации лабораторных показателей и рентгенологических данных. Этот срок абсолютно индивидуален для каждого больного ребенка.
Болезнь выживших недоношенных: некротический энтероколит
Каждый год в мире появляется на свет около 15 миллионов малышей, рожденных раньше срока. Одна из опасных патологий таких детей – некротический энтероколит новорожденных, который называют также «болезнь выживших недоношенных». Летальные исходы от НЭК крайне высоки – от 20 до 50% в разных группах. Основная проблема – своевременное выявление заболевания. MedAboutMe рассказывает о причинах НЭК и новых маркерах диагностики опасной болезни.

Суперфуды в косметике: сочные коктейли для здоровья кожи и волос
Причины НЭК у новорожденных

Некротический (или некротизирующий) энтероколит – тяжелейшая патология кишечника. Она развивается на фоне острой гипоксии, нарушения баланса микрофлоры кишечника. Самый высокий риск – у грудных детей после оперативного вмешательства. При прогрессировании НЭК вызывает перфорацию, некроз стенок кишечника, перитонит, сепсис и заканчивается летальным исходом.

НЭК регистрируется у 1-5 детей из 1000 новорожденных. В группе самого высокого риска – недоношенные дети и маловесные младенцы.
Что вызывает некротический энтероколит новорожденных? Помимо групп риска выделяют факторы-провокаторы болезни. Чаще всего НЭК возникает при:
- , чем меньше срок гестации, тем выше риск;
- 1) Stoll BJ. Epidemiology of necrotising enterocolitis. Clin Perinatol 1994;21: 205-218; 2) Kosloske AM. Epidemiology of necrotising enterocolitis. Acta Paediatr Suppl 1994; 396: 2-7; 3) Reber KM, Nankervis CA, Nowicki PT. Newborn intestinal circulation. Physiology and pathophysiology. Clinics Perinatol 2002; 29(1): 23-89; 4) Beeby PJ, Jeffery H. Risk factors for necrotising enterocolitis: the influence of gestational age. Arch Dis Child 1992; 67: 432-5; 5) Snyder CL, Gittes GK, Murphy JP, Sharp RJ, Ashcraft KW, Amoury RA. Survival after necrotizing enterocolitis in infants weighing less than 1,000g. 25 years’ experience at a single institution. J Pediatr Surg 1997; 32(3): 434-7; 6) Bernstein IM, Horbar JD, Badger GJ, Ohlsson A, Golan A. Morbidity and mortality among very low birth weight neonates with intrauterine growth restriction. The Vermont Oxford; 7) Network. Am J Obstet Gynecol 2000; 182(1): 198-206. Bolisetty S, Lui K, Oei J, Wojtulewicz J. A regional study of underlying congenital diseases in term neonates with necrotizing enterocolitis. Acta Paediatr. 2000; 89: 1226–30. Ng S. Necrotizing enterocolitis in the full-term neonate. J Paediatr Child Health 2001; 37: 1–4;
- острой гипоксии ребёнка в процессе родоразрешения;
- болезнях и патологиях легких;
- врожденных пороках сердечно-сосудистой системы;
- гемолитической болезни;
- анемии.
- Молниеносная. Перфорация стенки кишечника возникает на протяжении 36-48 часов после проявления первых симптомов – незначительного нарушения общего состояния ребенка. Характерна для доношенных детей с аномалиями развития ЖКТ (гастрошизис), гемолитической анемией, травмами ЦНС.
- Острая. Дебют характеризуется абдоминальными симптомами. Как правило, спустя 8-16 часов присоединяются соматические проявления, резко ухудшается общее состояние ребенка. Без соответствующего лечения НЭК быстро переходит в 3 стадию. Наблюдается у детей с массой тела при рождении свыше 1500 г.
- Подострая. Первичные абдоминальные проявления имеют перемежающийся характер, возникают поэтапно. Соматические расстройства развиваются медленно. Для этой формы характерно рецидивирующее течение. Обычно возникает у глубоко недоношенных детей с массой тела менее 1500 г.
- Локальный. Патологические изменения наблюдаются на ограниченном отрезке кишечника.
- Полисегментарный. Характерно поражение сразу нескольких участков.
- Паннекроз или тотальный. В патологический процесс втягивается весь кишечник.
Помимо патологий есть и иные причины – многоплодная беременность, агрессивный стиль энтерального кормления, катетеризация пупочной вены, переохлаждение, наркотические зависимости у матерей.

НЭК может указывать на наличие врожденного порока развития – болезни Гиршпрунга, непроходимости кишечника, гастрошизиса.
Терапия некротического энтероколита у младенцев
Если болезнь диагностирована на обратимой стадии, до развития некроза и перфорации, возможна вероятность успешной терапии без оперативного пособия. Для этого грудничка не кормят энтерально, проводят установку желудочного зонда, инфузионную терапию. Параллельно назначаются антимикробные препараты, иммуномодуляторы, антикоагулянты для профилактики образования тромбов.
При наличии осложнений показаны хирургические методы терапии при помощи лапароскопии, лапаротомии, резекции пораженной части, формирования анастомоза, вывода энтеростомы.
На этапе реабилитации необходима интенсивная инфузионная и антибактериальная терапия. Энтеральное вскармливание вводится медленно при условии восстановления функций желудочно-кишечного тракта и отсутствия осложнений.
Среди отдаленных осложнений болезни выживших недоношенных выделяют синдром короткой кишки, стенозы кишечника, нарушения всасывания и т. д., требующие постоянного наблюдения и терапии. Качество жизни после НЭК определяется также сопутствующими патологиями, характерными для недоношенных младенцев: бронхолегочной дисплазией, хроническими заболеваниями легких, последствиями поражения центральной нервной системы, ретинопатией, задержкой физического, психомоторного развития.

Для определения соответствия этапам развития детей созданы специальные нормы для недоношенных с градацией возраста.
Проблемы диагностики и новые методы анализа
Некротический энтероколит новорожденных – тяжелое и опасное заболевание. Даже с современными методиками диагностики и терапии сокращение летальности идет медленно. Основная проблема заключается в эффективности диагностических методов, подтвержденных клинически.

На данный момент прогрессирующий НЭК определяется при помощи рентгенологического исследования, однако чувствительность данного метода не превышает 44%.
Согласно исследованиям, НЭК вызывает динамические изменения состава микробиоты, микрофлоре содержимого кишечника и каловых масс.
Результаты нового исследования, (публикация в JAMA Network Open, февраль 2019), основаны на анализе показателей щелочной фосфатазы кишечника. Функция этого фермента – защита от агентов, проникающих сквозь барьеры слизистой кишечника, при помощи детоксикации липополисахаридов клеточных стенок бактерий.
В исследовании изучили образцы каловых масс детей с некротическим энтероколитом, подозрением на НЭК и контрольной группы здоровых новорожденных. Анализировались также иные характеристики – показатели при рождении, оценка гестационного возраста (актуального для недоношенных детей), раса, половая принадлежность, тип родоразрешения.

Доказано, что при родоразрешении посредством кесарева сечения заселение кишечника полезными микроорганизмами происходит позднее, чем при естественных родах.
Данный факт вызвал появление феномена «бактериального крещения», применения влагалищных выделений матери для обсеменения слизистых младенца. Однако по многим причинам этот способ не рекомендован для новорожденных, тем более для недоношенных младенцев.
Согласно лабораторным и рентгенологическим исследованиям, у 18% детей был некротический энтероколит в тяжелой форме, у 14% — подозрение на болезнь, оставшиеся дети были в контрольной группе.
По данным исследования выявлено, что при тяжелой форме НЭК и подозрении на патологию количество щелочной фосфатазы повышается с одновременным снижением активности фермента. Точность диагностики при помощи анализа на концентрацию и активность составила 97% и 76% при тяжелой форме НЭК и 97/62% при дифференциальной диагностике. Это высокорезультативный диагностический биомаркер с уникальной прогностической ценностью даже на ранних стадиях заболевания.
Хотя щелочная фосфатаза связана только с проявлениями НЭК и не коррелирует с кишечными инфекциями или сепсисом, потенциально данный анализ может быть использован также с целью коррекции режима вскармливания, последствий антибиотикотерапии. Это неинвазивный метод анализа, не доставляющий боли и неудобств ребёнку, что также крайне важно в педиатрии, в особенности в период грудничкового возраста.
Некротический энтероколит новорожденных
Некротический энтероколит новорожденных (НЭК) – это неспецифическое заболевание воспалительного характера, которое вызывается инфекционными агентами на фоне повреждения слизистой оболочки кишечника или ее функциональной незрелости. Симптомы включают соматические реакции и абдоминальные проявления. При длительном течении наблюдаются признаки перфорации кишечника и клиника перитонита. Диагностика НЭК сводится к физикальному обследованию, оценке симптомов по шкале Walsh и Kliegman и рентгенографии. Лечение зависит от стадии заболевания, может быть как консервативным, так и хирургическим.
Общие сведения
Некротический энтероколит новорожденных или «болезнь выживших недоношенных» – это гетерогенная патология, которая характеризуется развитием язв и некрозов стенки кишечника с дальнейшей перфорацией. Более 90% больных детей – недоношенные, с массой тела до 1500г. Общая заболеваемость составляет 0,5-3 на 1000 новорожденных. Прогноз, как правило, неясен, т. к. для НЭК характерно резкое ухудшение состояния на фоне мнимого благополучия. Часто требуется хирургическое вмешательство. Летальность в зависимости от формы колеблется от 25 до 55%. Даже после успешного проведения операции показатель смертности составляет свыше 60%. При условии выживания ребенка наблюдается тяжелый период реабилитации, остается высокий риск послеоперационных осложнений.

Причины НЭК новорожденных
Некротический энтероколит новорожденных – полиэтиологическое заболевание. Основными патогенетическими факторами являются гипоксия и ишемия в перинатальном периоде, нерациональное питание новорожденного и заселение кишечника аномальными микроорганизмами. К способствующим факторам относятся преждевременные роды, эклампсия, травмы ЦНС при родах, иммунодефицитные состояния у ребенка, аномалии развития кишечника, отягощенный семейный анамнез.
Ишемия кишечника может быть обусловлена внутриутробной асфиксией плода, при которой наблюдается централизация кровообращения, постановкой катетера в пупочную артерию, влекущей за собой спазм артерий и их тромбоэмболию, явлением «сгущения крови» и артериальной гипотензией, при которых нарушается ток крови и поступление питательных веществ. К алиментарным причинам развития некротического энтероколита новорожденных относят питание ребенка искусственными смесями и их резкую смену, использование гипертонических растворов, повреждающих слизистую оболочку кишечника, врожденную непереносимость молока, непосредственную инвазию патогенных агентов через ЖКТ. Наиболее часто причиной НЭК становятся Kl. pneumonia, E. coli, клостридии, стафилококки, стрептококки и грибы рода Candida.
Классификация НЭК новорожденных
По скорости развития выделяют следующие формы некротического энтероколита новорожденных:
В зависимости от массивности поражения различают следующие варианты НЭК:
Симптомы и осложнения НЭК новорожденных
Некротический энтероколит новорожденных может возникать в первые 24 часа после родов (ранняя форма) или после 1 месяца жизни (поздняя форма), средний возраст детей на момент появления симптомов – 1-2 недели. Все проявления данной патологии можно разделить на 3 группы: соматические, абдоминальные, генерализованные. Первыми, как правило, появляются абдоминальные симптомы, которые почти сразу дополняются соматическими. Генерализованные проявления НЭК отмечаются при прогрессировании заболевания и возникновении перфорации кишечника, что, в зависимости от формы, может происходить через 1-3 дня.
В группу соматических симптомов входят патологические реакции организма на развитие НЭК: приступы апноэ, респираторный дистресс, олигурия, ухудшение микроциркуляции (позитивный симптом «белого пятна»). К абдоминальным признакам НЭК относятся симптомы раздражения брюшной полости и дисфункция ЖКТ: потеря аппетита, метеоризм, рвота желчью и кровью, отсутствие перистальтических шумов, мелена, асцит, покраснение кожи, отечность подкожной жировой клетчатки и резкое напряжение мышц передней брюшной стенки. Нарушения в организме ребенка, возникшие в результате прогрессирования некротического энтероколита новорожденных, объединяют в группу генерализованных проявлений. Сюда входят гипертермия, переходящая в гипотермию, артериальная гипотония, бледность и диффузный цианоз, выраженная вялость и сонливость, ДВС-синдром, дыхательная и сердечно-сосудистая недостаточность.
Большинство осложнений некротического энтероколита новорожденных, как правило, развиваются после проведенного хирургического лечения. Наиболее часто после оперативного вмешательства возникает кишечный свищ, синдром «укороченной кишки», хроническая диарея, демпинг-синдром, обезвоживание, синдром мальабсорбции, стриктура толстого кишечника, абсцесс, задержка физического развития. Также при НЭК могут встречаться патологические состояния, вызванные полным парентеральным питанием: дефицит витамина D (рахит), поражение печени (гепатит) и костей (деминерализация).
Диагностика НЭК новорожденных
Диагностика некротического энтероколита новорожденных включает в себя сбор анамнеза, клиническое, лабораторное и инструментальное обследование. Анамнестические данные могут помочь педиатру и детскому хирургу установить возможную этиологию, проследить за динамикой заболевания. При объективном осмотре выявляются присутствующие на данный момент клинические симптомы – абдоминальные, соматические и генерализованные проявления. Специфических лабораторных тестов для подтверждения НЭК не существует. Информативными являются следующие данные, полученные при проведении лабораторных исследований: лейкоцитоз со сдвигом формулы влево, лейкопения и тромбоцитопения в ОАК, ацидоз и гипоксемия при определении газового состава крови, гиперкалиемия и гипонатриемия в электролитном спектре, диспротеинемия и выявления С-реактивного протеина в белковом спектре, обнаружение крови в кале при пробе Грегерсена. С целью выявления инфекционного возбудителя проводится бактериальный посев, ИФА и ПЦР.
Ведущую роль в диагностике некротического энтероколита новорожденных играют инструментальные методы: рентгенография, УЗИ, КТ и МРТ. Они дают возможность визуализировать отек стенок кишечного тракта, плюс-ткань, наличие воздуха в брюшной полости, в просвете портальной или печеночной вен, а также отсутствие перистальтики на серии последовательных снимков. В педиатрии для подтверждения диагноза «некротический энтероколит новорожденных» и определения стадии заболевания применяется шкала Walsh и Kliegman. При использовании данной шкалы учитываются присутствующие у ребенка соматические симптомы, проявления со стороны желудочно-кишечного тракта и рентгенологические признаки. В зависимости от количества и выраженности проявлений выделяют подозреваемый НЭК (1а и 2а ст.), явный НЭК (2а и 2б ст.), прогрессирующий НЭК (3а и 3б ст.). Это имеет существенное значение при выборе тактики лечения.
Дифференциальная диагностика некротического энтероколита новорожденных проводится с такими патологиями как неонатальный сепсис, пневмония, пневмоперитонеум, кишечная непроходимость различного генеза, аппендицит новорожденного, бактериальный перитонит и спонтанная перфорация кишечника.
Лечение НЭК новорожденных
Тактика лечения некротического энтероколита новорожденных зависит от тяжести состояния ребенка и стадии заболевания. Детям с 1а, 1б и 2а стадиями показана консервативная терапия. С момента постановки диагноза отменяется энтеральное питание и проводится постановка назо- или орогастрального зонда с целью декомпрессии. Ребенок переводится на полное парентеральное питание (TPN) в соответствии с клиническими протоколами. Параллельно назначаются антибактериальные препараты из групп пенициллинов (ампициллин) и аминогликозидов II поколения (гентамицин) в комбинации с медикаментами, действующими на анаэробную микрофлору (метронидазол). При неэффективности выбранной антибиотикотерапии применяют цефалоспорины III-IV поколения (цефтриаксон) в сочетании с аминогликозидами III поколения (амикацин). Таким детям рекомендованы пробиотики и эубиотики для нормализации кишечной микрофлоры. Также проводят СВЧ-терапию, вводят иммуномодуляторы и гамма-глобулины.
Детям с 2б, 3а и 3б стадиями показано хирургическое вмешательство. Объем операции зависит от распространенности поражения кишечника. Как правило, проводится экономная резекция пораженного участка с формированием энтеростомы или колостомы. При локальных формах НЭК возможно наложение анастомоза по типу «конец в конец». После операции назначается инфузионная терапия и медикаментозное лечение, аналогичное более ранним стадиям.
Прогноз и профилактика НЭК новорожденных
Исход НЭК зависит от тяжести общего состояния ребенка и стадии заболевания. Так как данные показатели почти всегда отличаются нестабильностью, прогноз считается сомнительным даже на фоне полноценного лечения. Профилактика некротического энтероколита новорожденных включает в себя антенатальную охрану здоровья плода, рациональное ведение беременности, грудное вскармливание в физиологических объемах. Согласно некоторым исследованиям, риск развития заболевания снижается при использовании эубиотиков, пробиотиков и IgA у детей из группы риска. При высоком риске преждевременных родов применяют глюкокортикостероиды с целью профилактики РДС.
Источник https://diseases.medelement.com/disease/%D0%BD%D0%B5%D0%BA%D1%80%D0%BE%D1%82%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9-%D1%8D%D0%BD%D1%82%D0%B5%D1%80%D0%BE%D0%BA%D0%BE%D0%BB%D0%B8%D1%82-%D1%83-%D0%BD%D0%BE%D0%B2%D0%BE%D1%80%D0%BE%D0%B6%D0%B4%D0%B5%D0%BD%D0%BD%D0%BE%D0%B3%D0%BE/14863
Источник https://medaboutme.ru/articles/bolezn_vyzhivshikh_nedonoshennykh_nekroticheskiy_enterokolit/
Источник https://www.krasotaimedicina.ru/diseases/children/necrotizing-enterocolitis