Протонная терапия и современное лечение рака простаты
Рак простаты — одно из наиболее сложных в диагностике онкозаболеваний. Но и лечение рака простаты имеет ряд существенных особенностей. О том, почему протонная терапия, уже доступная в России, стала эталоном эффективности лечения рака простаты без операции — наша статья.
Широко известен термин “Аденома простаты”. Нет, это не рак. Это разрастание клеток предстательной железы, приводящее к сдавливанию растущей простатой окружающих структур, что и приводит к наиболее распространенным симптомам — трудностей с мочеиспусканием, неполным опорожнением мочевого пузыря и т.д. Аденома простаты не несет прямой угрозы организму, хотя и способна значительно снизить качество жизни мужчины.
Гораздо опаснее два популярных в обществе мнения: “аденома простаты — безопасна” и “лечение рака простаты — крайне травматично и чревато серьезными побочными эффектами” (чем конкретно пугает лечение рака простаты — поговорим в одном из следующих разделов статьи).
Первое “мнение” о безопасности аденомы предстательной железы приводит к игнорированию нарастающих симптомов. Второе “заблуждение” о том, что лечение рака простаты проводится только хирургическим способом, становится причиной позднего обращения к врачу, даже на той стадии, когда развился метастатический рак простаты и речь может идти о продлении жизни, а не о полном излечении.
Не так страшен рак простаты, как его метастазы
Симптомы рака простаты практически идентичны тем, что отмечает пациент с аденомой предстательной железы. И если их характер нарастает, то следует запланировать визит к врачу в ближайший день-два.
Справедливости ради, следует отметить — рак простаты чрезвычайно распространенное заболевание. И уровень смертности, который можно найти в статистике (в среднем, 3-4 место среди онкозаболеваний у мужчин), — завышен. Это связано с тем, что подавляющее большинство случаев рака простаты не регистрируются — зачастую мужчина даже не догадывается о наличии у него злокачественного заболевания предстательной железы до конца жизни. Та же аденома простаты растет гораздо быстрее, отчего ее симптоматика носит более выраженный характер. В большинстве случаев рак простаты не метастазирует, поэтому часто пациентам не показано лечение.
Но в тех случаях, когда у пациента развивается агрессивный рак простаты, опухоль растет быстро, нередко не только сдавливая окружающие ткани, но и прорастая в них. Наиболее явно об этом скажет кровь в моче и боли при мочеиспускании, реже — семяизвержении. Но помимо разрастания самой опухоли, приводящего к резкому появлению и нарастанию симптомов, ее клетки активно распространяются по организму с кровью и лимфой: появляются метастазы рака простаты — опухоли, растущие из “прикрепившихся” злокачественных клеток.
Наиболее вероятные органы-мишени рака простаты:
- легкие
- печень
- лимфоузлы (паховые и подвздошные)
- кости (чаще всего, кости таза)
Учитывая, что множественные метастазы рака простаты с высокой долей вероятности будут столь же агрессивны, как и первичная опухоль, прогноз у таких пациентов, в целом, неблагоприятен.
Лечение рака простаты: можно обойтись без операции?
Информация, приведенная в предыдущем разделе, показывает, насколько важно своевременно выявить новообразование простаты, установить точный диагноз и начать адекватное лечение.
Этого как раз и боятся пациенты, теряющие драгоценное время в изучении методов хирургического лечения рака предстательной железы, пугающих своей травматичностью и последствиями. К счастью, такое лечение рака простаты, как малоэффективная ТУР (трансуретральная резекция простаты) или радикальная простатэктомия (удаление простаты с семенными пузырьками) в современной онкологии уступает место эффективным альтернативам, позволяющим провести лечение без операции. К тому же хирургическое лечение рака простаты имеет какое-либо обоснование при лечении ранних стадий, когда опухоль локализована в пределах железы и нет метастазов.
Динамическое наблюдение
Первый из методов лечения рака предстательной железы имеет неожиданную формулировку — фиксация имеющихся данных о размере, расположении и распространенности новообразования, последующее регулярное прохождение одинакового “набора” обследований с целью своевременного выявления вероятной прогрессии заболевания. Именно динамическое наблюдение при раке простаты (в случае низкой агрессивности опухоли) способно сохранить качество жизни без значительного риска.
Хирургическое лечение
Важность хирургического вмешательства при лечении рака простаты в современной онкологии стремительно уменьшается. Хирургическое удаление — травматично, приводит к серьезным побочным эффектам (импотенция, недержание мочи и кала) и малорезультативно — зачастую рак простаты диагностируется на стадии, когда полное удаление опухоли невозможно. Аналогичным недостатком ввиду сложности визуального контроля обладают методы контактного удаления простаты: криоабляция (разрушение клеток воздействием сверхнизких температур) и ультразвуковая абляция фокусированным ультразвуком высокой интенсивности.
Лучевое лечение рака простаты
Более избирательным является воздействие на злокачественную опухоль простаты ионизирующим излучением. Лечение рака простаты на ранних стадиях может быть успешно выполнено различными методами лучевого воздействия:
- брахитерапия — разрушение опухоли излучением внедренных в ее объем “зерен” радиоактивных препаратов;
- дистанционная лучевая терапия, при которой в зону облучения, как правило, включаются лимфатические узлы;
- радиохирургия — высокоточное подведение разовых доз, вызывающих одномоментную остановку биологических процессов в заданном объеме, совпадающем с опухолью.
Лучевое лечение часто дополняется гормональной терапией проводимой для подавления выработки мужских гормонов, “подпитывающих” опухолевый процесс.
Протонная терапия
Лечение протонами (протонная терапия) — наиболее точный и технологичный метод разрушения опухолевых клеток, позволяющий лечить рак простаты с минимальной лучевой нагрузкой на здоровые ткани организма.
В отличие от фотонной терапии (основная часть современного лучевого лечения использует энергию элементарных частиц фотонов), протонная терапия использует свойства другой элементарной частицы — протона.
Протон отдает максимальную энергию на коротком участке своего “пробега” (пик Брэгга). Точный расчет и подведение пучков защищает от облучения здоровых тканей: на участке от точки входа в организм до границы опухоли энергия протона минимальна, основная доза радиации высвобождается на отрезке в пределах опухоли, после чего энергия протона падает до околонулевого значения,
Лечение рака протонами принципиально напоминает лучевую терапию. Однако, чрезвычайная точность и равномерность подведения заданной дозы ионизирующего излучения при протонной терапии удостоились собственного раздела в классификации методов лечения рака.
Преимущества протонной терапии
- высокая точность доставки излучения — протонная терапия позволяет подводить большие дозы непосредственно к опухоли;
- максимальная защита здоровых органов и тканей от облучения — протонная терапия при раке простаты исключает лучевые реакции, особенно в таких критически важных органах, как мочевой пузырь и прямая кишка;
- лечение протонами неинвазивно и безболезненно — не требуется реабилитация;
- протонная терапия проводится амбулаторно — коллеги и друзья могут и не узнать, с лечением какого заболевания вам пришлось иметь дело.
Протонная терапия в МИБС: важное отличие
Лечение рака протонами все еще воспринимается в обществе, как далекая фантастическая технология из будущего. Так оно и есть. Но с одной важной поправкой — протонная терапия в России — это уже настоящее. Первый в России клинический центр протонной терапии Медицинского института Березина Сергея (МИБС) работает с конца 2017 года, реализуя новейшие методики.
Сканирование карандашным пучком
Центр протонной терапии МИБС предлагает пациентам лечение методом сканирования карандашным пучком (pencil beam scanning, PBS), который является более наиболее совершенным видом протонной терапии. При этой методике пучок протонов безостановочно движется в заданном на виртуальной модели объеме опухоли, аккуратно, словно острием карандаша, “заштриховывая” пиком Брэгга (короткой зоной активного высвобождения энергии протона) объем опухоли. Таким образом, установка протонной терапии позволяет создавать зоны высокой дозы ионизирующего излучения, гибельного для раковых клеток, любой сложной формы и любого объема.
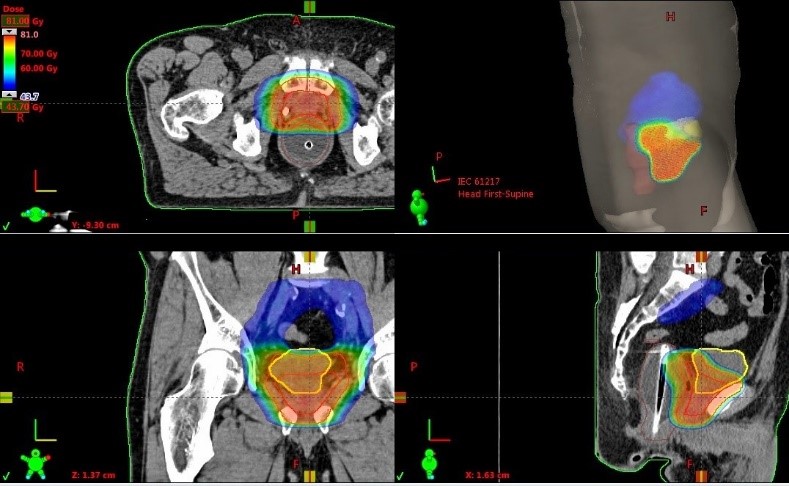
Пример плана лечения рака простаты протонами в Центре протонной терапии МИБС. Пациент Н., 71 год. Выполнена простатэктомия 5 лет назад. Местный рецидив в ложе предстательной железы. Самая эффективная методика в подобной ситуации – воздействие ионизирующего облучения. Самый точный и безопасный способ подведения высоких доз – протонная терапия. Благодаря точности протонной терапии облучение будет подано непосредственно в требуемые зоны: 46 Гр на тазовые лимфоузлы (зона, отмеченная синим), 76 Гр на ложе простаты и зону рецидива (объем тканей, в который будет подведена такая доза, выделен желтым и красным цветом). При этом остальные ткани организма защищены от излучения, которое могло бы оказать влияние на биологические процессы в них.
Лечение рака простаты протонами по методу сканирования карандашным пучком позволяет максимально обеспечить отсутствие побочных эффектов, в первую очередь, защитить пациента от импотенции. Это крайне важно для мужчин, у которых рак предстательной железы был выявлен в относительно молодом возрасте.
Реализовать столь точную технологию лечения рака помогает постоянное сотрудничество МИБС с производителями оборудования и зарубежными центрами протонной терапии.
Как выглядит протонная терапия для пациента с раком простаты?
Во время сеанса пациент находится в сознании (анестезия не требуется, так как протонная терапия безболезненна), удобно расположившись на специальной подвижной платформе (кушетке).
Важным аспектом является то, что сеанс (фракция) протонной терапии длится всего 15-20 минут, и не требует времени на восстановление, сохраняется физическая и сексуальная активность. И пациент, затрачивая на лечение около часа ежедневно, все остальное время может посвятить работе, общению с близкими, хобби и т.д. Таким образом ни коллеги, ни друзья, а, иногда, и члены семьи могут не догадываться о том, с каким заболеванием борется мужчина.
Сохранить конфиденциальность лечения помогают обособленное расположение Центра протонной терапии МИБС и специальные протоколы конфиденциальности, действующие в Клинике.
Длительность лечения рака простаты протонами варьируется в зависимости от индивидуальных особенностей случая (размер и расположение опухоли, получаемое ранее лечение и т.д.).
Чаще всего протонная терапия предусматривает 35-40 сеансов (называемых “фракциями”), которые проводятся пять дней в неделю с перерывом на выходные. Таким образом, курс лечения протонами длится около двух месяцев.
В некоторых случаях возможно «гипофракционирование»: 5 фракций за 5 дней, то есть лечение рака простаты протонами может длиться всего одну неделю. Окончательное решение по количеству фракций и методу (фракционирование или гипофракционирование) принимает врач на основании комплекса факторов, таких как распространенность опухоли, стадия заболевания и т.д.
Сколько стоит протонная терапия рака простаты?
Стоимость лечения онкологического заболевания складывается из стоимости непосредственно лечения первичной опухоли и ее метастазов, а также необходимой поддерживающей терапии и стоимости лечения побочных эффектов, восстановительного лечения, пластической хирургии, реабилитации. Кроме того, при сравнении стоимости различных видов лечения рака следует обращать внимание на уровень ожидаемого качества жизни как во время лечения, так и по его завершению. И обязательно учесть время, в течение которого пациент не сможет выполнять свои профессиональные обязанности (стоимость упущенные возможности)
Таким образом, стоимость протонной терапии рака простаты, более дорогого, но эффективного метода лечения, не требующего дополнительной терапии или реабилитации (и во время которого пациент живет полноценной жизнью), оказывается ненамного ниже, чем стоимость хирургического лечения рака простаты на ранней стадии, которое пока еще проводится в некоторых онкологических и урологических клиниках России.
То, что протонная терапия включена в список методов лечения, покрываемых программами обязательного и добровольного медицинского страхования в США и некоторых странах Европы, — дополнительное подтверждение эффективности метода.
Подозреваете рак простаты? Не откладывайте обращение — звоните в Центр протонной терапии МИБС сейчас!

Воробьев Николай Андреевич
Врач-онколог, врач- радиолог
Заведующий отделением протонной лучевой терапии
Лечение рака простаты (предстательной железы)
Заболевание диагностируется у 20% мужчин старше 50-ти лет, оперированных по поводу аденомы предстательной железы. Вероятность появления злокачественного новообразования с возрастом увеличивается, а возможность провести радикальное лечение рака простаты с выходом в стойкую ремиссию – уменьшается. В то же время, в любом возрасте прогноз успешности лечения напрямую зависит от того когда было обнаружено заболевание: чем раньше, тем больше шансов у больного на выздоровление.

В группу риска, прежде всего, попадают мужчины с наследственной (генетической) предрасположенностью, то есть те, у кого раком предстательной железы болел кто-либо из близких родственников.
Поэтому для мужчин старше 45 лет крайне важны профилактические обследования у онкоуролога, а также определение уровня ПСА (простатспецифического антигена) в крови – ежегодно и при появлении любых симптомов, характерных для данного заболевания.
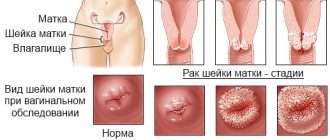
Виды и стадии (степени) рака простаты
Формат и успешность лечения в онкологии зависят от стадии заболевания. Правильная терминология подразумевает вести речь, не о степени рака простаты, а стадии. Принято пользоваться общепринятой международной системой классификации TNM, позволяющей описать саму опухоль (T), состояние региональных лимфоузлов (N) и наличие или отсутствие отдаленных метастаз (M). Согласно этой системе выделяют 4 основных стадии.
Степень злокачественности определяют по шкале Глиссона (диапазон значений от 2 до 10) на основании данных микроскопического исследования биопсийной ткани. Чем меньше степень злокачественности, тем лучше прогноз. Чем ниже дифференцировка клеток новообразования, тем она злокачественнее. Чем больше размеры опухоли, тем больше в ней недифференцированных клеток. При постановке диагноза также учитывается значение ПСА.
- 1 степень (1 стадия) рака простаты характеризуется отсутствием видимых на УЗИ-исследовании очагов поражения. При пальпации (прощупывании) железы на этой стадии онкоуролог также не находит изменений. Диагноз выставляется по данным лабораторных исследований: тесту ПСА, биопсии.
- Лечение рака простаты 2 степени (2 стадии) также проводится исходя из того, что заболевание не выходит за пределы органа. Новообразование видно при ультразвуковом исследовании, однако оно занимает не более половины предстательной железы.
- Рака простаты 3 степени (3 стадии) характеризуется прорастанием опухоли за пределы капсулы (в семенные пузырьки). При этом прогноз при лечение рака простаты 3 степени относительно хороший, за счет того, что поражения других органов, лимфоузлов и отдаленные метастазы отсутствуют.
- При 4 степени (4 стадии) опухоль распространяется в другие органы и ткани: регионарные лимфоузлы, шейку мочевого пузыря, прямую кишку. Отдаленные метастазы чаще всего определяются в костях малого таза, позвоночнике, ребрах.
По своим морфологическим признакам злокачественные новообразования подразделяются на эпителиальные (плоскоклеточные, переходно-клеточные, аденокарциномы) и не эпителиальные.
Еще один критерий, учитывающийся при классификации, – зависимость роста опухоли от содержания в крови мужского полового гормона (тестостерона).
Основные методы лечения при раке предстательной железы
1 степень
Больным 1 стадии в возрасте до 70 лет при отсутствии противопоказаний к проведению операции показано хирургическое удаление новообразования. Прогноз выживаемости позитивный, большинство пациентов удается успешно излечить. Объем операции в данном случае минимальный, поэтому ее можно провести с помощью эндоскопа.
Лучевая терапия на системе Кибер-нож
При невозможности хирургического вмешательства из-за высокой степени риска для пациента в качестве альтернативного радикального лечения рака простаты может быть выбрано дистанционное радиохирургическая терапия Киберножом, гипофракционная терапия на системе TrueBeam или брахитерапия, реже – проведение курса лучевой терапии – стандартной конформной либо IMRT.
2 степень
Рак простаты 2 стадии предусматривает лечение любым из описанных выше способов описанных выше способов или их комбинацией. Прогноз по выживаемости положительный — до 80% стойкой ремиссии (отсутствие признаков возврата заболевания) в течение 5 лет. Хирургическое лечение, как правило на этом этапе проводится классическим способом (без эндоскопа). В процессе операции чаще всего удаляется не только сама железа, но часть семенников.
Криохирургическая операция
Еще один метод радикального воздействия – криохирургия (удаление опухоли путем разрушения с помощью локального замораживания жидким азотом). Опухоль также может разрушаться посредством действия высокоинтенсивного сфокусированного ультразвука.
3 и 4 степень
При обнаружении заболевания в поздних стадиях (3, 4) проводится комплексная терапия, объем и содержание которой определяются в индивидуальном порядке. Относительно других видов рака процент выходящих в ремиссию высокий.
На всех стадиях заболевания больному может быть назначена гормонотерапия, реже – химиотерапия вследствие ее низкой эффективности и высокого риска развития осложнений.
В некоторых случаях онкоурологи отказываются от любых способов лечения рака простаты, выбирая тактику активного наблюдения. Прежде всего, это касается престарелых мужчин с низкой степенью злокачественности новообразования, наличие которой не сказывается на качестве жизни больного.
Лечение гормонозависимого рака
Раковые клетки гормонозависимых опухолей активно растут и размножаются при избытке тестостерона, поэтому такие новообразования лечатся с применением гормонотерапии (медикаментозной кастрации) или удалением яичек (классической кастрации).
Гормонотерапия проводится с помощью препаратов, блокирующих рецепторы к тестостерону раковых клеток или снижающих выработку самого гормона. При терапии гормонорезистентной (гормононезависимой) онкологии эти методы неэффективны. По мере прогрессирования болезни гормонозависимость опухоли уменьшается.
Последствия лечения рака простаты у мужчин
Одно из наиболее психотравмирующих осложнений у мужчин в возрасте до 60-ти лет – высокая вероятность импотенции, которая после хирургического вмешательства, гормональной терапии и конформной лучевой терапии развивается в 35-50% случаев.
После радиохирургической терапии Киберножом риск развития импотенции минимален. Результаты метода сопоставимы с результатами стандартной операции, при этом лечение полностью бескровно и атравматично, что исключает необходимость наркоза и риск инфицирования.
Контактная лучевая терапия (брахитерапия) с использованием современного оборудования также обычно не вызывает значимых нарушений эректильной функции.
Помимо импотенции, в отдаленном периоде после курса классической ЛТ при облучении обширных зон могут возникать такие осложнения, как проктит (воспаление прямой кишки) или цистит (воспаление мочевого пузыря).
Характер и выраженность осложнений после химиотерапии обуславливается типом используемых препаратов, интенсивностью терапии и индивидуальными особенностями организма пациента.
Негативные последствия у мужчин старше 70 — 80 лет возникают чаще и протекают тяжелее, что принимаются во внимание при выборе методов и препаратов. Вероятность возникновения осложнений зависит от наличия сопутствующих диагнозов и состояния естественной иммунной защиты.
Восстановление
Полное восстановление у мужчин после лечения рака простаты при отсутствии осложнений занимает до 2-3 месяцев. При этом после операции первые 3-4 недели пациент находится в стационаре. Восстановление после терапии Кибер-ножом и брахитерапии обычно не требует пребывания в клинике дольше 5 дней. Гормональная терапия и химиотерапия может проводиться амбулаторно.
Если вам требуется второе мнение для уточнения диагноза или плана лечения, отправьте нам заявку и документы для консультации, или запишитесь на очную консультацию по телефону.
Рак предстательной железы — симптомы и лечение
Что такое рак предстательной железы? Причины возникновения, диагностику и методы лечения разберем в статье доктора Скатова Бориса Валерьевича, уролога со стажем в 29 лет.
Над статьей доктора Скатова Бориса Валерьевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
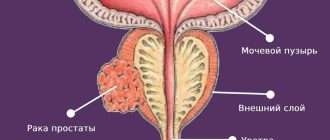
Рак предстательной железы (РПЖ) — это злокачественное новообразование, развивающееся из патологических клеток предстательной железы. Рак предстательной железы является самым распространённым новообразованием у мужчин старше 50 лет и характеризуется значительной летальностью (свыше 16% в отдельных случаях), занимая второе место в структуре смертности после рака лёгких. [1]
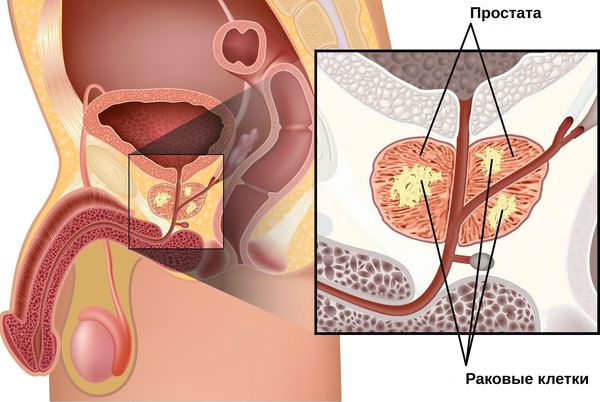
Предстательная железа — особый орган мочеполовой системы мужчин, расположенный в промежутке между прямой кишкой, лобковой костью и мочевым пузырём, охватывает значительный участок мочеиспускательного канала. Простата вырабатывает гормоны и сок простаты, являющийся средой для жизни сперматозоидов, при попадании их в матку участвует в регуляции мочеиспускания.
Наиболее высокий процент заболевания РПЖ наблюдается в США, Канаде, а также в некоторых европейских странах — там болезнь занимает первое место среди всех онкологических заболеваний. Согласно данным Национального института рака (National Cancer Institute, США), с 1986 по 1992 год процент заболеваемости раком простаты среди белокожего населения вырос на 108% и на 102% — для афроамериканцев. [2]
Уровень заболеваемости РПЖ на территории России также неумолимо увеличивается. В 2006 году впервые было выявлено 18 092 случая рака предстательной железы, а стандартизованный показатель равнялся 21,4 на 100 тысяч населения. Прирост заболеваемости с 1996 по 2006 год составил 94,84% при учёте среднего темпа прироста за 2006 год — 6,9%.
Прирост летальности от рака простаты за последние 20 лет составил 58,76%. Такой прирост равнозначен распространению самой настоящей эпидемии. Так, в США в 2016 году было заявлено 272843 (а в 2009 году — 207789) первичных выявлений рака предстательной железы, приведших к 29225 летальным случаям в 2009 году. По данным европейских урологов, в 2017 году заболеваемость в Европе составила 219 случаев на 1000 мужчин. В России, согласно эпидемиологическим данным Чиссова В.И., в 2012 году впервые выявлено 24911 случаев рака предстательной железы. [3]
Следует понимать, что интенсивный прирост заболеваемости раком предстательной железы связан, в частности, с широким внедрением в клиническую практику новейших диагностических методов обследования пациентов среднего и пожилого возраста. Огромное значение имеет определение ПСА в качестве скрининга мужчин старше 50 лет, основанный на выявлении простатического специфического антигена в крови и моче мужчин. Например, в 60-х и 70-х годах прошлого века, при отсутствии данной методики, рак предстательной железы выявляли только на поздних стадиях уже в крайне запущенном состоянии. [4]
Частота распространения онкологии этой локализации неодинакова в разных регионах, а также среди лиц разных профессий и представителей определённых национальностей. Чаще всего рак предстательной железы выявляется у североамериканцев и европейцев, реже всего у азиатов. [5]
Причины заболевания раком предстательной железы:
- гормональная возрастная перестройка организма;
- качественное изменение цикла синтеза тестостерона;
- генетическая предрасположенность (наличие подобных заболеваний у ближайших родственников);
- высокий уровень сывороточного тестостерона;
- загрязнение окружающей среды, чрезмерное употребление синтетических и жирных продуктов;
- работа на вредных производствах;
- злоупотребление бытовыми наркотиками (никотин, алкоголь);
- наличие «предраковых» заболеваний (простатит, гиперплазия предстательной железы).
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
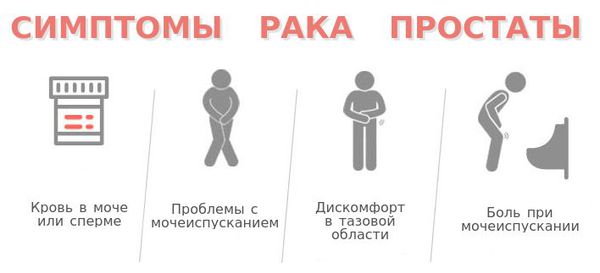
Симптомы рака предстательной железы
Как распознать первые симптомы рака простаты
Следует знать, что рак предстательной железы на ранних стадиях протекает совершенно бессимптомно.
По мере распространения опухоли и появления метастазов начинают проявляться определённые клинические симптомы:
- частое, иногда затруднённое мочеиспускание;
- слабая («вялая») струя мочи;
- возникновение чувства, что мочевой пузырь опорожнён не полностью;
- задержки нормального мочеиспускания, запоры;
- недержание мочи;
- болевые ощущения различной интенсивности в промежности, крестце, головке полового члена, внизу живота, пояснице;
- наличие крови в моче и сперме;
- отёк нижних конечностей;
- параплегия (онемение нижних конечностей) при компрессии (сдавлении) спинного мозга;
- заметное снижение массы тела, истощение (кахексия);
- анемия (снижение гемоглобина) и уремия. [6]
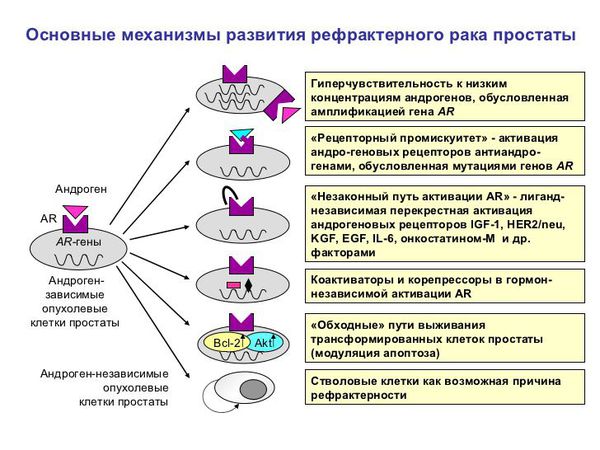
Патогенез рака предстательной железы
Причины, по которым возникает рак простаты, разнообразны и до конца не установлены. Выделяют следующие механизмы молекулярного возникновения РПЖ:
- Внутри трансформированных клеток простаты происходят множественные видоизменения синтеза генов, которые контролируют пролиферацию (новообразование клеток). Повышается уровень образования факторов роста и их рецепторов, осуществляется активация сигнальных каскадов, связанных с андрогенновыми и эстрогенновыми рецепторами, увеличивается активность эмбриональных сигнальных путей, характерных для стволовых клеток. Совокупность этих компонентов придаёт изменённым клеткам простаты агрессивные свойства, стимулирует их избыточное деление, миграцию и метастатическую активность.
- В клетках предстательной железы, которые начали злокачественно перерождаться, нарушается экспрессия генов и белков, контролирующих апоптоз (механизм, обеспечивающий выживание клеток опухоли, развитие их устойчивости к химиотерапии).
- Генетические мутации и разнообразные генетические факторы играют важную роль в развитии рака простаты, сигнальных белков, которые стимулируют более поздние стадии канцерогенеза — канцероматозный неоангиогенез (образование сосудов, снабжающих развивающуюся опухоль кислородом и питательными веществами). [7]
Классификация и стадии развития рака предстательной железы
Классификация рака предстательной железы по системе TNM
Классификацию стадий развития рака разработал французский хирург Пьер Денуа в 1952 году. В дальнейшем она была многократно переработана. В 2002 году было принято решение о прекращении внесения изменений до возникновения радикальных перемен в диагностике и лечении злокачественных опухолей. Идею новой знаковой классификации по системе TNM поддержали национальные комитеты TNM различных стран, данная система получила признание во всём мире. Классификация 2002 года помогает интерпретации полученных результатов, оптимизирует алгоритмы лечения. Система TNM в последней редакции повсеместно используется в установлении диагноза и определении стадии рака предстательной железы.
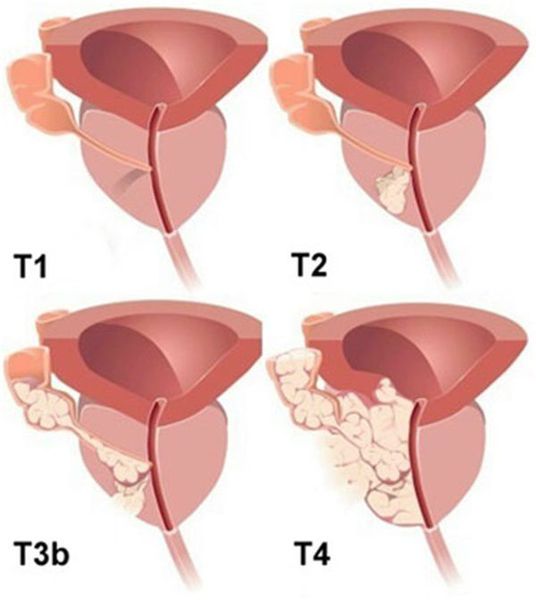
Т — опухоль первичная:
— ТX — недостаточно сведений для интерпретации первичной опухоли;
— Т0 — первичная опухоль не выявляется;
— Т1 — клинических проявлений опухоли нет, она не проявляется при пальпации, её не удаётся визуализировать специальными методами:
- Т1а — опухоль случайно обнаруживается при гистологическом исследовании и составляет менее 5% ткани, полученной при биопсии;
- Т1b — опухоль случайно обнаруживается при гистологическом исследовании и составляет более 5% ткани, полученной при биопсии;
- Т1с — опухоль диагностируется при помощи игольчатой биопсии простаты, которая производится по причине высокого уровня ПСА);
— Т2 — опухоль, ограниченная предстательной железой или распространённая в капсуле:
- Т2а — опухоль поражает меньше половины или половину одной доли;
- Т2b — опухоль поражает более половины одной доли (но не две доли);
- Т2c — опухоль поражает две доли;
— Т3 — опухоль распространяется за пределы капсулы предстательной железы:
- Т3а — опухоль распространяется за пределы капсулы (одно- или двустороннее распространение);
- Т3b — опухоль распространяется на семенной пузырёк;
— Т4 — несмещаемая опухоль или опухоль, которая распространяется на соседние ткани и органы, но не на семенные пузырьки: шейку мочевого пузыря, наружный сфинктер, прямую кишку, мышцу, поднимающую задний проход, и/или тазовую стенку.
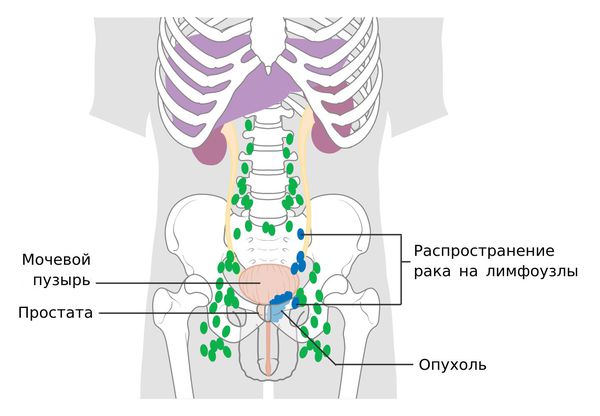
N — регионарные лимфоузлы
Регионарные лимфоузлы предстательной железы — это узлы малого таза, находящиеся ниже бифуркации общих подвздошных артерий. Категория N не зависит от стороны локализации регионарных метастазов.
— NX — недостаточно данных для оценки регионарных лимфоузлов;
— N0 — отсутствие метастаз в регионарных лимфоузлах;
— N1 — метастазы в регионарных лимфоузлах присутствуют.
M — отдалённые метастазы:
— МX — определение наличия отдалённых метастазов невозможно;
— М0 — признаки отдалённых метастазов отсутствуют;
— М1 — присутствие отдалённых метастазов:
- M1a — поражение регионарных лимфатических узлов;
- M1b — происходит поражение костей;
- M1c — возникают отдалённые метастазы иных локализаций (в лёгких, печени и т.д.).
Классификация рака простаты по шкале Глисона (Gleason score)
Шкала Глисона позволяет определить степень злокачественности опухоли, выявленной при биопсии предстательной железы. Об уровне опасности опухоли свидетельствуют набранные баллы по данной шкале: чем бал больше, тем опаснее опухоль. В основе оценки опухоли лежит сравнение раковых клеток, полученных при биопсии простаты, с нормальными клетками. Так, отсутствие отличия раковых клеток от обычных позволяет оценить опухоль в 1 балл по шкале Глисона. При радикальном отличии клеток опухоли ставится максимальная оценка в 5 баллов.
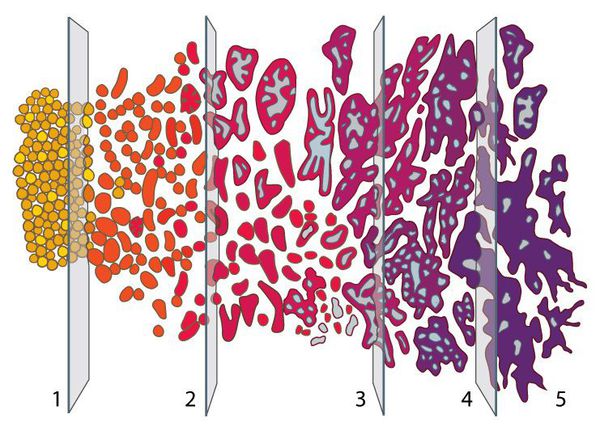
Степень злокачественной опухоли определяется по сумме Глисона, то есть путём суммирования баллов данной шкалы (от 1 до 5) по двум самым обширным и злокачественным новообразованиям, которые обнаружили в тканях предстательной железы.
Оценка злокачественных опухолей по сумме Глисона:
- умеренно выраженные, если сумма Глисона ≤ 6 баллам;
- средне выраженные, если сумма Глисона = 7 баллам;
- высоко выраженные, если сумма Глисона = 8-10 баллам.
Классификация рака простаты по системе Джюит-Уайтмор
По системе Джюит-Уайтмора классификация рака предстательной железы делится на стадии: А, В, С и D. Стадии А и В — излечимы, стадии С и D также вылечиваются, но прогноз их излечения менее благоприятный.
Стадия А. Она является самой ранней стадией. Симптомы не проявляются, хотя раковые клетки уже локализуются в простате:
- А 1 — дифференциация раковых клеток хорошая, аномалия клеток умеренная;
- А 2 — умеренная или плохая дифференциация раковых клеток в нескольких участках простаты.
Стадия В. Опухоль не выходит за пределы простаты. Определяется при пальпировании, и/или фиксируется повышенный уровень ПСА:
- В 0 — опухоль в пределах простаты, не пальпируется; повышенный уровень ПСА;
- В 1 — наличие одиночного опухолевого узла в одной доле простаты;
- В 2 — экстенсивный рост опухоли в одной или в обеих долях простаты.
Стадия С. Опухоль выходит за пределы капсулы простаты и распространяется на соседние ткани и органы, включая семенные пузырьки:
- С 1 — прорастание опухоли за пределы капсулы простаты;
- С 2 — перекрытие просвета уретры или мочевого пузыря опухолью.
Стадия D. Опухоль распространяет метастазы в регионарные лимфатические узлы или в отдалённые органы и ткани (лёгкие, печень, кости, желудок и т. д.):
- D 0 — клиническое обнаружение метастаз при повышенном уровне ПСА;
- D1 — поражение регионарных лимфоузлов;
- D2 — поражение отдаленных лимфоузлов, органов и тканей;
- D3 — метастазы после лечения. [8][9][10]
Осложнения рака предстательной железы
Метастазы при раке простаты
Раковые клетки продвигаются через соединительную ткань и в результате проникают внутрь кровеносной или лимфатической системы. Затем они переносятся с кровью или лимфой, пока не закрепятся на новом месте, — так образуются метастазы.
Наиболее часто метастазы рака простаты поражают кости. При этом возникает боль в поражённой костной ткани, иногда в отдалённых участках. Если сдавливается нерв, боль может отдавать в другие участки, особенно такое характерно для рук и ног. При поражении метастазами позвоночника часто сдавливается спинной мозг и возникают переломы. Сдавливание нервных стволов может приводить к различным неврологическим симптомам: боли, парестезии (ощущению покалывания, жжения, «ползания мурашек»), гиперестезии (повышенной чувствительности) и т. д.
Помимо костей, метастазы рака простаты часто развиваются в лимфоузлах. Выделяют поражение ближайших лимфатических узлов и отдалённых. Если опухоль распадается и продукты её распада разносятся по организму, метастазы могут появиться в любом лимфатическом узле. Увеличенные лимфоузлы сдавливают органы, что приводит к нарушению их работы и характерным проявлениям. Симптомы зависят от того, где именно локализовались очаги опухоли.
Диагностика рака предстательной железы
Пальцевое исследование предстательной железы через прямую кишку (задний проход) долгое время являлось основным и чуть ли не единственным методом диагностики рака простаты. Метод не потерял своего значения и на сегодняшний день. Специфической характеристикой РПЖ при ректальном исследовании является плотность узлов в одной или двух долях предстательной железы, доходящая до так называемой «каменистости». Однако низкий процент выявления первичного рака простаты (меньше 6% по последним данным), при развитии более информативных методов, постепенно сводит диагностическую ценность метода к минимуму. Кроме того, пальцевое исследование приводит к ложному повышению уровня простатического специфического антигена в результате вынужденной стимуляции предстательной железы. [11] [12]
Простатический специфический антиген (ПСА) является онкомаркером рака предстательной железы и обладает высокой чувствительностью и хорошей специфичностью в отношении данного процесса. ПСА — это белок гликопротеин, который может вырабатываться только эпителием простаты. При раке он старается блокировать развитие клеток эндотелия простаты.
В норме содержание ПСА в крови равно 4,0 нг/мл. Значения 4,0-10,0 нг/мл являются промежуточными (так называемая «серая зона»), а более 10,0 нг/мл — диагностически значимые. ПСА является калликреиноподобной сериновой протеазой, секретируемой клетками эпителия предстательной железы. Этот маркер считается не опухолеспецифическим, а органоспецифическим, в связи с этим сывороточный уровень ПСА может увеличиваться не только при раке простате, но и при доброкачественной гиперплазии предстательной железы, хроническом простатите, а также при любой стимуляции предстательной железы. [13]
Простатический специфический антиген 3 (ПСА 3) (PCA 3 (Prostate Cancer Gen 3) важен при решении вопроса о повторной биопсии после отрицательного результата первоначально проведённого исследования. PCA — наиболее значимый новый биомаркер. Антиген определяется в моче после 3-кратного массажа предстательной железы во время ректального исследования. Показатель РСА 3 превосходит чувствительность общего ПСА и свободного ПСА. Показатель РСА 3 стоит применять вместе с ПСА и иными клиническими факторами риска в номограммах или других системах стратификации риска для того, чтобы принять решение о проведении первичной или повторной биопсии. Считается, что уровень РСА 3 повышается с увеличением объёма РПЖ. [14]
Индекс здоровья простаты (показатель PHI — Prostate healthindex). Его определение основано на определении фракции свободного ПСА (-2проПСА). [15]
Инструментальная диагностика
Ультразвуковое исследование рака предстательной железы (трансректальное УЗИ предстательной железы, ТРУЗИ). Эхографическая диагностика рака предстательной железы неоднозначна. Классическая ультразвуковая картина представлена гипоэхогенными очаговыми зонами в периферических отделах предстательной железы. С увеличением площади опухолевых очагов эти зоны содержат как гипо-, так и гиперэхогенные участки. 40 % опухолей предстательной железы, которые диагностированы при биопсии, представлены изоэхогенными участками. [16]
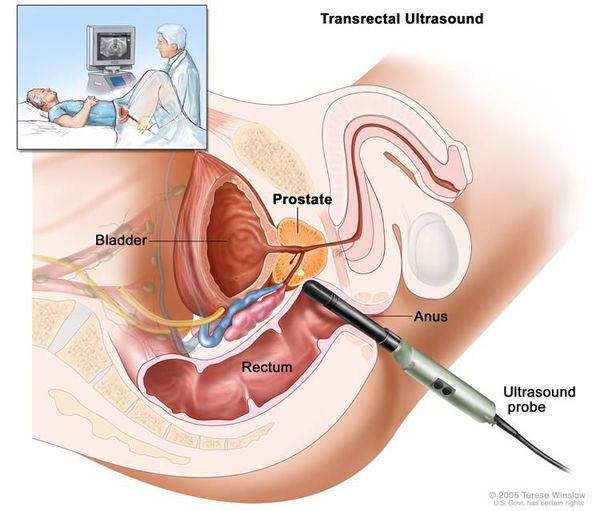
ТРУЗИ проводится для решения двух первоочерёдных задач:
- Выявление патологических участков в предстательной железе, в которых подозревается рак;
- Повышение точности трансректальной биопсии предстательной железы.
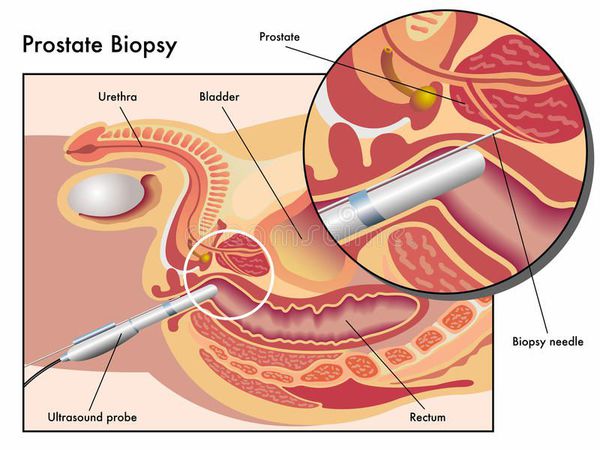
Биопсия простаты — самый точный метод диагностики рака предстательной железы. Стандартная методика выполнения биопсии предстательной железы — трансректальная биопсия под контролем трансректального УЗИ, которая обязательно выполняется, как минимум, из 12 точек. Проводится по результатам одного из трёх методов диагностики: пальцевого ректального исследования, определения концентрации ПСА в сыворотке крови и ТРУЗИ. [17]
Магнитно-резонансная томографии (МРТ) предстательной железы является наиболее чувствительным методом диагностики экстрапростатической инвазии опухоли, а применение динамической магнитно-резонансной простатовезикулографии с помощью контрастного усиления и эндоректальной магнитной катушки повышает точность диагностики ещё на 18%. [18]
Компьютерная томография (КТ). Выполнение КТ предстательной железы для определения стадии процесса не рекомендуется, так как КТ предстательной железы менее информативна, чем МРТ, для дифференциальной диагностики локализованного и экстрапростатического процесса. КТ чаще назначают для планирования дистанционной лучевой терапии (ДЛТ) (ссылка). [19]
Методы диагностики отдалённых метастазов. Для диагностики отдалённых метастазов рекомендуются следующие методы:
- сцинтиграфия скелета;
- УЗИ, КТ, МРТ органов брюшной полости;
- рентгенографическое исследование, КТ органов грудной клетки;
- рекомендуется определять уровень активности щелочной фосфатазы в сыворотке крови, являющейся косвенным признаком метастатического поражения скелета (выявляется у 70% больных с генерализацией процесса). [20]
Радиоизотопное исследование (сканирование) скелета применяется при первичном обследовании пациентов с высоким баллом злокачественного роста по шкале Gleason, высоким уровнем ПСА (> 10 нг/мл) и щелочной фосфатазы или при выраженном болевом синдроме (в таком случае риск костных метастазов достаточно высок).
Для радиоизотопного исследования внутривенно вводят аналог пирофосфата, объединённый с радиоактивным изотопом технеция-99.
Через три часа после введения препарата (пирофосфат + технеций-99), когда изотоп накопился в костной ткани, пациента укладывают на диагностический стол и с помощью гамма-камеры исследуют расположение радиоактивной метки в костной ткани. Обработка информации происходит с помощью компьютерной программы. Доза радиации, получаемая пациентом при обследовании, очень мала и безопасна.
Лечение рака предстательной железы
Радикальная простатэктомия (РПЭ) — полное удаление простаты
Хирургическое вмешательство в объёме полной простатэктомии является наиболее радикальным методом лечения. Большинство урологов рекомендуют радикальную простатэктомию как метод выбора при лечении локализованного рака предстательной железы. Под таким оперативным лечением подразумевается удаление предстательной железы с семенными пузырьками и участком мочеиспускательного канала. Целью операции при локализованном и некоторых вариантах местно распространённого РПЖ является полное излечение пациента. В редких случаях полное удаление простаты нацелено на паллиативную помощь при лечении местно распространённого процесса, т. е. для улучшения состояния больного. В этих случаях задача операции состоит в удалении основной массы опухоли для повышения эффективности консервативного лечения.
Радикальное хирургическое лечение обычно проводится у пациентов с РПЖ локализованной формы с ожидаемой продолжительностью жизни более 10 лет.
Варианты операционного доступа при выполнении радикальной простатэктомии:
- позадилонный;
- промежностный;
- лапароскопический (с помощью робота).
Показания к радикальной простатэктомии:
- опухоли T1a G1-G2 при ожидаемой продолжительности жизни более 15 лет; опухоли T1a G3; опухоли T1b-T2с; опухоли Т3а; ограниченная экстракапсулярная инвазия.
Преимущества радикальной простатэктомии перед консервативными методами лечения:
- полное удаление интракапсулярной опухоли;
- точное определение стадии опухолевого процесса;
- излечение сопутствующей доброкачественной гиперплазии предстательной железы, имеющей клинические проявления. [21]
В последние несколько лет стала широко применяться лапароскопическая радикальная простатэктомия, которую можно выполнить чрезбрюшинным или внебрюшинным доступами. Применение данной техники позволяет снизить число осложнений и ускорить процесс реабилитации больных.
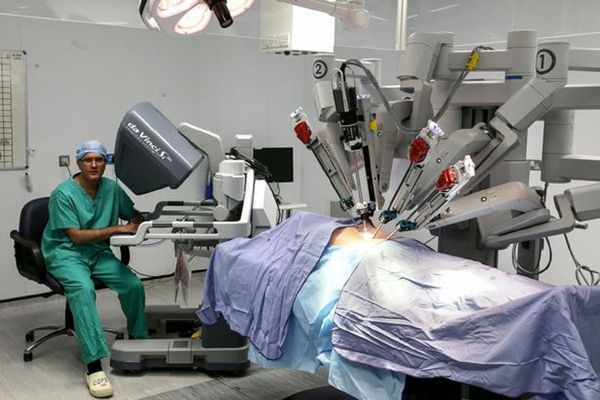
Один из вариантов лапароскопической операции — робот-ассистированная радикальная простатэктомия (согласно материалам Guidelines EAU 2015 года — клинического руководства Европейской ассоциации урологов). Робот-ассистированная радикальная простатэктомия (РАРП) активно «вытесняет» РПЭ в качестве «золотого стандарта» оперативного лечения локализованного рака простаты во всём мире. [22] При РАРП, по сравнению с РПЭ, достоверно уменьшается объём кровопотери, имеются преимущества при оценке восстановления удержания мочи и эректильной функции. [14]
Лучевая терапия (ЛТ)
Как и простатэктомия, лучевую терапию относят к радикальным методам лечения локализованного рака простаты. При местно распространённом РПЖ, ЛТ проводят для того, чтобы улучшить выживаемость больных, и чаще в сочетании с гормонотерапией. Цель лучевой терапии — максимально точное достижение терапевтической дозы ионизирующего излучения в ткани предстательной железы при условии минимального лучевого воздействия на окружающие органы и ткани. [23]
Брахитерапия (внутритканевая ЛТ) — имплантация радиоактивных источников в ткань предстательной железы. Для терапии РПЖ применяется постоянная (низкодозная) и временная (высокодозная) брахитерапия. Для временной брахитерапии применяют изотоп 192 Ir. Удаление радиоактивных игл осуществляется после подведения необходимой дозы к предстательной железе. Высокодозную брахитерапию применяют при местно распространённом РПЖ (T3 N0 M0), комбинируя с дистанционным облучением. При локализованном РПЖ чаще применяют постоянную брахитерапию: в предстательную железу вводятся радиоактивные гранулы 125I (период полураспада — 60 дней) или 103Pd (период полураспада — 17 дней). Более локализованное распределение ионизирующего излучения при брахитерапии позволяет подвести более высокую дозу облучения к предстательной железе с меньшим лучевым воздействием на окружающие ткани, чем при проведении дистанционной ЛТ. Внедрение радиоактивных источников производится через промежность под контролем трансректального УЗИ. Доза облучения при имплантации 125I составляет 140-160 гр, при имплантации 103Pd — 115-120 гр. [24]
Минимально инвазивные методы лечения РПЖ
К минимально инвазивным методам лечения РПЖ относятся криоабляция простаты и абляция предстательной железы с помощью высокоинтенсивного сфокусированного ультразвука — HIFU (англ. High Intensity Focused Ultrasound). Криоабляция простаты — хорошо изученный альтернативный метод терапии РПЖ, в то время как метод HIFU до конца не изучен. Фокальная терапия РПЖ с помощью различных методик, таких как криоабляция, ультразвуковая или лазерная абляция и пр.) активно изучается во многих клиниках. [14]
Гормональная терапия
Гормонотерапия, в качестве самостоятельного способа лечения РПЖ, рекомендуется с паллиативной целью. В то же время назначение гормональных препаратов может быть показано в сочетании с радикальным оперативным или лучевым лечением в качестве комбинированной противоопухолевой терапии. Основой механизма действия эндокринного лечения является снижение концентрации тестостерона в клетках предстательной железы, реализованное одним из следующих способов:
- подавление яичками секреции андрогенов (снижается концентрация сывороточного тестостерона);
- конкурентное взаимодействие с андрогенными рецепторами в ядрах клеток предстательной железы (снижается внутриклеточная концентрация тестостерона, уровень сывороточного тестостерона не уменьшается).
К методам гормонотерапии относят:
- двустороннюю орхидэктомию (удаление обоих яичек);
- терапию агонистами лютеинизирующего гормона рилизинг-гормона (ЛГРГ) — используются препараты гозерелин, лейпрорелин, трипторелин, бусерелин;
- терапию антагонистами ЛГРГ (дегареликс);
- эстрогенотерапию (диэтилстильбэстрол);
- максимальную (комбинированную) андрогенную блокаду;
- монотерапию антиандрогенами (стероидные — ципротерон, мегестрол и хлормадинон; нестероидные — бикалутамид, флутамид, нилутамид). [14][25]
Гормональные препараты других классов
Рекомендуется принимать кетоконазол — противогрибковый препарат, угнетающий синтез андрогенов надпочечников. Применяют в качестве второй линии гормональной терапии метастатического РПЖ на фоне прогрессирования процесса после проведения максимальной андрогенной блокады. Кетоконазол назначают внутрь в дозе 400 мг 3 раза в сутки.
Иммунотерапия рака простаты
Иммунная терапия рака предстательной железы активирует лимфоциты, способные уничтожить раковые клетки. Мишень — антигены, характерные для рака простаты. Это, прежде всего, PSA, а также простатическая фосфатаза и простатспецифический мембранный антиген (PSMA). При иммунологическом лечении злокачественных опухолей простаты применяются дендритно-клеточные вакцины, вакцины клеток всей опухоли, векторсвязанные вакцины и моноклональные антитела.
На сегодняшний день появились новые лекарственные средства, которые могут стать препаратами первой линии лечения данного заболевания. Абиратерон (Zytiga) — препарат, утверждённый в Израиле и предназначенный для лечения кастрат-резистентного рака предстательной железы. Проствак, как вакцина, стимулирует иммунитет для мобилизации организма на борьбу с раковыми клетками. Выживаемость пациентов с тяжёлыми формами рака простаты, принимающих проствак, повышается с 16-ти месяцев до 24-х. Алфарадин — радиофармпрепарат, выделяющий радиоактивные альфа-частицы, они локально воздействуют на метастазы. Деносумаб защищает кости при возникновении метастаз, препятствуя выводу кальция из костей, притормаживая развитие метастатического процесса в 5 раз эффективнее других препаратов. [14]
Химиотерапия рака простаты
На начальных этапах рака простаты химиотерапия малоэффективна. Это связано с тем, что злокачественные опухолевые клетки предстательной железы растут так же, как и здоровые. Цитостатики же действуют исключительно на быстрорастущие клеточные структуры. Чаще всего противоопухолевые препараты назначаются на III–IV стадии болезни — при больших размерах первичной опухоли, сильной боли, метастазах и наличии нескольких очагов в костной ткани.
Преимущество противоопухолевых химиопрепаратов — это возможность использовать их при агрессивных опухолях предстательной железы, которые уже дали метастазы и не могут быть удалены хирургически. В сочетании с операцией и гормональными препаратами химиотерапия позволяет стабилизировать или улучшить состояние пациента.
Химиотерапия заключается во внутривенном введении специальных химиотерапевтических средств. В среднем один цикл химиотерапии при раке простаты длится 1–4 недели. При раке предстательной железы применяется Доцетаксел с Гозерелином, Бусерелином и Трипторелином.
При неэффективности Доцетаксела или устойчивости к нему применяется Кабазитаксел (Джевтана). Результаты исследований показали, что этот химиопрепарат гораздо эффективнее Митоксантрона, который ранее выбирался для замены Доцетаксела.
Химиотерапевтические препараты останавливают деление злокачественных клеток, замедляя или полностью останавливая рост опухоли. В то же время эти препараты вызывают тяжёлые побочные эффекты, такие как:
- снижение уровня лейкоцитов и иммунитета;
- анемия, ухудшение свёртываемости крови и предрасположенность к кровотечениям;
- тошнота, рвота и диарея; и язвы в ротовой полости;
- ухудшение аппетита, вкусовые нарушения; ;
- общая слабость и быстрая утомляемость;
- задержка жидкости и отёки;
- периферическая нейропатия.
Виротерапия
Вирусотерапия рака предстательной железы исследуется учёными и считается перспективным направлением [27] . Однако для лечения пациентов этот метод пока не используется.
Спасительная терапия
У всех пациентов с метастатическим процессом в костях, получающих терапию на основе доцетаксела, наблюдалось прогрессирование. В связи с этим были проведены многочисленные исследования, связанные с изучением роли спасительной терапии. Результаты этих исследований показали, что терапия кабазитакселом, интермиттирующая химиотерапия доцетакселом и молекулярно-направленная терапия — наиболее приемлемые режимы лечения. В настоящее время эти методики не рекомендуются в связи с малым количеством рандомизированных исследований.
Методы паллиативной терапии
- Терапия, направленная на лечение поражений костной системы при кастрационно-резистентном раке предстательной железы
У большинства пациентов с костно-распространённым раком предстательной железы с (КР РПЖ), костные метастазы сопровождаются выраженным болевым синдромом. Два радиоизотопа, Sr-89 и Sа-153, способны уменьшить или купировать боль в костях у 72 % пациентов. У больных с костными метастазами, которые сопровождаются болевым синдромом, применение Rа-233 оказалось весьма эффективным.
Осложнения, вызванные костными метастазами, выражаются в болевых ощущениях в костях, разрушении позвонков, деформирующих патологических переломах и компрессии спинного мозга. Ещё одна причина патологических переломов — остеопороз, поэтому необходимо проведение его профилактики.
Применение костного цемента — продуктивный метод лечения патологических переломов, который позволяет значительно уменьшить болевые ощущения и повысить качество жизни. При возникновении подозрения на существование компрессии спинного мозга необходимо как можно скорее назначить высокие дозы кортикостероидов и выполнить МРТ.
Бифосфонаты используются для торможения резорбции костной ткани. При применении золедроновой кислоты было отмечено увеличение времени до появления первого скелетного осложнения, что улучшало качество жизни пациентов. В настоящее время бифосфонаты показаны пациентам с КР РПЖ с костными метастазами для профилактики скелетных осложнений, хотя однозначного оптимального интервала между приёмами не существует (на данный момент он составляет 3 недели или менее).
Всегда стоит помнить о том, что у этих препаратов существуют побочные эффекты, в особенности у амино-бисфосфонатов (например, некроз верхней челюсти). Бисфосфонаты назначают на раннем этапе лечения КР РПЖ с клиническими проявлениями. При дополнительной системной терапии обнаруживают методы устранения возможных побочных эффектов — болевого синдрома, запора, отсутствия аппетита, тошноты, усталости, депрессии, которые развиваются при проведении паллиативного лечения. Терапия включает в себя паллиативную ДЛТ, кортизон, анальгетики и противорвотные средства.
- Ингибиторы лиганд RANK-рецептора-активатора ядерного фактора
Деносумаб — моноклональное антитело человека, направленное против рецептора-активатора ядерного фактора В-лиганда, является ключевым медиатором образования остеокластов (больших многоядерных клеток). У пациентов с КР РПЖ стадии М0 деносумаб привёл к увеличению показателя выживаемости без костного метастазирования по сравнению с плацебо. При проведении третьей фазы лечения было отмечено, что эффективность и безопасность деносумаба сопоставима с золедроновой кислотой у пациентов с метастатическим КР РПЖ. Деносумаб разрешён к применению Управлением по контролю качества пищевых продуктов и лекарственных средств США для профилактики скелетных осложнений у пациентов с костными метастазами, обусловленными наличием раковых опухолей.
После терапии доцетакселом, при прогрессии РПЖ рекомендовано применение кабазитаксела.
Рейтинг ведущих онкоцентров России:
- Российский онкологический научный центр им. Н.Н. Блохина РАМН, Москва.
- Городская клиническая больница имени С.П. Боткина, Москва.
- Клиническая больница № 85 ФМБА России, Москва.
- Онкологический центр ЛДЦ МИБС в Санкт-Петербурге.
- Клиника «К+31», Москва.
- Лечебно-диагностический центр (ЛДЦ) «ПАТЕРО КЛИНИК», Москва.
- Клинический госпиталь на Яузе, Москва.
Рейтинг ведущих зарубежных клиник, специализирующихся на лечении рака предстательной железы:
- Университетская клиника Кёльна.
- Университетская клиника «Рехтс дер изар», Мюнхен.
- Клиника «Вивантес Нойкёльн», Берлин.
- Академическая клиника «Асклепиос Бармбек», Гамбург.
- Медицинский центр «Рамбам», Хайфа (Израиль).
- Клиника «Вивантес Ам Урбен» Берлин.
- Клиника «Ленокс-Хилл», Нью – Йорк.
- Урологический центр в Алабаме (США).
- Бостонский медицинский центр (США).
- Клиника «Хирсланден перманенс» (Швейцария).
Далее рассмотрим осложнения различных методов лечения РПЖ.
Осложнения радикальной простатэктомии:
- смертность — 0-1,3%;
- травма прямой кишки — 0,5-2,8%;
- повреждение мочеточника — 0,3%;
- тромбоз вен нижних конечностей — 1,2-1,5%;
- тромбоэмболия лёгочной артерии — 0,6-1,4%;
- острый инфаркт миокарда — 0,4-0,7%;
- недержание мочи — 0,8-12%.
Нарушение эрекции может развиваться у всех больных после выполнения радикальной простатэктомии, не применяя при этом нервосберегающую технику. Для того, чтобы сохранить эректильную функцию, разработана техника операции, позволяющая сохранить кавернозные нервно-сосудистые пучки.
Осложнения дистанционной лучевой терапии:
- недержание мочи — 0,2-1,5 %;
- эректильная дисфункция — 54-66%;
- диарея — 1,4-7,7%;
- стриктуры уретры — 2,6-11,0%;
- гематурия — 2,5-10,0%:
- ректальное кровотечение — 2,5-14,2%.
Осложнения эстрогенотерапии:
- тромбоэмболические осложнения;
- сердечно-сосудистые осложнения;
- отёки;
- эректильная дисфункция;
- гинекомастия и болезненность грудных желёз;
- гастрологические расстройства (боль, тошнота, рвота). [26]
Прогноз. Профилактика
Классификация прогностических факторов риска по DAmico
По этой классификации учитывается вероятность прогрессирования рака на начальных стадиях до проявления клинических симптомов и летального исхода, а также риск возникновения рецидивов после локализованного лечения рака.
По классификации рака предстательной железы DAmico, пациентов относят к одной из трёх групп прогрессирования болезни: низкой, средней или высокой. Для оценки берутся следующие показатели:
- классификация рака по системе ТNM, а именно показатель Т — распространенность первичной опухоли;
- степень рака простаты по шкале Глисона;
- уровень простат-специфического антигена в крови (ПСА).
В группу низкого риска относятся пациенты, у которых уровень ПСА ≤ 10 нг/мл, шкала Глисона ≤ 6 баллов, клиническая стадия — T1-2a. К группе среднего риска относят пациентов, у которых уровень ПСА 10-20 нг/мл, шкала Глисона — 7 баллов, клиническая стадия — T2b. К группе высокого риска относят пациентов, у которых уровень ПСА > 20 нг/мл, шкала Глисона ≥ 8 баллов, клиническая стадия — T2c-3a.
Прогнозирование по таблицам Алана Партина (номограммам)
Таблицы Партина представляют собой шкалы, в которых учитываются математические модели, высчитанные на основании значения уровня ПСА, баллов по шкале Глисона и клинической стадии рака простаты по классификации по системе ТNM. График Партина позволяет сделать прогноз дальнейшей прогрессии заболевания. Номограммы составлялись на основании исследования данных о мужчинах, которые проходили лечение рака предстательной железы. Таким образом, базируясь на этих данных, были составлены таблицы, которые делятся следующим образом:
- степень рака простаты — от Т1с до Т2с;
- по уровню ПСА в крови выделяют следующие категории: 0-10 нг/мл и более 10,0 нг/мл;
- баллы шкалы Глисона делятся на 3 категории: 2-4, 5-6 или 8-10.
Вот так выглядят модифицированные номограммы Партина, по которым можно определить вероятность дальнейшего прогрессирования рака простаты:
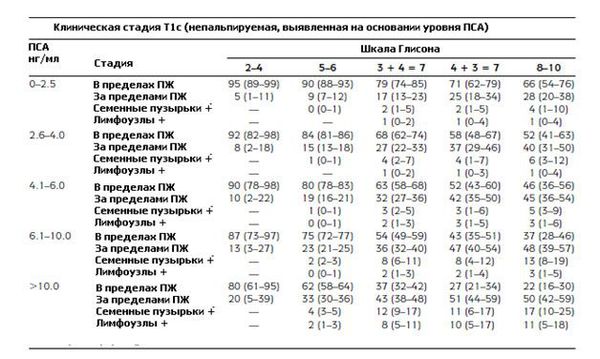
Прогноз выживаемости при раке простаты
Прогноз определяется стадией, на которой выявлен рак, а также степенью дифференцировки опухоли и уровнем простатического специфического антигена (ПСА). Пятилетняя выживаемость без рецидивов пациентов с I–II стадией после радикальной простатэктомии и лучевой терапии составляет 70–90 %, общая выживаемость — 85–97 %. При выявлении рака на стадии метастазов средний период до прогрессирования болезни на фоне лечения составляет 2–3 года [28] .
Профилактика
— Ежегодное урологическое обследование после 50 лет, а мужчин с генетической предрасположенностью — после 40 лет по стандартной программе обследования, включающее:
- анализ крови на ПСА, при необходимости — анализ на ПСА-3 в моче;
- пальцевое ректальное исследование простаты;
- ТРУЗИ.
— Правильное сбалансированное питание:
- с содержанием веществ, способных замедлить рак предстательной железы: прежде всего ликопена (содержится в арбузе, томатах, розовых грейпфрутах), катехина (содержится в зелёном чае) и фитоэстрогенов (имеются в чечевице, чесноке, горохе, шишках хмеля, календуле и бобовых растениях);
- употребление свежих овощей и фруктов, богатых клетчаткой;
- минимизация потребления жиров животного происхождения;
- имеет значение употребление свежевыжатых соков: морковного, свекольного, гранатового, яблочного и апельсинового;
- достаточное потребление хлеба с отрубями и из муки грубого помола;
- употребление риса, пшеницы и других круп, бобовых и сои;
- приём растительных масел первого «холодного» отжима (оливковое, кедровое, грецкого ореха и др.).
— Отказ от вредных привычек: курения, алкоголя, наркотиков.
— Физическая активность.
Одним из основных факторов, способствующих развитию болезни, является образ жизни. Умеренные физические нагрузки на свежем воздухе — бег трусцой, ходьба, плавание, езда на велосипеде — улучшают иммунитет, устраняют гиподинамию как фактор развития рака простаты, усиливают кровообращение малого таза мужчины.
Источник https://radiosurgery.ldc.ru/stati/protonnaya-terapiya-i-sovremennoe-lechenie-raka-prostaty
Источник https://rakanet.ru/rak-prostaty/lechenie-raka-prostaty/
Источник https://probolezny.ru/rak-predstatelnoy-zhelezy/