Лимфома Ходжкина
Лимфома Ходжкина (болезнь Ходжкина или лимфогранулематоз) – злокачественное заболевание лимфатической системы.
Причины развития
Лимфома Ходжкина (ЛХ) возникает из-за злокачественного изменения (мутации) В-лимфоцитов. В-лимфоциты — это белые кровяные клетки крови, которые находятся в основном в лимфатической ткани. Поэтому лимфома Ходжкина может развиваться везде, где есть лимфатическая ткань, также она может поражать и другие органы (печень, костный мозг, лёгкие и/или селезёнку).
Распространенность
- Лимфома Ходжкина занимает 5-е место в структуре заболеваемости у детей и подростков и состаляет 5-7%.
- Заболеваемость лимфогранулематозом в России составляет 0,8 на 100 тыс. детского населения.
- Наиболее часто болеют дети и подростки старше 11 лет.
- В детском и подростковом возрасте мальчики болеют немного чаще, чем девочки, соотношение по полу составляет 1,6 : 1 (мальчики : девочки).
Формы
Морфологическим субстратом опухоли являются клетки Березовского-Штенберга-Рид, однако, их количество в опухолевой ткани редко превышает 10%. Второй вариант клеток – клетки Ходжкина, которые являются провариантом клетки Березовского-Штенберга-Рид. В зависимости от того, как выглядит ткань опухоли под микроскопом, выделяют пять форм лимфомы Ходжкина.
- Вариант болезни Ходжкина с лимфоцитарным преобладанием составляет 5-6% от всех случаев ЛХ. Клеток Березовского-Штенберга-Рид очень мало.
- Смешанно-клеточный вариант диагностируется у трех четвертей пациентов. Клетки Березовского-Штенберга-Рид и клетки Ходжкина встречаются в достаточном количестве.
- Лимфоцитарное истощение – наиболее редко встречающийся морфологический вариант опухоли (менее 1%).
- Наиболее часто встречается вариант лимфомы Ходжкина с нодулярным склерозом.
- При нодулярном лимфоидном преобладании ткань лимфатического узла полностью или частично замещена инфильтратом нодулярного строения, часто сочетающегося с зонами диффузного роста.
Клинические стадии
Клиническая стадия определяется согласно классификации Ann Arbor (1971), дополненной рекомендациями, принятыми в Котсвольде (1989):
I стадия — поражение одной или двух группы лимфатических узлов (I) или одного нелимфатического органа (или ткани) — (IE);
II стадия — поражение двух или более лимфатических областей по одну сторону диафрагмы (II) или вовлечение одного нелимфатического органа (или ткани) и одной (или более) лимфатических областей по одну сторону диафрагмы (IIE), поражение селезенки (IIS);
III стадия — поражение лимфатической системы по обе стороны диафрагмы (III), которое может сочетаться с локализованным вовлечением одного нелимфатического органа или ткани (IIIE), или с вовлечением селезенки (IIIS), или поражением того и другого (IIIES);
IV стадия — распространенное поражение одного и более нелимфатических органов (легких, плевры, перикарда, костного мозга, костей и проч.) в сочетании или без вовлечения лимфатических узлов.
На рис. 1 представлены зоны поражения при лимфоме Ходжкина.
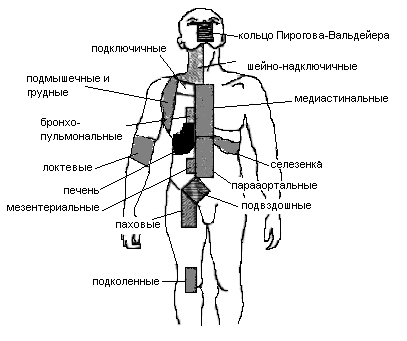
Рис. 1. Зоны поражения при болезни Ходжкина
Симптомы
Первым и наиболее характерным симптомом при лимфоме Ходжкина является увеличение лимфатических узлов. Лимфатические узлы, как правило, безболезненные, плотные, подвижные, часто в виде конгломератов (напоминают «мешок с картошкой»). Наиболее часто увеличенные лимфоузлы можно заметить на шее (рис. 2), в области подмышек, рядом с ключицей, в паху или одновременно в нескольких местах. Лимфатические узлы могут увеличиваться и там, где их нельзя прощупать, например, в грудной клетке, животе, в области таза.
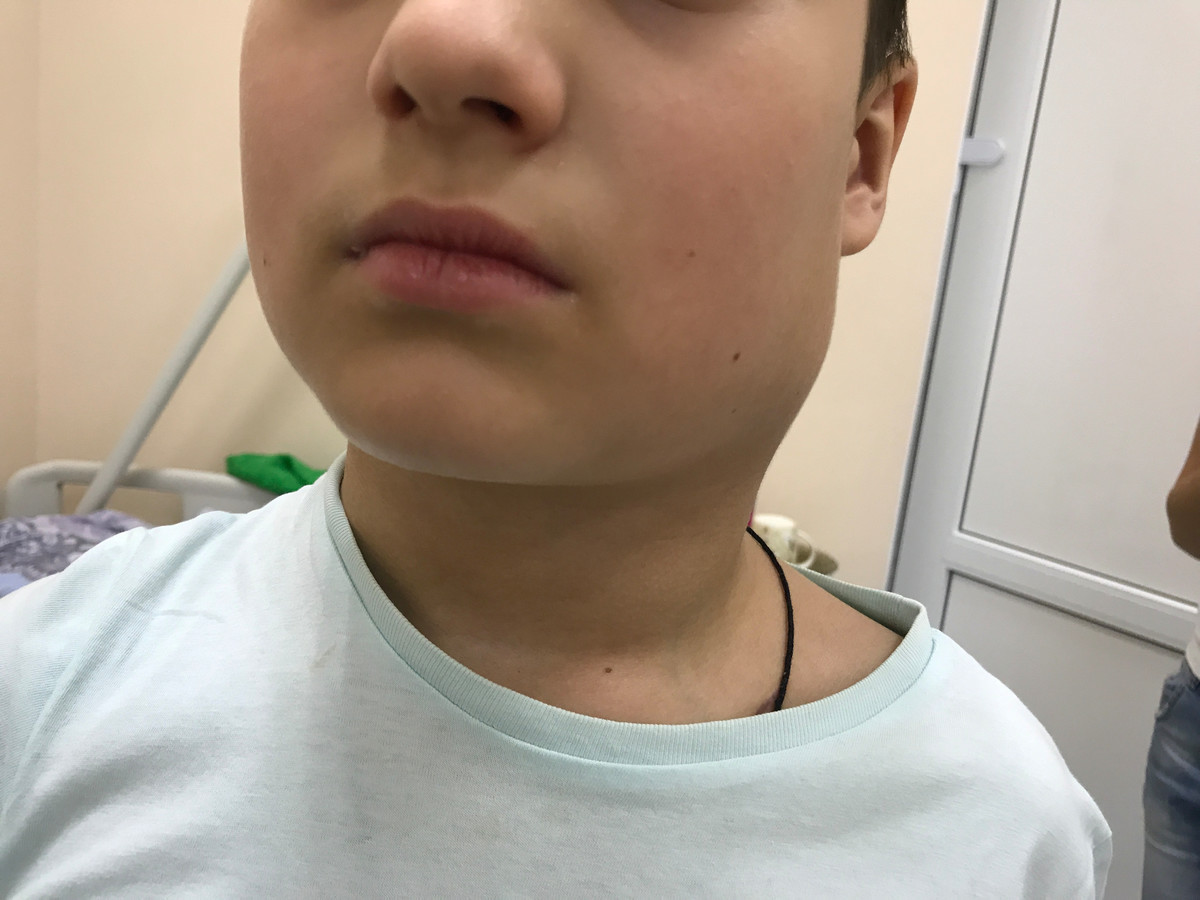
Рис. 2. Поражение шейных лимфатических узлов при лимфоме Ходжкина.
Если увеличенные лимфоузлы находятся в грудной клетке (средостении) (рис. 3), могут появляться приступы кашля или одышка.
Иногда увеличиваются печень и селезенка (в медицинской практике это называется гепатомегалия и спленомегалия).
Поражение ЦНС может развиться в далеко зашедших случаях лимфомы Ходжкина.
Поражение костей: чаще поражаются позвонки, тазобедренные суставы.
Вовлечение костного мозга встречается в 5-10% случаев болезни Ходжкина.
У детей могут появляться общие симптомы заболевания: повышение температуры тела выше 38°С в течение трех дней без признаков инфекционных заболеваний, сильные ночные поты, потеря веса более, чем на 10% за последние 6 месяцев без видимой причины, утомляемость, слабость, кожный зуд по всему телу. Эти симптомы в медицинской практике называют В-симптомами и обозначают буквой «В», их используют в определении стадии заболевания.
Для стадирования необходимо учитывать биологическую активность заболевания. Определяется она на основании двух и более следующих показателей: СОЭ ≥ 30 мм/час; фибриноген ≥ 4 г/л; альбумин ≤ 40 %; СРБ (++ и более); число лейкоцитов ≥ 12х10 /л; альфа-2-глобулин ≥ 12%
Диагностика
Если после тщательного осмотра педиатр находит признаки лимфомы Ходжкина, то он дает направление в специализированный стационар (клинику детской онкологии и гематологии).
В стационаре проводятся:
- Исследование пораженной ткани. Основным методом диагностики лимфомы является биопсия (оперативное удаление пораженного лимфатического узла или ткани и изучение материала под микроскопом). По результатам исследования образца ткани можно точно определить, болен ребенок лимфомой Ходжкина, и если да, то каким именно ее видом.
- Анализ распространенности болезни в организме. После установления диагноза необходимо выяснить, насколько болезнь успела распространиться по организму и какие органы она успела поразить. С этой целью выполняют ПЭТ-КТ всего тела с глюкозой. По показаниям проводят исследование костного мозга (трепан–биопсия костного мозга у больных с IВ, IIB-IV стадиями), остеосцинтиграфию, МРТ при костных поражениях.
- Если в анамнезе имеется сердечно-сосудистая патология, выслушивается сердечный шум, выполняется ФВЛЖ (функция выброса левого желудочка).
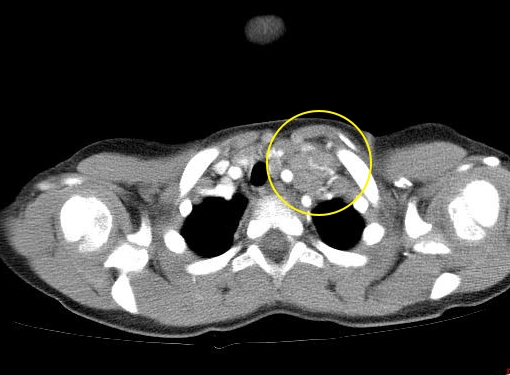
Рис. 3. Поражение внутригрудных лимфатических узлов при лимфоме Ходжкина
Современные подходы к лечению
Основное место в лечении лимфомы Ходжкина занимает химиотерапия.
Химиотерапия – это лечение лекарственными препаратами (цитостатиками), которые блокируют деление или убивают опухолевые клетки. Максимального эффекта можно добиться используя комбинации цитостатиков (полихимиотерапия — ПХТ), которые по-разному действуют на клетки.
Полихимиотерапия проводится в соответствии с группой риска, в которую отнесен больной при первичном стадировании, в специализированном стационаре.
Первый цикл ПХТ начинается сразу же после подтверждения диагноза и установления стадии, в случае проведения оперативного лечения полихимиотерапия начинается через 5 дней после операции.
После химиотерапии проводится лучевая терапия (облучение) пораженных зон. Лучевая терапия должна начинаться в течение 14 дней от окончания химиотерапии при нормальных показателях крови.
В России сегодня используются две основные программы лечения лимфомы Ходжкина: DAL-HD и СПбЛХ. Оба протокола включают в себя полихимиотерпию и завершающую лучевую терапию. Количество циклов ПХТ зависит от стадии болезни и от выбора терапевтической группы, по которой лечат пациента. Больные обычно получают следующую программу: при благоприятных вариантах (1-я группа риска) – 2 цикла химиотерапии, при промежуточном прогнозе (2-я группа риска) – 4 цикла химиотерапии, при неблагоприятных вариантах (3-я группа риска) – 6 циклов химиотерапии. Разделение больных на группы риска имеет некоторые отличия в зависимости от применяемого протокола.
В программе DAL-HD используются схемы OPPA/OEPA и COPP. В протоколе СПбЛХ – схемы VBVP и ABVD.
Лучевая терапия
Завершающим этапом лечения лимфомы Ходжкина является облучение всех пораженных зон лимфатических узлов. Как правило, лучевую терапию начинают через 2 недели после окончания лекарственной терапии при нормализации показателей крови.
Доза облучения зависит от полноты ремиссии после лекарственной терапии: при достижении полной ремиссии (исчезновение всех клинических и радиологических признаков заболевания) в лимфатической зоне по данным ПЭТ-КТ доза облучения составляет 20 Гр. Если размер опухоли после полихимиотерапии уменьшился на 75% и более от первоначальной опухоли и/или отмечается снижение гиперфиксации РФП по ПЭТ-КТ до 2-3 по Deauville, то доза облучения составляет 25 Гр. При уменьшении опухолевых образований менее чем на 75% и/или сохранении гиперфиксации РФП по ПЭТ-КТ 4-5 по Deauville, то дозу облучения увеличивают до 30 Гр.
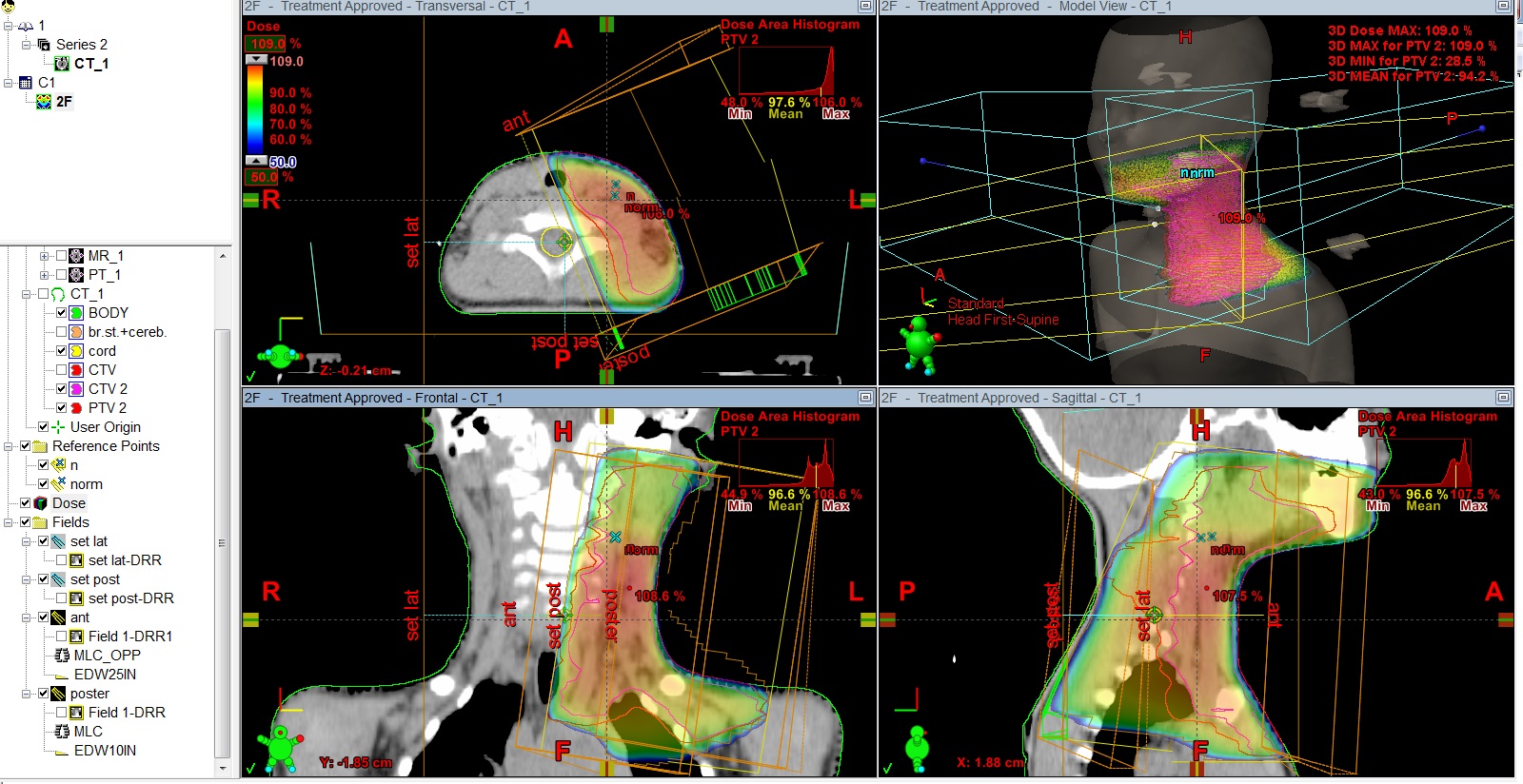
Рис.5 План лучевого лечения. Пациент И., 4 года 6 мес. Лимфома Ходжкина IIст. с поражением шейных, надключичных, подключичных л/у слева, вилочковой железы, носоглотки. Состояние после 4 курсов курсов ПХТ, ремиссия. Облучение шейно-над-подключичных л/у слева с консолидирующей целью, СОД 20 Гр.
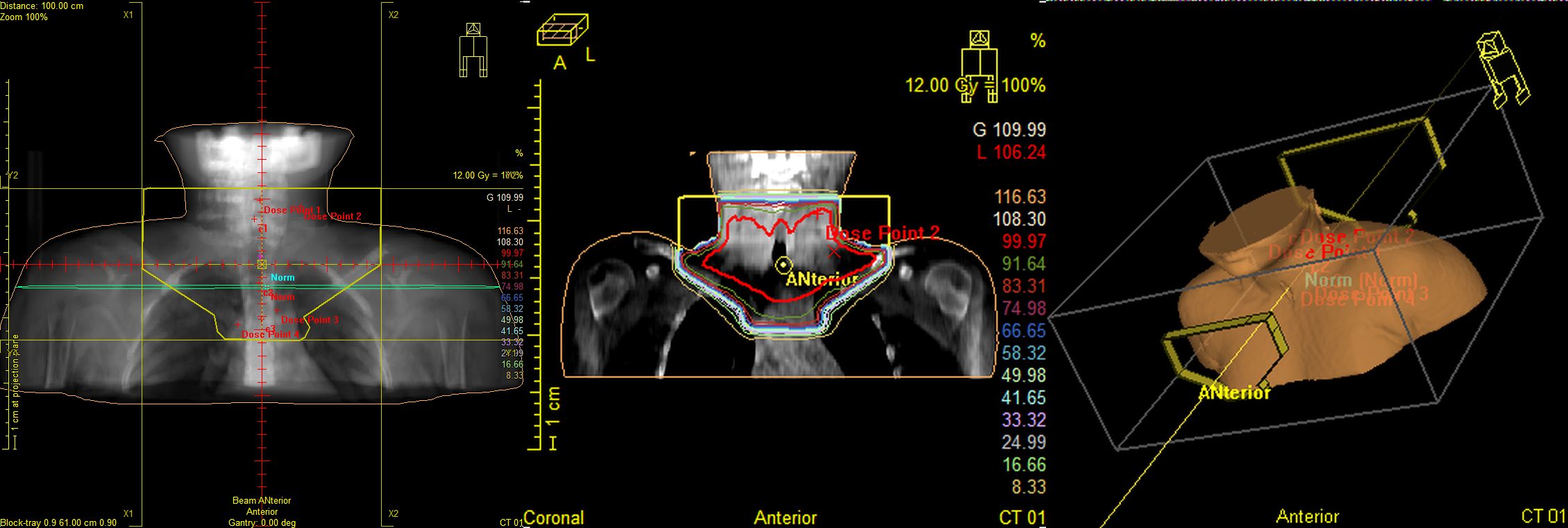
Рис.6 Пациентка М., 11лет. Лимфома Ходжкина II ст. с поражением мягких тканей шеи, лимфатических узлов шеи. Состояние после 2 курсов ПХТ. По данным контрольного ПЭТ/КТ метаболически значимых очагов не выявлено, ремиссия. Проведение лучевой терапии первично вовлеченных зон в суммарной очаговой дозе 20,0Гр с целью консолидации.
Критерии оценки полноты ремиссии
Критерии оценки ремиссии нужны врачу для определения необходимости продолжения лечения или интенсификации программ терапии, либо перевода пациента под динамическое наблюдение.
- Полная ремиссия — полный регресс всех признаков заболевания (клинических, гематологических и других проявлений болезни) по данным визуализирующих методов обследования, определяемая дважды с интервалом не менее 4 недель.
- Частичная ремиссия — уменьшение размеров опухолевых образований не менее, чем на 50% на срок от 4 недель при отсутствии новых очагов поражения.
- Стабилизация заболевания – уменьшение размеров опухолевых образований менее, чем на 50% или увеличение их не более, чем на 25% от первоначального объема при отсутствии новых очагов поражения.
- Прогрессирование — появление в процессе лечения новых очагов поражения или увеличение ранее имевшихся более, чем на 25%, а также появление симптомов интоксикации.
- Рецидив — появление новых очагов поражения после достижения полной ремиссии.
Диспансерное наблюдение
Наблюдение детей и подростков с лимфомой Ходжкина проводится в течение не менее 3-х лет после завершения лечебной программы.
В первом квартале пациент обследуется каждый месяц, в последующие 9 месяцев – каждый квартал и в последующие годы – раз в полгода.
Лимфома Ходжкина относится к числу наиболее излечиваемых онкологических заболеваний и около 80% пациентов живут более 10 лет после окончания лечения.

Авторская публикация:
КУЛЕВА СВЕТЛАНА АЛЕКСАНДРОВНА
заведующая отделением химиотерапии и комбинированного лечения злокачественных опухолей у детей, доктор медицинских наук
Что вам необходимо сделать
Если вы хотите узнать побольше о бесплатных возможностях ФБГУ НМИЦ онкологии им. Н.Н. Петрова Минздрава России, получить очную или заочную консультацию по диагностике и лечению, записаться на приём, ознакомьтесь с информацией на официальном сайте.
Если вы хотите общаться с нами через социальные сети, обратите внимание на аккаунты в ВКонтакте и Одноклассники.
Лимфома Ходжкина
Лимфома Ходжкина – опухоль лимфатической системы, определяющим морфологическим субстратом которой являются гигантские многоядерные клетки Рид-Штернберга (производные В-клеток герминальных центров лимфоидного фолликула) и одноядерные клетки Ходжкина, обычно располагающиеся в своеобразном клеточном скоплении – «гранулеме», образованной смесью опухолевых и неопухолевых реактивных клеток: лимфоцитов, нейтрофилов, плазмоцитов, иногда окруженных волокнами коллагена [1].
КЛИНИЧЕСКИЙ ПРОТОКОЛ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
ЛИМФОМА ХОДЖКИНА
Код(ы) МКБ-9.10.11:
| МКБ-10 | МКБ-9 | ||
| Код | Название | Код | Название |
| С 81. | Лимфома Ходжкина | 40.11 | Биопсия лимфатической структуры |
| С 81.0 | Лимфома Ходжкина, лимфоидное преобладание | 40.21 | Иссечение глубокого шейного лимфатического узла |
| С 81.1 | Лимфома Ходжкина, нодулярный склероз | 40.23 | Иссечение подмышечного лимфатического узла |
| С 81.2 | Лимфома Ходжкина, смешанно-клеточный вариант | 40.24 | Иссечение пахового лимфатического узла |
| С 81.3 | Лимфома Ходжкина, лимфоидное истощение | 40.29 | Простое иссечение другой лимфатической структуры |
| С 81.7 | Другие формы Лимфома Ходжкина | 40.30 | Локальное иссечение лимфоузла |
| 41.98 | Другие манипуляции на костном мозге | ||
| С81.9 | Лимфома Ходжкина неуточненная | 40.11 | Биопсия лимфатической структуры |
| 99.791 | Заготовка стволовых гемопоэтических клеток крови для аутотрансплантации | ||
| МКБ-11* | |
| Код | Название |
| 2B30 | Лимфома Ходжкина |
| 2B30.0 | Нодулярный тип лимфоидного преобладания лимфомы Ходжкина |
| 2B30.1 | Классическая лимфома Ходжкина |
| 2B30.10 | Нодулярный склероз классической лимфомы Ходжкина |
| 2B30.12 | Смешанно-клеточный вариант (классической) лимфомы Ходжкина |
| 2B30.13 | Лимфоидное истощение (классической) лимфомы Ходжкина |
| 2B30.11 | Лимфоцитарная (Lymphocyte-rich – богатая лимфоцитами) (классическая) лимфома Ходжкина |
| 2B30.1Z | Другие формы (классической) лимфомы Ходжкина Классическая лимфома Ходжкина неуточненного типа |
| 2B30.Z | Лимфома Ходжкина неуточненная |
NB! *Использование после разрешения к применению в РК.
Дата разработки/пересмотра протокола: 2016 г. (пересмотр 2022 г).
Пользователи протокола: врачи общей практики, терапевты, онкологи, гематологи, акушер-гинеколог.
Категория пациентов: взрослые, беременные.
Шкала уровня доказательности:
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или Высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+), результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование или мнение экспертов. |

Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
— 800 RUB / 5500 KZT / 27 BYN — 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
Классификация
Классификация

Морфологическая классификация [2]:

Система стадирования Ann-Arbor в модификации Cotswold[3]:
Критерии вовлеченности (по D.Cheson соавт. в модификации) [4]:
| Локализация | Клинические признаки вовлечения | ПЭТ позитивность | Исследование | Лабораторно-инструментальные признаки вовлечения |
| Лимфоузлы | Пальпируются | + | ПЭТ/КТ | Повышение накопления ФДГ |
| — | КТ, УЗИ | Необъяснимое увеличение лимфоузлов | ||
| Селезенка | Пальпируется | + | ПЭТ/КТ | Диффузное накопление, солитарное образование, милиарные очаги, узелки |
| — | КТ, УЗИ | Длинник более 13 см, образования, узелки | ||
| Печень | Пальпируется | + | ПЭТ/КТ | Диффузное накопление, образования |
| — | КТ, УЗИ | Узелки | ||
| ЦНС | Общемозговая симптоматика | — | КТ | Образования |
| — | ЯМРТ | Инфильтрация мягкой мозговой оболочки, образования | ||
| Исследование СМЖ | Цитоз по данным цитологического исследования, проточной цитометрии | |||
| Прочее (в т.ч. кожа, легкие, ЖКТ, кости, костный мозг) | В зависимости от локализации | — | ПЭТ/КТ | Накопление ФДГ |
| — | Биопсия | Выявление специфической инфильтрации |
Стратификация группы риска Лимфомы Ходжкина.
Для ранних/промежуточных стадий рекомендуется использовать шкалу GHSG [5]:
| Ранние стадии, благоприятные (EF) | Промежуточные стадии, не благоприятные (EU) |
| Стадия IA или IB и IIA или IIB по Ann-Arbor без факторов риска | Стадия IA или IB и стадия IIA с ≥1 или несколькими факторами риска. Стадия IIB, если высокая СОЭ и/ или ≥ 3 пораженных лимфатических узлов. |
Факторы риска включают:
- Наличие объемного образования средостения; масса средостения считается большой, если она составляет не менее одной трети поперечного диаметра грудной клетки.
- Экстранодальное образование, то есть любое распространение опухоли с вовлечением других тканей, кроме лимфатических узлов, селезенки, тимуса, миндалин Вальдейера, аппендикса и пейеровских бляшек.
- Высокая скорость оседания эритроцитов 50 мм/ч при наличии А-симптомов и 30 мм/ч при наличии В-симптомов.
- Поражение трех и более участков лимфатических узлов. Области лимфатических узлов не соответствуют областям лимфатических узлов согласно системе классификации Ann-Arbor (область лимфатических узлов может включать несколько областей лимфатических узлов).
| Продвинутые стадии | Стадия IIIA или IIIB. Стадия IVA или IVB. *Стадия IIB, если есть экстранодальное поражение (E-поражения) и/или большая масса средостения присутствуют в качестве факторов риска. |
| Стандартный риск Средний риск Высокий риск | 1 балл. 2-3 балла. 4-7 баллов. |
Факторы риска включают:
- Мужской пол.
- Возраст ≥45 лет.
- Стадия IV.
- Лейкоцитоз ≥15*10 9 /л.
- Лимфопения < 0,6*10 9 /л.
- 1 фактор=1 балл.
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ
- Решающее значение для верификации диагноза лимфомы являются гистологическое и иммуногистохимическое исследования. Дополнительные методы необходимы для определения распространенности опухолевого процесса и стратификации пациентов по группам риска [5,7].
- Жалобы, анамнез, данные физического исследования играют важную роль в диагностике и дифференциальной диагностике лимфопролиферативных заболеваний, но неспецифичны в связи с чем не относятся к диагностическим критериям. [5,7].
- Диагноз ЛХ устанавливается на основе морфологического и иммуногистохимического исследования биопсийного материала и формулируется в соответствии с пересмотренной классификацией опухолей гемопоэтической и лимфоидной тканей ВОЗ 2017 г. [5,7].
- увеличение лимфоузлов (чаще безболезненное);
- кашель без выделения мокроты – возникает за счет сдавления дыхательных путей увеличенными лимфоузлами средостения;
- отеки лица, шеи, рук – возникают за счет сдавления верхней полой вены;
тяжесть в левом подреберье – за счет увеличения селезенки; - кожный зуд, преимущественно в области увеличенных лимфоузлов, реже – по всему телу;
- повышение температуры тела, преимущественно в вечернее и ночное время;
- снижение массы тела (более 10-15 кг в течение 2-3 месяцев);
- общая слабость, повышенная утомляемость;
- усиленное потоотделение, особенно в ночное время.
Физикальное обследование
- определяется цвет кожных покровов (возможна бледность);
- при кожном зуде на коже могут быть следы расчесов;
- при пальпации определяется увеличение лимфоузлов;
- при перкуссии – возможно увеличение селезенки;
- пульс может быть учащенным, а артериальное давление – сниженным.
Лабораторные исследования:
- общий анализ крови – подсчет лейкоформулы, тромбоцитов в мазке: ОАК может быть в пределах нормы, однако может быть умеренный лейкоцитоз. Часто отмечается ускорение СОЭ до значительных цифр. Анемия наблюдается редко и является независимым неблагоприятным прогностическим признаком;
- Биохимический анализ крови – лактатдегидрогеназа, общий белок, альбумин, креатинин, мочевина, электролиты, мочевая кислота, для выявления синдрома лизиса опухоли, а также сопутствующего поражения органов;
- Гистологическое исследование биоптата лимфоузла (образования) – с целью верификации морфологической формы ЛПЗ;
- Иммуногистохимическое исследование биоптата лимфоузла (образования) – с целью верификации морфологической формы ЛПЗ.
- Гистологическое исследование гребня подвздошной кости — обязательным компонентом определения распространенности опухолевого процесса (стадии) является гистологическое исследование трепанобиоптата костного мозга. В процессе первичного обследования рекомендуется выполнять биопсию билатерально. Морфологическое исследование пунктата костного мозга не заменяет гистологическое исследование трепанобиоптата [7].
В случае изначального поражения костного мозга гистологическое исследование костного мозга (трепанобиопсия) проводиться при рестадировании.
Инструментальные исследования:
- ПЭТ/КТ – для более точного стадирования процесса в дебюте заболевания, а также адекватной оценки ответа на лечение, в том числе при подозрении на рецидив заболевания является необходимым проведение позитронно эмиссионной томографии, совмещенную с компьютерной томографией с туморотропными радиофармпрепаратами [10].
- КТ с контрастированием (органов брюшной полости, малого таза) – при невозможности проведения ПЭТ/КТ рекомендуется выполнить КТ шеи, грудной клетки, органов брюшной полости и малого таза (с контрастированием) для стадирования заболевания и уточнения наличия, размеров и распространенности опухолевых очагов [7].
- УЗИ периферических и внутрибрюшных лимфоузлов – увеличение размеров и изменение структуры лимфоузлов.
Перечень обязательных исследований на стационарном уровне для исключения абсолютных противопоказаний к началу лечения:
- ОАК с лейкоформулой, подсчетом количества тромбоцитов;
- Биохимический анализ крови (натрий, калий, кальций, глюкоза, мочевина, креатинин, мочевая кислота, общий белок, альбумин, общий билирубин, прямой, билирубин, ЛДГ, АСТ, АЛТ, СРБ, щелочная фосфотаза);
- Определение группы крови по системам АВО;
- Определение резус-фактора;
- Общий анализ мочи;
- Коагулограмма (АЧТВ, ПВ, МНО, ПТИ, фибриноген, Д-димер, Антитромбин-3);
- Определение СКФ;
- Определение маркеров вирусного гепатита В и С методом ИФА или ИХЛ;
- ВИЧ-инфекции (HIVAg/anti-HIV) методом ИФА;
- ПЦР на вирусные гепатиты В и С (качественно);
- Комплекс серологических реакций на сифилис;
- ЭКГ;
- ЭхоКГ;
- УЗИ ОБП+почек.
- Вирус Эбштейна-Барр, герпес 1-2 типа, цитомегаловирус, токсоплазмоз методом ПЦР;
- ПЦР на вирусные гепатиты В, С (количественно);
- ПЦР на СOVID-19;
- Определение КЩС и газов крови;
- Исследование спинномозговой жидкости: общий анализ ликвора+/- вирусологическое, бактериологическое исследование;
- Прямая и непрямая пробы Кумбса;
- Стандартное цитогенетическое исследование;
- Исследование методом FISH и молекулярно-генетическое исследование;
- Определение ферритина, фолаты, сывороточное железо, Витамин В12;
- ProBNP;
- Прокальцитонин;
- Антитромбин III, Д-димер;
- Для женщин фертильного возраста- тест на беременность, определение ХГЧ;
- Миелограмма;
- ИФТ периферической крови;
- Антитела к Т-лимфотропному вирусу человека I/II-IgG;
- Стандартное –цитогенетическое исследование;
- Молекулярно-генетические исследования методом FISH, ПЦР;
- HLA-типирование;
- Рентгенография придаточных пазух носа;
- Ортопантомограмма;
- Компьютерная томография грудного сегмента;
- КТ головы, шеи, ОБП с контрастированием;
- ФГДС;
- Бронхоскопия;
- Колоноскопия;
- УЗДГ сосудов (вен и/или артерий);
- Спирография;
- МРТ-головного мозга;
- УЗИ плевральной полости, периферических лимфоузлов, ОМТ, мочевого пузыря;
- Холтеровское – мониторирование ЭКГ.
Показания для консультации специалистов:
- Консультация гинеколога – беременность, метроррагии, меноррагии, консультация при назначении комбинированных оральных контрацептивов; для диагностики и лечения заболеваний репродуктивной системы;
- Консультация кардиолога – для коррекции/подбора базисной терапии при АГ, хронической сердечной недостаточности, нарушения ритма сердечной деятельности; для диагностики и лечения заболеваний ССС;
- Консультация нефролога (эфферентолог) – для диагностики и лечения заболеваний почек;
- Консультация оториноларинголога – для диагностики и лечения воспалительных заболеваний придаточных пазух носа и среднего уха;
- Консультация офтальмолога – нарушения зрения, воспалительные заболевания глаз и придатков;
- Консультация хирурга – для решение вопроса о биопсии лимфатического узла/ образования, при развитии хирургических осложнений на курсах химиотерапии, определение показаний для хирургических вмешательств;
- Консультация торакального хирурга – для определения показаний к биопсии легкого/образования средостения;
- Консультация реаниматолога – нарушение витальных функций;
- Консультация фтизиатра – диагностика туберкулеза;
- Консультация челюстно-лицевого хирурга — инфекционно-воспалительные заболевания зубо-челюстной системы.
NB! Консультации узких специалистов – по показаниям.
Диагностический алгоритм:
Диагностический алгоритм включат в себя выявление образования или увеличенных лимфоузлов с помощью методов лучевой диагностики, проведение биопсии и/или удаление выявленного образования с последующим гистологическим и иммуногистохимическим исследованиями. В зависимости от клинической ситуации перечень диагностических мероприятий может быть расширен.

Схема 1. Алгоритм диагностики лимфопролиферативных заболеваний
Дифференциальный диагноз
Таблица 1. Дифференциально-диагностические критерии ЛХ в зависимости от морфологической классификации и иммунофенотипа [2]
| Лимфома Ходжкина | ||
| Морфологическая классификация | Гистологические признаки | Иммунофенотип опухолевого субстрата |
| Лимфоидное истощение | Характеризуется преобладанием опухолевых клеток на относительно бедном реактивно-воспалительном фоне. Выделяют два гистологических варианта. В одном на фоне гистиоцитов и малых лимфоцитов преобладает фиброз. Для второго характерно формирование полей опухолевых клеток, многие из которых Штернберга —Рид с выраженным полиморфизмом. | Клетки Штернберга—Рид и их варианты в большинстве случаев экспрессируют CD30, в 75-85% случаев— CD15; РАХ5 (очень слабо) и MUM1. В 20-40 % случаев наблюдается экспрессия CD20 (обычно гетерогенная, от слабой до умеренно выраженной и интенсивной); в части случаев обнаруживают вариабельную/частичную экспрессию ОСТ-2 и ВОВ1 (обычно либо одного, либо другого антигена). Клетки Штернберга—Рид не экспрессируют CD45 и EМА. Большинство фоновых неопухолевых лимфоцитов представлены Т-клетками, преимущественно CD4+. Определение РHК ВЭБ методом гибридизации in situ дает положительный результат в 75% случаев классической лимфомы Ходжкина (смешанноклеточный вариант и вариант с лимфоидным истощением). В остальных двух подтипах классической лимфомы Ходжкина ВЭБ обнаруживают лишь в отдельных случаях. |
| Смешанно-клеточный вариант | В лимфатическом узле ткань замещена пролифератом из разрозненных клеток Ходжкина и Штернберга—Рид на фоне из смеси лимфоцитов, эозинофильных и нейтрофильных гранулоцитов, гистиоцитов и плазматических клеток. | |
| Богатый лимфоцитами | Подтип проявляется в двух вариантах – нодулярном (чаще) и диффузном (реже) Рисунок стояния лимфатического узла, как правило, стерт. Лимфоидная ткань замещена нодулярными структурами, которые образованы малыми лимфоцитами и эксцентрично расположенным атрофичным герминативным центром. В нодулярных структурах обычно обнаруживают клетки Ходжкина и Штернберга—Рид. Опухолевые клетки нередко имеют строение лакунарных и LP-клеток, обнаруживаемых в нодулярной лимфоме Ходжкина с лимфоидным преобладанием. | |
| Нодулярный склероз (grade1 grade2) | В лимфатических узлах утолщена капсула, лимфоидная ткань замещена нодулярным пролифератом, в котором фиброзные дуги и кольца окружают опухолевые узлы. Клеточный состав представлен разрозненными лакунарными клетками (иногда встречаются клетки Штернберга—Рид и Ходжкина) на фоне малых лимфоцитов, гистиоцитов, эозинофильных и нейтрофильных гранулоцитов. Опухолевые клетки могут формировать скопления, иногда возле очагов некроза. | |
| Неклассическая лимфома Ходжкина, вариант с лимфоидным преобладанием | В лимфатическом узле обычно обнаруживается пролиферат нодулярного, нодулярного и диффузного или преимущественно диффузного (лишь с единичными узлами) строения. В зависимости от степени выраженности диффузного роста и количества реактивных мелких В- и Т-клеток выделяют шесть иммуноархитектурных вариантов «неклассической» лимфомы Ходжкина. Самый распространенный вариант представлен пролифератом нодулярного строения из неопухолевых В-лимфоцитов. Узлы обычно крупные (макроузлы), с преобладанием малых лимфоцитов и разрозненных макрофагов, эпителиоидных гистиоцитов и опухолевых «клеток лимфоидного преобладания» — LP-клеток. Они находятся как в узлах, так и за их пределами. LP-клетки крупные, как правило, с мультилобулярными ядрами и несколькими мелкими ядрышками, скудной цитоплазмой. Своим строением напоминают воздушную кукурузу. Внешний вид LP-клеток может варьировать. Встречаются клетки с одним ядром и выраженным ядрышком, а также многоядерные, похожие на клетки Ходжкина и Штернберга—Рид. В лимфатическом узле, пораженном нодулярной лимфомой Ходжкина с лимфоидным преобладанием, может присутствовать очаговая фолликулярная гиперплазия, иногда с прогрессивной трансформацией герминативных центров. | LP-клетки экспрессируют маркеры В-лимфоцитов (CD20, CD79a и РАХ5), а также CD45, ОСТ2, ВОВ1, BCL6, EMA (50 % случаев). Обычно отсутствует экспрессия CD15 и CD30. Мелкие реактивные лимфоциты представлены смесью В-лимфоцитов и Т-клеток с фенотипом фолликулярных Т-хелперов с экспрессией CD3, CD4, PD-1, CD57. Клетки, экспрессирующие PD1, располагаются розетками (кольцом в один слой) вокруг LP-клеток. Сеть фолликулярных дендритных клеток в узлах экспрессируют CD21 и CD23 |
Дифференциальный диагноз и обоснование дополнительных исследований.
Таблица 2. Дифференциальная диагностика ЛХ.
| Диагноз | Обоснование для дифференциальной диагностики | Обследования | Критерии исключения диагноза |
| Лимфома Ходжкина | Немотивированная лихорадка и лимфаденопатия | ИГХ | В биоптатах лимфоузлов больных с ЛХ удается обнаружить большое количество клеток БШ, эозинофилов и гранулоцитов, при ИФТ СD30 иCD15 позитивны |
| Неходжкинские лимфомы | ИГХ | Картина лимфоузла менее полиморфна и состоит из лимфоидных элементов преимущественно высокой, промежуточной или высокой степени зрелости, многие из которых имеют свой характерный иммунофенотип и кариотип | |
| Туберкулез лимфоузлов | Цитологические и иммунологическое исследования Туберкулиновые пробы | Результаты цитологических и иммунологических обследований на наличие в организме туберкулезной палочки Туберкулиновые пробы — положительны |
Лечение (амбулатория)
Лечение (стационар)
ТАКТИКА ЛЕЧЕНИЯ НА СТАЦИОНАРНОМ УРОВНЕ
- Первичным пациентам с верифицированной кЛХ в ранних стадиях, подтвержденной ПЭТ/КТ, с благоприятным прогнозом проводится 2–4 курса полихимиотерапии по схеме ABVD [8].
- Пациентам с верифицированной кЛХ ранней стадии, ПЭТ/КТ-позитивных (4–5 баллов по шкале Deauville) после 2 курсов ABVD, рекомендуется усиление терапии – проведение дополнительно 2–4 циклов ХТ по схеме BEACOPP-эскалированный [9].
- Первичным пациентам с распространенными стадиями кЛХ без симптомов интоксикации с МПИ 0–2 при отсутствии абсолютной лимфоцитопении менее 0,6×109/л рекомендуется ПХТ по схеме ABVD [9]
- У пациентов с распространенными стадиями кЛХ, выполнивших ПЭТ/КТ до начала лечения, ПЭТ/КТ-позитивных (4–5 баллов по шкале Deauville) после 2 циклов ABVD, рекомендовано усиление терапии — BEACOPP-эскалированный (4–6 циклов) или BEACOPP-14 – 6 циклов [10,11]
- Пациентам, получающим терапию режимами BEACOPP-эскалированный, BEACOPP-14 необходимо назначение Г-КСФ для обеспечения возможности проведения последующего курса терапии в требуемые сроки [10]
- Пациентам с кЛХ, подтвержденной иммуногистохимически (CD30+), которым показано, но невозможно проведение или продолжение интенсивных программ ХТ 1-й линии, или имеющим высокий риск развития пульмонита при применении блеомицина, в качестве варианта терапии 1-й линии может быть рекомендована комбинация Брентуксимаб ведотина с ХТ по схеме AVD – режим BV-AVD [11].
- Пациентам с кЛХ, получающим в качестве 1-й линии терапии режим BV-AVD, рекомендована первичная профилактика нейтропении Г-КСФ, начиная с 1-го цикла ХТ [12,13].

Алгоритм терапии классической Лимфомы Ходжкина впервые выявленной. Рисунок 1.
- Пациентам до 60 лет в хорошем соматическом статусе (отсутствие тяжелых сопутствующих заболеваний) с рефрактерным течением заболевания (не достигнут ЧО после окончания химиотерапевтического этапа, констатировано прогрессирование), либо с первым ранним рецидивом (продолжительность ремиссии менее 1 года после завершения индукционного лечения), в первом позднем рецидиве или во втором позднем рецидиве, не получавшим в первом рецидиве высокодозной ХТ (ВДХТ) с аутоТГСК, рекомендуется проведение ХТ по любой из схем терапии 2-й линии c перспективой высокодозной терапии с аутологичной трансплантацией гемопоэтических стволовых клеток (ауто-ТГСК) [14-16].
- Пациентам c иммуногистохимически доказанной кЛХ, которым выполнена аутоТГСК, имеющим высокий риск рецидива или прогрессирования заболевания, восстановленных после ауто-ТГСК рекомендуется проведение консолидирующей терапии Брентуксимабом ведотином с целью воздействия на минимальную остаточную болезнь [17].
- резистентность к 1-й линии терапии;
- рецидив или прогрессирование лимфомы в течение 12 месяцев после окончания 1-й линии терапии;
- наличие экстранодального поражения при рецидиве до аутоТГСК.
Пациентам c кЛХ с рецидивом или рефрактерностью после аутоТГСК и брентуксимаба ведотина в качестве одной из возможных опций рекомендуется проведение терапии ниволумабом [19].
NB! Лечение препаратом проводится до прогрессирования или непереносимой токсичности. Показания для отмены препарата обсуждаются отдельно в каждой клинической ситуации по результатам обследования каждые 6 мес.
Пациентам c кЛХ с рецидивом или рефрактерностью после 3 и более линий системной терапии в качестве одной из возможных опций рекомендуется проведение терапии пембролизумабом [20].
NB! Лечение препаратом проводится до прогрессирования или непереносимой токсичности. Показания для отмены препарата обсуждаются отдельно в каждой клинической ситуации по результатам обследования каждые 6 мес.

Алгоритм терапии рефрактерной/рецидивирующей классической Лимфомы Ходжкина Рисунок 2.
- Клинический диагноз устанавливается на основании стандартных гистологических и иммуногистохимических критериев диагностики ЛХ [2]. Стадию заболевания определяют в соответствии с общепринятой классификацией Ann Arbor [3].
- Особенностью стадирования в период беременности является применение нерентгенологических методов визуализации — УЗИ периферических лимфатических узлов, брюшной полости и малого таза, средостения. При наличии показаний (синдром сдавления верхней полой вены, признаки компрессии воздухоносных путей, пищевода) выполняется МРТ [21]. В послеродовом периоде стадирование заболевания осуществляется в полном объеме по стандартному протоколу обследования при лимфомах с использованием КТ грудной клетки и брюшной полости, билатеральной трепанобиопсии.
- Ведение ЛХ во время беременности определяется сроком беременности, стадией и течением заболевания [22].
- Сочетание беременности с ЛХ в ремиссии не служит показанием к прерыванию беременности [3]
- У пациенток с ранней стадией ЛХ с небольшой опухолевой массой, отсутствием В-симптомов, желающих сохранить беременность, возможно наблюдение при контроле с интервалом в 2 — 4 недели.
- У пациенток с продвинутыми стадиями заболевания, выраженными В-симптомами, наличием осложнений от сдавления или прорастания опухолью органов и тканей, т. е. при жизненно необходимом незамедлительном начале ПХТ, рекомендуется прерывание беременности [22].
- Решение принимается на основании первичного обследования и динамического контроля 1 раз в 3 недели.
- При благоприятной клинической ситуации в процессе наблюдения за пациенткой возможна отсрочка начала лечения до послеродового периода. При наличии или возникновении экстренных показаний к началу терапии возможно проведение ПХТ по программам АВVD без существенных нежелательных эффектов для плода [23].
- Показаниями к срочному началу лечения являются быстрый рост опухоли, выраженные В-симптомы, наличие или появление таких тяжелых осложнений, как синдром сдавления верхней полой вены, плеврит, перикардит.
- Программа терапии и число курсов определяются индивидуально в каждой ситуации, с учетом срока беременности и срока до предстоящих родов, объема опухолевого поражения, наличия симптомов интоксикации и осложнений, а также соматического статуса пациентки. Применение Г-КСФ во время лечения не рекомендуется [22].
- ПХТ необходимо завершить за 3 недели до планируемых родов, чтобы роды не совпали с периодом миелотоксической цитопении у матери и плода. С учетом последующего лечения необходим отказ от лактации [3,22].
- В послеродовой период возобновление или начало ПХТ рекомендуется через 3 — 4 недели после выполнения полноценного стадирования заболевания с применением лучевых методов диагностики. Программа терапии и число курсов определяются в соответствии с протоколом терапии классической лимфомы Ходжкина в зависимости от стадии заболевания, объема опухолевого поражения Консолидирующая лучевая терапия также проводится в соответствии с протоколом лечения классической ЛХ[22].
- кЛХ у пожилых пациентов ассоциируется с худшими исходами заболевания [24]. В этой популяции чаще встречаются B-симптомы, низкая работоспособность, смешано-клеточный гистологический подтип, EBV + подтип опухоли и сопутствующие соматические заболевания [25].
- Стандартные режимы химиотерапии ассоциированы со снижением доз, токсичностью лечения, и смертностью связанной с лечением у пожилых пациентов [26,27]. Проспективные данные, оценивающие альтернативы стандартным методам лечения у пожилых пациентов ограничены. Выбор стандартной или альтернативной терапии первой линии для пожилых пациентов должен основываться на клинической оценке, с целью минимизации токсичности при максимальной эффективности.
- ХТ на основе ABVD в первой линии является стандартом терапии пожилых пациентов с кЛХ, которые достаточно сохранны для ПХТ. Однако из-за соответствующей токсичности, вызванной блеомицином, наблюдаемой у пожилых людей, получающих более 2-х циклов ABVD, блеомицин следует отменить после 2-го цикла ХТ у этой группы пациентов [27-30]. CHOP-21 является хорошо переносимым и эффективным средством для лечения пожилых пациентов с лимфомой Ходжкина [31].
- Проведение только ЛТ является опцией в лечении, когда системная химиотерапия не считается осуществимой или безопасной.
- Перечисленные ниже схемы следует рассматривать у пожилых пациентов, чтобы уменьшить/минимизировать токсичность.
- ABVD 2 курса +/- AVD 2-4 курса +/- ЛТ;
- CHOP до 6 курсов +/-ЛТ.
- Результаты лечения одинаково неудовлетворительны у пожилых пациентов с рецидивом или рефрактерным течением заболевания [32].
- Нет единого мнения относительно оптимальной схемы химиотерапии для данной группы пациентов. Рекомендуется индивидуальный выбор программы лечения в зависимости от сопутствующих заболеваний пациента [32].
- Варианты паллиативной терапии включают:
- Бендамустин;
- Брентуксимаб-ведотин;
- ЛТ;
- Ниволумаб;
- Пембролизумаб.
- НЛХЛП отличается от кЛХ и клеточным составом (лимфоцитарно-гистиоцитарные клетки), и иммунофенотипом, и клиническим поведением, и, соответственно, подходом к терапии.
- Заболевание чаще диагностируется у мужчин в возрасте 20–40 лет и неплохо поддается лечению.
- Прогноз нодулярной лимфомы благоприятный, однако у 3–5% пациентов отмечается ее трансформация в крупноклеточную В-клеточную лимфому, богатую Т-лимфоцитами. В случае рецидива крайне необходима повторная биопсия, так как есть вероятность трансформации.
- Ранее не получавшим лечение пациентам с НЛХЛП I–IIA стадии без массивного опухолевого поражения рекомендовано проведение ЛТ СОД 30 Гр и/или монотерапии ритуксимабом в режиме для ранних стадий В-клеточных неходжкинских лимфом [33,34].
- Ранее не получавшим лечение пациентам с НЛПЛХ I–II стадии с массивным опухолевым поражением и/или с симптомами интоксикации (В-симптомами) рекомендовано проведение ХТ по схеме ABVD в комбинации с ритуксимабом и ЛТ СОД 30 Гр [35].
- Ранее не получавшим лечение пациентам с распространенными (III–IV) стадиями НЛПЛХ рекомендовано применение режима R-CHOP [36].
- Пациентам с рецидивами или рефрактерным течением НЛПЛХ без признаков трансформации в диффузную В-клеточную крупноклеточную лимфому рекомендована терапия рецидивов по схемам ХТ, аналогичным схемам для лечения рецидивов кЛХ, с добавлением Ритуксимаба и дальнейшем решением вопроса о возможности аутоТГСК [37,38].
- Пациенты, рецидивирующие после ауто-ТГСК, имеют плохой прогноз с 5-летней OВ менее 30%. Ранний рецидив, IV стадия заболевания, bulky disease, возраст ≥50 лет при неэффективности ауто-ТГСК являются предикторами плохого исхода [39].
- Алло-ТГСК по-прежнему считается потенциально излечивающим вариантом терапии для пациентов с кЛХ, рецидивирующих или прогрессирующих после ауто-ТГСК. Согласно рекомендациям EBMT аллогенная (полностью совместимая) трансплантация ГСК является стандартом терапии при рецидиве ЛХ после аутоТГСК [39].
- Режим: общеохранительный.
- Диета: №15.
- ЛТ во всех программах лечения ЛХ должна быть начата в сроки от 2 до 4 недель после окончания ХТ, но не позднее 6-й недели.
- В рамках комбинированной терапии:
- ЛТ в монорежиме – обычно не применяется, только при ЛХ с лимфоидным преобладанием:
- Паллиативная ЛТ: 4-30 Гр.
Основные схемы химиотерапии
ABVD [40-42]
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Доксорубицин | 25 мг/м2 | 1 и 15 | в/в |
| Блеомицин | 10 мг/м2 | 1 и 15 | в/в |
| Винбластин | 6 мг/м2 | 1 и 15 | в/в, (суммарно не более 10 мг) |
| Дакарбазин | 375 мг/м2 | 1 и 15 | в/в |
| Курс повторяют каждые 28 сут. | |||
*при НЛХЛП Ритуксимаб 375мг/м2 при в День 0 или 1
Escalated BEACOPP [41,43]
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Этопозид | 200 мг/м2 | 1-3 | в/в |
| Доксорубицин | 35 мг/м2 | 1 | в/в |
| Циклофосфамид | 1250 мг/м2 | 1 | в/в |
| Винкристин | 1,4 мг/м2 | 8 | в/в (суммарно не более 2 мг) |
| Блеомицин | 10 мг/м2 | 8 | в/в |
| Прокарбазин | 100 мг/м2 | 1-7 | внутрь, (возможна замена на в/в дакарбазин 375 мг/м2 в 1-й день) |
| Преднизолон | 40 мг/м2 | 1-14 | внутрь |
| G-КСФ | 5 мкг/кг/сут | С 8 по 12 или до восстановления показателей лейкоцитов | подкожно |
| Курсы повторяют на 22 сут. | |||
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Этопозид | 100 мг/м2 | 1-3 | в/в |
| Доксорубицин | 25 мг/м2 | 1 | в/в |
| Циклофосфамид | 650 мг/м2 | 1 | в/в |
| Винкристин | 1,4 мг/м2 | 8 | в/в (суммарно не более 2 мг) |
| Блеомицин | 10 мг/м2 | 8 | в/в |
| Прокарбазин | 100 мг/м2 | 1-7 | внутрь, (возможна замена на в/в дакарбазин 375 мг/м2 в 1-й день) |
| Преднизолон | 40 мг/м2 | 1-7 | Внутрь. Отмена преднизолона в один день на 8й день цикла. При возникновении синдрома отмены – в 3 дня). |
| G-КСФ | 5 мкг/кг/сут | С 9 по 13 или до восстановления показателей лейкоцитов | Подкожно, 1 раз в сутки |
| Курсы повторяют каждые 14 сут. | |||
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Брентуксимаб ведотин | 1,2мг/кг | 1,15 | Внутривенно инфузия 30 мин через 1 ч после завершения введения AVD |
| Доксорубицин | 25мг/м2 | 1,15 | Внутривенно капельно или струйно |
| Винбластин | 6 мг/м2 (не более 10 мг) | Внутривенно, за 5-10 мин | 1,15 |
| Дакарбазин | 375 мг/м2 | Внутривенно капельно | 1,15 |
| Лечение возобновляется на 29-й день. Накануне и с первого дня цикла рекомендуется увеличивать объем потребляемой жидкости до 2 л в день. При большой опухолевой массе каждому пациенту назначают аллопуринол в дозе 300 мг/сут и в первые 3 дня цикла назначают гидратирующую терапию в объеме до 3 л/м2 при строгом контроле за диурезом и электролитными показателями. Первичная профилактика Г-КСФ рекомендована всем пациентам независимо от их возраста, начиная в первые 4 дня после введения химиопрепаратов, но не позднее 5-го дня | |||
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Дексаметазон | 40 мг | 1-4 | в/в или внутрь |
| Цисплатин | 100 мг/м2/сут | 1 | в/в капельно, 24-часовая инфузия |
| Цитарабин | 2000 мг/м2 | 2 | в/в, капельно, в течение 3 часов; 2 раза в день |
| Курсы повторяют каждые 21-28сут. | |||
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Этопозид | 100 мг/м2 | 1-3 | в/в, капельно |
| Ифосфамид | 5000 мг/м2 | 2 | в/в, 24-часовая инфузия + урометиксан в аналогичной дозе |
| Карбоплатин | 400 мг/м2 | 2 | в/в капельно |
| Курс возобновляется на 22 сут. | |||
GDP [48]
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Цисплатин | 100 мг/м2 | 1 | в/в, капельно |
| Гемцитабин | 1000 мг/м2 | 1,8 | в/в, капельно |
| Дексаметазон | 40 мг | 1-4 | внутрь |
| Курс возобновляется на 22й сут | |||
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Брентуксимаб ведотин | 1,8мг/кг | 1 | в/в, капельно, в течение 30 минут. Вводить обязательно сразу после разведения |
| Курс повторяется на 22 сут. | |||
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Брентуксимаб ведотин | 1,8мг/кг | 1 | в/в, капельно, в течение 30 минут. Вводить обязательно сразу после разведения |
| Бендамустин | 100 мг/м2 | 2,3 | в/в, в течение 30 минут |
| Курс повторяется на 22 сут. | |||
| Монотерапия ниволумабом | |||
| Препарат | Стандартная доза | Путь введения | Дни введения |
| Ниволумаб | 3 мг/кг или 240мг независимо от массы тела или 480 мг независимо от массы тела | Внутривенно В течение 60 мин | 1 |
| Лечение возобновляется на 15-й день (для дозы 3 мг/кг или 240 мг) или на 29-й день (для дозы 480 мг) | |||
| Монотерапия пембролизумабом | |||
| Препарат | Стандартная доза | Путь введения | Дни введения |
| Пембролизумаб | 200мг | Внутривенно В течение 30 мин | 1 |
| Лечение возобновляется на 22-й день | |||
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Ритуксимаб | 375 мг/м2/сут | 0 или 1 | в/в, капельно |
| Доксорубицин | 50 мг/м2/сут | 1 | в/в, капельно |
| Циклофосфамид | 750 мг/м2/сут | 1 | в/в, капельно |
| Винкристин | 1,4 мг/м2/сут | 1 | в/в (суммарно не более 2 мг) |
| Преднизолон | 100 мг | 1-5 | внутрь |
| Курс возобновляется на 22 день. | |||
- Показания к проведению трансфузионной терапии определяются в первую очередь клиническими проявлениями индивидуально для каждого пациента с учетом возраста, сопутствующих заболеваний, переносимости химиотерапии и развития осложнений на предыдущих этапах лечения.
- Лабораторные показатели для определения показаний имеют вспомогательное значение, в основном для оценки необходимости профилактических трансфузий концентрата тромбоцитов.
- Показания к трансфузиям также зависят от времени, после проведения курса химиотерапии – принимаются во внимание, прогнозируемое снижение показателей в ближайшие несколько дней.
- Уровень гемоглобина не нужно повышать, пока обычные резервы и компенсационные механизмы достаточны для удовлетворения потребностей тканей в кислороде;
- Существует только одно показание для трансфузий эритроцитсодержащих сред при хронических анемиях – симптомная анемия (проявляющаяся тахикардией, одышкой, стенокардией, синкопе, de novo депрессией или элевацией ST);
- Уровень гемоглобина менее 30 г/л является абсолютным показанием для трансфузии эритроцитов;
- При отсутствии декомпенсированных заболеваний сердечно-сосудистой системы и легких показаниями для профилактической трансфузии эритроцитов при хронических анемиях могут быть уровни гемоглобина:
| Возраст (лет) | Триггерный уровень Hb (г/л) |
| 35-45 | |
| 25-50 | 40-50 |
| 50-70 | 55 |
| >70 | 60 |
- При снижении уровня тромбоцитов менее 10 х10 9 /л или появлении геморрагических высыпаний на коже (петехии, синячки) проводится профилактическая трансфузия аферезных тромбоцитов;
- Профилактическая трансфузия аферезных тромбоцитов у пациентов с лихорадкой, пациентам, которым планируется инвазивное вмешательство может проводится при более высоком уровне – 20 х109/л;
- При наличии геморрагического синдрома петехиально-пятнистого типа (носовые, десневые кровотечения, мено-, метроррагии, кровотечения других локализаций) трансфузия концентрата тромбоцитов проводится с лечебной целью.
- Трансфузии СЗП проводятся у пациентов с кровотечением или перед проведением инвазивных вмешательств;
- Пациенты с МНО ≥2.0 (при нейрохирургических вмешательствах ≥1.5) рассматриваются как кандидаты для трансфузии СЗП при планировании инвазивных процедур. При плановых вмешательствах возможно назначение не менее, чем за 3 дня до вмешательства фитоменадиона не менее 30 мг/сут внутривенно или внутрь.
| Лекарственная группа | Международное непатентованное наименование ЛС | Способ применения | Уровень доказательности |
| Антинеопластические лекарственные средства | Блеомицин* | Внутривенное | С |
| Бендамустин | Внутривенное | С | |
| Винбластин | Внутривенное | А | |
| Винкристин | Внутривенное | А | |
| Винорелбин | Внутривенное | С | |
| Гемцитабин | Внутривенное | С | |
| Доксорубицин | Внутривенное | В | |
| Дакарбазин | Внутривенное | А | |
| Ифосфамид | Внутривенное | С | |
| Карбоплатин | Внутривенное | С | |
| Оксалиплатин | Внутривенное | С | |
| Прокарбазин* | Внутривенное | А | |
| Циклофосфамид | Внутривенное | С | |
| Цитарабин | Внутривенное | С | |
| Этопозид* | Внутривенное | В | |
| Цисплатин | Внутривенное | С | |
| Таргетные препараты | Ритуксимаб | Внутривенное | С |
| Брентуксимаб-ведотин | Внутривенное | В | |
| Ниволумаб* | Внутривенное | В | |
| Пембролизумаб | Внутривенное | В | |
| Глюкокортикостероиды | Преднизолон | Внутривенное | С |
| Метилпреднизолон | Внутривенное | С | |
| Дексаметазон | Внутривенное | С | |
| Лекарственные средства, ослабляющие токсическое действие противоопухолевых препаратов | Аллопуринол | Внутрь | С |
| Колониестимулирующий фактор | Филграстим | Подкожно, внутривенно | С |
*В соответствии с правилами применения незарегистрированных ЛС.
NB! Дополнительное медикаментозное лечение проводится соответственно протоколам лечения развившихся осложнений.
Хирургическое вмешательство:
• Резекционная биопсия лимфоузла или образования — для гистологического и иммуногистохимического исследования с целью верификации диагноза (и/или подтверждения рецидива заболевания).
• Полная спленэктомия — для гистологического и иммуногистохимического исследования с целью верификации диагноза (и/или подтверждения рецидива заболевания) при отсутствии других локализаций лимфомного поражения.
• Иссечение анальной трещины (острой/хронической) — по показаниям в рамках профилактики / лечения септических состояний у пациентов с гемобластозами.
• Удаление геморроидальных узлов (геморроидэктомия) — по показаниям в рамках профилактики / лечения септических состояний у пациентов с гемобластозами.
• Вскрытие парапроктита/инфильтрата — по показаниям в рамках профилактики/лечения септических состояний у пациентов с гемобластозами.
• Выведение стомы кишечника — по показаниям (при острой и хронической анальной трещины) в рамках профилактики/лечения септических состояний у пациентов с гемобластозами.
• Плевральная пункция — по показаниям при гидротораксе плеврите.
• Лапароцентез — по показаниям при асците.
Основным противопоказанием к хирургическим вмешательствам является не купируемый геморрагический синдром
NB! Хирургическое лечение прочих сопутствующих хирургических патологии в рамках лечения соответствующего протокола.
Дальнейшее ведение.
Полный ответ должен быть подтвержден по ПЭТКТ через 3 месяца от завершения инициальной терапии [6].
• Взрослым пациентам, завершившим лечение по поводу ЛХ с достижением ПО, рекомендуется динамическое наблюдение у врача-онколога или врача-гематолога в течение 1-го года после завершения терапии каждые 3 месяца, 2-го года – каждые 6 месяцев, в дальнейшем – ежегодно [3].
• ОАК, Биохимический анализ крови необходимо проводить каждые 3 месяца в течение 1-го года жизни, затем каждые 6 месяцев в течении 2-го года и в дальнейшем – один раз в год.
• В случае применения лучевой терапии на область шеи, рекомендован контроль ТТГ как минимум ежегодно [6].
• КТ шеи, ОГК, ОБП, таза с контрастированием каждые 6-месяцев в первые 2 года от завершения терапии, либо по клиническим показаниям. ПЭТКТ проводиться в случае если последний ПЭТКТ был 4-5б Deauville для подтверждения полного ответа/в случае подозрения на прогрессию/рецидив заболевания [6].
Индикаторы эффективности лечения.
NB! Всем пациентам с ЛХ, после 2 и 4 циклов ХТ, после окончания химиотерапевтического этапа и после завершения всей программы лечения, рекомендуется оценка ответа на терапию в соответствии с критериями ответа по Lugano для определения дальнейшей тактики ведения пациента [3,4].
Для группы пациентов, которым в дебюте заболевания и для рестадирования проводится ПЭТ/КТ, эффективность лечения оценивается по шкале Deauville (см. приложение 5).
Госпитализация
ПОКАЗАНИЯ ДЛЯ ГОСПИТАЛИЗАЦИИ С УКАЗАНИЕМ ТИПА ГОСПИТАЛИЗАЦИИ
- Проведение биопсии лимфатического узла/экстранодального образования или трепанобиопсии.
- Проведение курсов химиотерапии, таргетной терапии и иных видов лечения.
- Проведения мобилизации аутологичных гемопоэтических стволовых клеток.
- Проведение аутологичной/аллогенной трансплантации гемопоэтических стволовых клеток.
- Контрольное обследование перед/после ауто/аллоТКМ.
Показания для экстренной госпитализации:
- Соматически тяжелый пациент (ECOG≥3 баллов):
— опухолевая интоксикация, синдром сдавление;
— тяжелой анемический/геморрагический синдром, требующий заместительной терапии;
— полиорганная недостаточность в следствии основного заболевания.
- Фебрильная нейтропения.
Информация
Источники и литература
- Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2022
- 1) Алгоритм диагностики и протоколы лечения заболеваний системы крови, том 2, Под ред. В.Г. Савченко.-М.: Практика, 2016, стр 41. 2) Lymph node pathology for clinicians / Michel R Nasr, Anamarija M. Perry, Pamela Skrabek Springer Nature Switzerland 2019., стр 159-167. 3) Лимфома Ходжкина. Клинические рекомендации. Е.А. Демина, Г.С. Тумян, Т.Н. Моисеева., Современная онкология. 2020; 22 (2): 6–33. 4) Cheson BD, Fisher RI, Barrington SF et al. Recommendations for initial evaluation, staging, and response assessment of Hodgkin and non-Hodgkin lymphoma: the Lugano classification. J Clin Oncol 2014. 5) Hodgkin lymphoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up† D. A. Eichenauer1, B. M. P. Aleman2, M. Andreґ 3,4, M. Federico5, M. Hutchings6, T. Illidge7,8, A. Engert1 & M. Ladetto9, on behalf of the ESMO Guidelines Committee* Annals of Oncology 29 (Supplement 4): iv19–iv29, 2018 doi:10.1093/annonc/mdy080 Published online 23 May 2018. 6) Richard T. Hoppe., et al. Hodgkin lymphoma. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines). Version 3.2021. 7) Общие принципы диагностики лимфом. Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний. Демина Е.А. и др. Под ред. И.В. Поддубной, В.Г. Савченко. 2018; с. 9–27.
 Allen PB, Gordon LI. Frontline Therapy for Classical Hodgkin Lymphoma by Stage and Prognostic Factors. Clinical Medicine Insights: Oncology. SAGE Publications Ltd, 2017; 11. 9) Skoetz N et al. Comparison of first-line chemotherapy including escalated BEACOPP versus chemotherapy including ABVD for people with early unfavourable or advanced stage Hodgkin lymphoma. Cochrane Database of Systematic Reviews, 2017. 10) Barrington SF et al. PET-CT for staging and early response: Results from the Response-Adapted Therapy in Advanced Hodgkin Lymphoma study. Blood Am Soc Hematol 2016; 127 (12): 1531–8. 11) RATHL study: Johnson P, Federico M, Kirkwood A, et al. Adapted treatment guided by interim PET-CT scan in advanced Hodgkin’s lymphoma. N Engl J Med 2016;374(25):2419-2429. 12) Connors JM et al. Brentuximab vedotin with chemotherapy for stage III or IV Hodgkin’s lymphoma. N Engl J Med 2018; 378 (4): 331–44. 13) ЕCHELON-1: Connors JM, Jurczak W, Straus DJ, et al. Brentuximab vedotin with chemotherapy for stage IIl or IV Hodgkin’s lymphoma [published correction appears in N Engl J Med 2018 Mar 13378(9):878] N Engl J Med 2018;378(4):331-344. 14) Алгоритм диагностики и протоколы лечения заболеваний системы крови, том 2, Под ред. В.Г. Савченко.-М.: Практика, 2016, стр 52. 15) Fedele R et al. Clinical Options in Relapsed or Refractory Hodgkin Lymphoma: An Updated Review. J Immunol Res 2015; 2015: 968212. 16) Nikolaenko L, Chen R, Herrera AF. Current strategies for salvage treatment for relapsed classical Hodgkin lymphoma. Ther Adv Hematol 2017; 8 (10): 293–302. 17) Moskowitz CH et al. Five-year PFS from the AETHERA trial of brentuximab vedotin for Hodgkin lymphoma at high risk of progression or relapse. Blood 2018; 132 (25): 2639–42. 18) Chen R et al. Five-year survival and durability results of brentuximab vedotin in patients with relapsed or refractory Hodgkin lymphoma. Blood 2016; 128 (12): 1562–6. 19) Younes A et al. Nivolumab for classical Hodgkin’s lymphoma after failure of both autologous stem-cell transplantation and brentuximab vedotin: a multicentre, multicohort, singlearm phase 2 trial. Lancet Oncol 2016; 17 (9): 1283–94. 20) Chen R et al. Pembrolizumab in relapsed or refractory Hodgkin lymphoma: 2-year follow-up of KEYNOTE-087. Blood. Am Soc Hematol 2019; 134 (14): 1144–53. 21) Bachanova V, Connors JM. Hodgkin lymphoma in pregnancy. Curr Hematol Malig Rep 2013; 8 (3): 211–7. 22) Алгоритм диагностики и протоколы лечения заболеваний системы крови, том 2, Под ред. В.Г. Савченко.-М.: Практика, 2016, стр 71-74. 23) Pinnex C, Andraos TY, Milgrom S et al. the management of Lymphoma in the setting of pregnancy. Curr hematol malig rep 2017; 12:251. 24) Jagadeesh D, Diefenbach C, Evens AM. XII. Hodgkin lymphoma in older patients: challenges and opportunities to improvе outcomes. Hematol Oncol 2013,31 Suppl 1:69-75. 25) Evens AM, Sweetenham JV, Homing SJ. Hodgkin lymphoma in older patients: an uncommon disease in need of study. Oncology (Wiliston Park) 2008;22:1369-1379. 26) Halbsguth TV, Nogova L, Mueller H, et al. Phase 2 study of BACOPP (bleomуcin, adriamyсin, суclophosphamide, vincristine, procarbazine, and prednisone) in older patients with Hodgkin lymphoma: a report from the German Hodgkin Study Group (GHSG). Blood 2010;116:2026-2032. 27) Boll B, Gorgen H, Fuchs M, et al. ABVD in older patients with early-stage Hodgkin lymphoma treated within the German Hodgkin Study Group HD10 and HD11 trials. J Cin Oncol 2013;31:1522-1529. 28) Boll B, Goergen H, Behringer K et al. Bleomycin in older early-stage favorable Hodgkin lymphoma patients: analysis of the German Hodgkin Study Group (GHSG) HD10 and HD13 trials. Blood 2016; 127: 2189–2192. 29) Stamatoullas A, Brice P, Bouabdallah R, et al. Outcome of patients older than 60 years with classical Hodgkin lymphoma treated with front line ABVD chemotherару: frequent pulmonary events suggest limiting the use of bleomycin in the elderly. Br J Hаematol 2015;170:179-184. 30) Behringer K, Goergen H, Hitz F, et al. Omission of dacarbazine or bleomycin, or both, from the ABVD regimen in treatment of early-stage favourable Hodgkin’s lymphoma (GHSG HD13): an open-label, randomised, non-inferiority trial. Lancet 2015;385:1418-1427. 31) Koistad A, Nome O, Delabie J, et al. Standard CHOP-21 as first line theraрy for elderty patients with Hodgkin’s lymphoma. Leuk Lymphoma 2007;48:570-576. 32) Relapsed hodgkin lymphoma in older patients: a comprehensive analysis from the German hodgkin study group. J Clin Oncol 2013;31:4431-4437. 33) Nogova L et al. Extended field radiotherapy, combined modality treatment or involved field radiotherapy for patients with stage IA lymphocyte-predominant Hodgkin’s lymphoma: a retrospective analysis from the German Hodgkin Study Group (GHSG). Ann Oncol Off J Eur Soc Med Oncol 2005; 16 (10): 1683–7. 34) Eichenauer DA et al. Phase 2 study of rituximab in newly diagnosed stage IA nodular lymphocyte predominant Hodgkin lymphoma: A report from the German Hodgkin Study Group. Blood 2011; 118 (16): 4363–5. 35) Cencini E, Fabbri A, Bocchia M. Rituximab plus ABVD in newly diagnosed nodular lymphocyte predominant Hodgkin lymphoma. Br J Haematol 2017; 176 (5): 831–3. 36) Fanale MA et al. Encouraging activity for R-CHOP in advanced stage nodular lymphocytepredominant Hodgkin lymphoma. Blood 2017; 130: 472–7. 37) Eichenauer DA et al. Relapsed and refractory nodular lymphocyte-predominant Hodgkin lymphoma: An analysis from the German Hodgkin Study Group. Blood 2018; 132 (14): 1519–25. 38) Eichenauer DA, Engert A. Nodular lymphocyte-predominant Hodgkin lymphoma: A unique disease deserving unique management. Hematology 2017; 2017 (1): 324–8. 39) Enric C., Carlo D., et al The EBMT Handbook: Hematopoietic Stem Cell Transplantation and Cellular Therapies. Springer open access., 2019. 40) Meyer RM et al. ABVD alone versus radiation-based therapy in limited-stage Hodgkin’s lymphoma. N Engl J Med 2012; 366 (5): 399–408. 41) Allen PB, Gordon LI. Frontline Therapy for Classical Hodgkin Lymphoma by Stage and Prognostic Factors. Clinical Medicine Insights: Oncology. SAGE Publications Ltd, 2017; 11. 42) Skoetz N et al. Comparison of first-line chemotherapy including escalated BEACOPP versus chemotherapy including ABVD for people with early unfavourable or advanced stage Hodgkin lymphoma. Cochrane Database of Systematic Reviews, 2017. 43) Von Tresckow B et al. Dose-intensification in early unfavorable Hodgkin’s lymphoma: Final analysis of the German Hodgkin study group HD14 trial. J Clin Oncol 2012; 30 (9): 907–13. 44) Josting A, Rudolph C, Reiser M, et al. Time-intensified dexamethasone/cisplatin/ cytarabine: an effective salvage therapy with low toxicity in patients with relapsed and refractory Hodgkin’s disease. Ann Oncol 2002;13(10):1628-1635. 45) Abali H, Urin Y, Oksizoglu в, Budakoglu B, et al. Comparison of ICE (ifosfamide-carboplatin-etoposide) versus DHAР (сytosine arabinoside-cisplatin- dexamethasone) as salvage chemotherapy in patients with relapsed or refractory lymphoma. Cancer Invest 2008;26(4):401-406. 46) Jeon SY et al. The effect of the dexamethasone, cytarabine, and cisplatin (Dhap) regimen stem cell mobilization and transplant outcomes of patients with non-hodgkin’s lymphoma who are candidates for up-front autologous stem cell transplantation. Korean J Intern Med 2018; 33 (6): 1169–81. 47) Мoskowitz CH, Nimer SD, Zelenetz AD, et al. A 2-step comprehensive high- dose chemoradiotherapy second-line program for relapsed and refractory Нodjkin disease: analysis by intent to treat and development of a prognostic model. Blood 2001;97(3):616-623. 48) Ramzi M, Rezvani A, Dehghani M. GDP versus ESHAP Regimen in Relapsed and/or Refractory Hodgkin lymphoma: A Comparison Study. Int J Hematol Stem Cell Res 2015; 9 (1): 10–4. 49) Younes A, Goрal АK, Smith SE, et al. Results of a pivotal phase II stucy of brentuximab vedotin for patients with relapsed or refractory Hodgkin’s lymphorna. J Clin Oncol 2012;30:2183-2189. 50) О’Connor ОА, Lue JK, Sawas A. et al, Brentuximab vedotin plus bendamustine in relapsed or refractory Hodgkin’s lymphoma: an international, multicentre, single-arm, phase 1-2 trial. Lancet Oncol 2018;19: 257-266. 51) Long GV et al. Assessment of nivolumab exposure and clinical safety of 480 mg every 4 weeks flat-dosing schedule in patients with cancer. Ann Oncol 2018; 29 (11): 2208–13. 52) Ansell SM, Lesokhin AM, Borrello I, et al. PD-1 blockade with nivolumab in relapsed or refractory Hodgkin’s lymphoma. N Engl J Med 2015;372:311-319. 53) Timmerman J, Armand P, Lesokhin AM, et al. Nivolumab in patients with relapsed or refractory lymphoid malignancies and classical Hodgkin lymphoma: Updated results of a phase 1 study (CA 209-039) Hematol Oncol 2015;33. 54) Chen R, Zinzani PL, Fanale MA, et al. Phase II study of the efficacy and safety of pembrolizumab for relapsed/refractory classic Hodgkin lymphoma. J Clin Oncol 2017;35(19):2125-2132. 55) Kuruvilla J, Ramchandren R, Santoro A, et al. KEYNOTE-204: Randomized, open-label, phase III study of pembrolizumab (pembro) versus brentuximab vedotin (BV) in relapsed or refractory classic Hodgkin lymphoma (R/R cHL). Journal of Clinical Oncology 2020; 38:8005-8005.
Allen PB, Gordon LI. Frontline Therapy for Classical Hodgkin Lymphoma by Stage and Prognostic Factors. Clinical Medicine Insights: Oncology. SAGE Publications Ltd, 2017; 11. 9) Skoetz N et al. Comparison of first-line chemotherapy including escalated BEACOPP versus chemotherapy including ABVD for people with early unfavourable or advanced stage Hodgkin lymphoma. Cochrane Database of Systematic Reviews, 2017. 10) Barrington SF et al. PET-CT for staging and early response: Results from the Response-Adapted Therapy in Advanced Hodgkin Lymphoma study. Blood Am Soc Hematol 2016; 127 (12): 1531–8. 11) RATHL study: Johnson P, Federico M, Kirkwood A, et al. Adapted treatment guided by interim PET-CT scan in advanced Hodgkin’s lymphoma. N Engl J Med 2016;374(25):2419-2429. 12) Connors JM et al. Brentuximab vedotin with chemotherapy for stage III or IV Hodgkin’s lymphoma. N Engl J Med 2018; 378 (4): 331–44. 13) ЕCHELON-1: Connors JM, Jurczak W, Straus DJ, et al. Brentuximab vedotin with chemotherapy for stage IIl or IV Hodgkin’s lymphoma [published correction appears in N Engl J Med 2018 Mar 13378(9):878] N Engl J Med 2018;378(4):331-344. 14) Алгоритм диагностики и протоколы лечения заболеваний системы крови, том 2, Под ред. В.Г. Савченко.-М.: Практика, 2016, стр 52. 15) Fedele R et al. Clinical Options in Relapsed or Refractory Hodgkin Lymphoma: An Updated Review. J Immunol Res 2015; 2015: 968212. 16) Nikolaenko L, Chen R, Herrera AF. Current strategies for salvage treatment for relapsed classical Hodgkin lymphoma. Ther Adv Hematol 2017; 8 (10): 293–302. 17) Moskowitz CH et al. Five-year PFS from the AETHERA trial of brentuximab vedotin for Hodgkin lymphoma at high risk of progression or relapse. Blood 2018; 132 (25): 2639–42. 18) Chen R et al. Five-year survival and durability results of brentuximab vedotin in patients with relapsed or refractory Hodgkin lymphoma. Blood 2016; 128 (12): 1562–6. 19) Younes A et al. Nivolumab for classical Hodgkin’s lymphoma after failure of both autologous stem-cell transplantation and brentuximab vedotin: a multicentre, multicohort, singlearm phase 2 trial. Lancet Oncol 2016; 17 (9): 1283–94. 20) Chen R et al. Pembrolizumab in relapsed or refractory Hodgkin lymphoma: 2-year follow-up of KEYNOTE-087. Blood. Am Soc Hematol 2019; 134 (14): 1144–53. 21) Bachanova V, Connors JM. Hodgkin lymphoma in pregnancy. Curr Hematol Malig Rep 2013; 8 (3): 211–7. 22) Алгоритм диагностики и протоколы лечения заболеваний системы крови, том 2, Под ред. В.Г. Савченко.-М.: Практика, 2016, стр 71-74. 23) Pinnex C, Andraos TY, Milgrom S et al. the management of Lymphoma in the setting of pregnancy. Curr hematol malig rep 2017; 12:251. 24) Jagadeesh D, Diefenbach C, Evens AM. XII. Hodgkin lymphoma in older patients: challenges and opportunities to improvе outcomes. Hematol Oncol 2013,31 Suppl 1:69-75. 25) Evens AM, Sweetenham JV, Homing SJ. Hodgkin lymphoma in older patients: an uncommon disease in need of study. Oncology (Wiliston Park) 2008;22:1369-1379. 26) Halbsguth TV, Nogova L, Mueller H, et al. Phase 2 study of BACOPP (bleomуcin, adriamyсin, суclophosphamide, vincristine, procarbazine, and prednisone) in older patients with Hodgkin lymphoma: a report from the German Hodgkin Study Group (GHSG). Blood 2010;116:2026-2032. 27) Boll B, Gorgen H, Fuchs M, et al. ABVD in older patients with early-stage Hodgkin lymphoma treated within the German Hodgkin Study Group HD10 and HD11 trials. J Cin Oncol 2013;31:1522-1529. 28) Boll B, Goergen H, Behringer K et al. Bleomycin in older early-stage favorable Hodgkin lymphoma patients: analysis of the German Hodgkin Study Group (GHSG) HD10 and HD13 trials. Blood 2016; 127: 2189–2192. 29) Stamatoullas A, Brice P, Bouabdallah R, et al. Outcome of patients older than 60 years with classical Hodgkin lymphoma treated with front line ABVD chemotherару: frequent pulmonary events suggest limiting the use of bleomycin in the elderly. Br J Hаematol 2015;170:179-184. 30) Behringer K, Goergen H, Hitz F, et al. Omission of dacarbazine or bleomycin, or both, from the ABVD regimen in treatment of early-stage favourable Hodgkin’s lymphoma (GHSG HD13): an open-label, randomised, non-inferiority trial. Lancet 2015;385:1418-1427. 31) Koistad A, Nome O, Delabie J, et al. Standard CHOP-21 as first line theraрy for elderty patients with Hodgkin’s lymphoma. Leuk Lymphoma 2007;48:570-576. 32) Relapsed hodgkin lymphoma in older patients: a comprehensive analysis from the German hodgkin study group. J Clin Oncol 2013;31:4431-4437. 33) Nogova L et al. Extended field radiotherapy, combined modality treatment or involved field radiotherapy for patients with stage IA lymphocyte-predominant Hodgkin’s lymphoma: a retrospective analysis from the German Hodgkin Study Group (GHSG). Ann Oncol Off J Eur Soc Med Oncol 2005; 16 (10): 1683–7. 34) Eichenauer DA et al. Phase 2 study of rituximab in newly diagnosed stage IA nodular lymphocyte predominant Hodgkin lymphoma: A report from the German Hodgkin Study Group. Blood 2011; 118 (16): 4363–5. 35) Cencini E, Fabbri A, Bocchia M. Rituximab plus ABVD in newly diagnosed nodular lymphocyte predominant Hodgkin lymphoma. Br J Haematol 2017; 176 (5): 831–3. 36) Fanale MA et al. Encouraging activity for R-CHOP in advanced stage nodular lymphocytepredominant Hodgkin lymphoma. Blood 2017; 130: 472–7. 37) Eichenauer DA et al. Relapsed and refractory nodular lymphocyte-predominant Hodgkin lymphoma: An analysis from the German Hodgkin Study Group. Blood 2018; 132 (14): 1519–25. 38) Eichenauer DA, Engert A. Nodular lymphocyte-predominant Hodgkin lymphoma: A unique disease deserving unique management. Hematology 2017; 2017 (1): 324–8. 39) Enric C., Carlo D., et al The EBMT Handbook: Hematopoietic Stem Cell Transplantation and Cellular Therapies. Springer open access., 2019. 40) Meyer RM et al. ABVD alone versus radiation-based therapy in limited-stage Hodgkin’s lymphoma. N Engl J Med 2012; 366 (5): 399–408. 41) Allen PB, Gordon LI. Frontline Therapy for Classical Hodgkin Lymphoma by Stage and Prognostic Factors. Clinical Medicine Insights: Oncology. SAGE Publications Ltd, 2017; 11. 42) Skoetz N et al. Comparison of first-line chemotherapy including escalated BEACOPP versus chemotherapy including ABVD for people with early unfavourable or advanced stage Hodgkin lymphoma. Cochrane Database of Systematic Reviews, 2017. 43) Von Tresckow B et al. Dose-intensification in early unfavorable Hodgkin’s lymphoma: Final analysis of the German Hodgkin study group HD14 trial. J Clin Oncol 2012; 30 (9): 907–13. 44) Josting A, Rudolph C, Reiser M, et al. Time-intensified dexamethasone/cisplatin/ cytarabine: an effective salvage therapy with low toxicity in patients with relapsed and refractory Hodgkin’s disease. Ann Oncol 2002;13(10):1628-1635. 45) Abali H, Urin Y, Oksizoglu в, Budakoglu B, et al. Comparison of ICE (ifosfamide-carboplatin-etoposide) versus DHAР (сytosine arabinoside-cisplatin- dexamethasone) as salvage chemotherapy in patients with relapsed or refractory lymphoma. Cancer Invest 2008;26(4):401-406. 46) Jeon SY et al. The effect of the dexamethasone, cytarabine, and cisplatin (Dhap) regimen stem cell mobilization and transplant outcomes of patients with non-hodgkin’s lymphoma who are candidates for up-front autologous stem cell transplantation. Korean J Intern Med 2018; 33 (6): 1169–81. 47) Мoskowitz CH, Nimer SD, Zelenetz AD, et al. A 2-step comprehensive high- dose chemoradiotherapy second-line program for relapsed and refractory Нodjkin disease: analysis by intent to treat and development of a prognostic model. Blood 2001;97(3):616-623. 48) Ramzi M, Rezvani A, Dehghani M. GDP versus ESHAP Regimen in Relapsed and/or Refractory Hodgkin lymphoma: A Comparison Study. Int J Hematol Stem Cell Res 2015; 9 (1): 10–4. 49) Younes A, Goрal АK, Smith SE, et al. Results of a pivotal phase II stucy of brentuximab vedotin for patients with relapsed or refractory Hodgkin’s lymphorna. J Clin Oncol 2012;30:2183-2189. 50) О’Connor ОА, Lue JK, Sawas A. et al, Brentuximab vedotin plus bendamustine in relapsed or refractory Hodgkin’s lymphoma: an international, multicentre, single-arm, phase 1-2 trial. Lancet Oncol 2018;19: 257-266. 51) Long GV et al. Assessment of nivolumab exposure and clinical safety of 480 mg every 4 weeks flat-dosing schedule in patients with cancer. Ann Oncol 2018; 29 (11): 2208–13. 52) Ansell SM, Lesokhin AM, Borrello I, et al. PD-1 blockade with nivolumab in relapsed or refractory Hodgkin’s lymphoma. N Engl J Med 2015;372:311-319. 53) Timmerman J, Armand P, Lesokhin AM, et al. Nivolumab in patients with relapsed or refractory lymphoid malignancies and classical Hodgkin lymphoma: Updated results of a phase 1 study (CA 209-039) Hematol Oncol 2015;33. 54) Chen R, Zinzani PL, Fanale MA, et al. Phase II study of the efficacy and safety of pembrolizumab for relapsed/refractory classic Hodgkin lymphoma. J Clin Oncol 2017;35(19):2125-2132. 55) Kuruvilla J, Ramchandren R, Santoro A, et al. KEYNOTE-204: Randomized, open-label, phase III study of pembrolizumab (pembro) versus brentuximab vedotin (BV) in relapsed or refractory classic Hodgkin lymphoma (R/R cHL). Journal of Clinical Oncology 2020; 38:8005-8005.
Информация
ОРГАНИЗАЦИОННЫЕ АСПЕКТЫ ПРОТОКОЛА.
- Кемайкин Вадим Матвеевич — кандидат медицинских наук, врач-гематолог высшей квалификационной категории, руководитель центра онкогематологии и ТКМ, ТОО «Национальный научный онкологический центр».
- Жүніс Гүлжанат Қуанышқызы — врач-гематолог центра онкогематологии и ТКМ, ТОО «Национальный научный онкологический центр».
- Сарина Сабила Тұрғанбайқызы — врач-гематолог центра онкогематологии и ТКМ, ТОО «Национальный научный онкологический центр».
- Габбасова Сауле Телембаевна — врач гематолог высшей категории, магистр общественного здравоохранения, член общества онкогематологов РК, член Ассоциации онкологов РК, руководитель центра гематологии с трансплантацией костного мозга КазНИИиОР.
- Худайбергенова Махира Сейдуалиевна — клинический фармаколог, ТОО «Национальный научный онкологический центр».
- Рапильбекова Гульмира Курбановна — доктор медицинских наук, профессор КФ UMC «Национальный научный центр материнства и детства», старший ординатор акушерского отделения №1, врач акушер-гинеколог.
Рецензенты: Рамазанова Райгуль Мухамедовна – доктор медицинских наук, врач-гематолог высшей квалификационной категории, профессор кафедры внутренних болезней НАО «Казахский Национальный Медицинский университет имени С.Д Асфендиярова».
Указание условий пересмотра протокола: пересмотр протокола через 5 лет после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.
Приложение 1
Индекс Карновского/Шкала ECOG-ВОЗ
Общее состояние онкологического больного рекомендовано оценивать по индексу Карновского (0-100%) или Шкале ECOG-ВОЗ (0-4 балла).
Индекс Карновского Активность,% Шкала ECOG-ВОЗ Балл Состояние нормальное жалоб нет 100 Нормальная активность 0 Способен к нормальной деятельности, незначительные симптомы или признаки заболевания 90 Есть симптомы заболевания, но ближе к нормальному состоянию 1 Нормальная активность с усилием 80 Обслуживает себя самостоятельно, не способен к нормальной деятельности или активной работе 70 Больше 50% дневного времени проводит не в постели, но иногда нуждается в отдыхе 2 Нуждается порой в помощи, но способен сам удовлетворять большую часть своих потребностей 60 Нуждается в значительной помощи и медицинском обслуживании 50 Нуждается в пребывании в постели более 50% дневного времени 3 Инвалид, нуждается в специальной помощи, в т.ч. медицинской 40 Тяжелая инвалидность, показана госпитализация, хотя смерть не предстоит 30 Не способен обслуживать себя, прикован к постели 4 Тяжелый больной. Необходимы активное лечение и госпитализация 20 Умирающий 10 Приложение 2
Классификация лимфом. ВОЗ 2016 год.
- Хронический лимфолейкоз/ лимфома из малых лимфоцитов;
- Моноклональный В-клеточный лимфоцитоз;
- В-пролимфоцитарный лейкоз;
- Лимфома селезенки из клеток маргинальной зоны;
- Волосатоклеточный лейкоз;
- Лимфома/ лейкоз селезенки, неклассифицируемый:
- Лимфоплазмоцитарная лимфома
- Моноклональные гаммапатии неясного генеза (MGUS), IgM:
- Моноклональные гаммапатии неясного генеза (MGUS), IgG/A:
- Экстранодальная лимфома из клеток маргинальной зоны лимфоидной ткани, ассоциированной со слизистой оболочкой (MALT- лимфом);
- Нодальная лимфома из клеток маргинальной зоны;
- Нодальная лимфома из клеток маргинальной зоны, педиатрический вариант;
- Фолликулярная лимфома:
- Фолликулярная лимфома, педиатрический вариант;
- Крупноклеточная В- клеточная лимфома с IRF4;
- Первичная кожная центрофолликулярная лимфома;
- Лимфома из клеток мантии:
- Диффузная крупноклеточная В- клеточная лимфома, NOS:
- В-клеточная лимфома, богатая T-клетками/гистиоцитами;
- Первичная ДВККЛ центральной нервной сиситемы (ЦНС);
- Первичная кожная диффузная крупноклеточная В- клеточная лимфома с поражением нижних конечностей;
- EBV1+ DLBCL, NOS;
- EBV1+, кожно-слизистая язва;
- ДВККЛ, связанная с хроническим воспаленнием;
- Лимфоматоидный гранулематоз;
- Первичная медиастинальная (тимическая) крупноклеточная В- клеточная лимфома;
- Внутрисосудистая крупноклеточная В- клеточная лимфома;
- ALK + крупноклеточная В- клеточная лимфома;
- Плазмобластная лимфома;
- Первичная экссудативная лимфома;
- HHV81 DLBCL, NOS*;
- Лимфома Беркитта;
- Беркитоподобная лимфома с абберацией 11q;
- В-клеточная лимфома высокой степени злокачественности, с мутациями MYC и BCL2 и /или BCL6;
- В-клеточная лимфома высокой степени злокачественности, NOS;
- В- клеточная лимфома, неклассифицируемая, с признаками, промежуточными между диффузной крупноклеточной В- клеточной лимфомой и лимфомой Ходжкина;
- Т- клеточный пролимфоцитарный лейкоз;
- Т- клеточный гранулярный лимфоцитарный лейкоз;
- Хроническое лимфопролиферативное NK- клеточное заболевание;
- Агрессивный NK- клеточный лейкоз;
- Системная EBV Т-клеточная лимфома у детей;
- Гидроаоспенновидно- подобнаялимфома;
- Т- клеточная лимфома/ лейкоз взрослых;
- Экстранодальная NK/ T- клеточная лимфома, назальный тип;
- Ассоциированная с энтеропатией Т- клеточная лимфома;
- Мономорфная эпителиотропная кишечная Т-лимфома;
- Индолетние Т-клеточные лимфопролиферативные заболевания ЖКТ;
- Гепатоспленическая Т- клеточная лимфома;
- Подкожная панникулит- подобная Т- клеточная лимфома;
- Грибовидный микоз;
- Синдром Сезари;
- Первичные кожные CD30- позитивные Т- клеточные лимфомы;
- Лимфоматоидный папуллез;
- Первичная кожная анапластическая крупноклеточная лимфома;
- Первичная кожная γδ Т- клеточная лимфома;
- Первичная кожная CD8+ агрессивная эпидермотропная цитотоксическая Т- клеточная лимфома;
- Первичная кожная CD8+ Т- клеточная лимфома
- Первичная кожная периферическая CD8+ Т- клеточная лимфома
- Первичная кожная CD4+ мелко/ среднеклеточная Т- клеточная лимфома;
- Периферическая Т- клеточная лимфома, неуточненная;
- Ангиоиммунобластная Т- клеточная лимфома;
- Фолликулярная Т-клеточная лимфома;
- Нодальная периферическая Т-клеточная лимфома с фенотипом TFH;
- Анапластическая крупноклеточная лимфома, ALK- позитивная;
- Анапластическая крупноклеточная лимфома, ALK- негативная;
- Грудной имплантат-ассоциированной анапластическая крупно-клеточная лимфома;
- Нодулярная с лимфоидным преобладанием лимфома Ходжкина;
- Классическая лимфома Ходжкина;
- Лимфома Ходжкина, вариант нодулярный склероз;
- Лимфома Ходжкина, вариант, богатый лимфоцитами;
- Лимфома Ходжкина, смешанноклеточный вариант;
- Лимфома Ходжкина, вариант с лимфоидным истощением.
- Плазматическая гиперплазия (PTLD);
- Инфекционный мононуклеоз (PTLD);
- Багровая фолликулярная гиперплазия;
- Полиморфная PTLD;
- Мономорфная PTLD (B- и T-/NK-клеточные типы)
- Классическая лимфома Ходжкина (PTLD).
- Гистиоцитарная саркома;
- Гистиоцитоз из клеток Лангергаса;
- Саркома из клеток Лангергаса;
- Неопределенный опухоль дендритных клеток;
- Саркома из дендритных клеток;
- Саркома фолликулярных дендритных клеток;
- Опухоль из ретикулярных фибробластических клеток;
- Рассеянная юношеская ксантогранулома
- Болезнь Эрдгейма-Честер
Приложение 3
Классификация лимфом Ann Arbor, модификация Cotswold
- Поражение одной лимфатической зоны или структуры *
- Локализованное поражение одного экстралимфатического органа или ткани в пределах одного сегмента.
- Поражение двух или более** лимфатических зон по одну сторону диафрагмы.
- Локализованное в пределах одного сегмента поражение одного
- Поражение лимфатических узлов или структур по обе стороны диафрагмы***
- Локализованное в пределах одного сегмента поражение одного
- Экстралимфатического органа или ткани и его регионарных лимфатических узлов с поражением других лимфатических областей по обе стороны диафрагмы
- Диссеминированное (многофокусное) поражение одного или нескольких экстралимфатических органов, с или без поражения лимфатических узлов.
- Изолированное поражение экстралимфатического органа с поражением.
- Отдаленных (не регионарных) лимфатических узлов.
- Поражение печени и/или костного мозга.
- Отсутствие признаков В-стадии
- Лихорадка выше 38°С не менее трех дней подряд без признаков воспаления.
- Ночные профузные поты.
- Похудание на 10% массы тела за последние 6 месяцев.
- Локализованное экстранодальное поражение (при I-IIIстадиях)
- Поражение селезенки (при I-IIIстадиях)
- Массивное (bulky) опухолевое поражение –очаг более 10 см в диаметре или медиастинально-торакальный индекс***** более 1/3
* К лимфатическим структурам относят лимфатические узлы, селезенку, вилочковую железу, кольцо Вальдейера, червеобразный отросток, пейеровы бляшки.
** При лимфоме Ходжкина для второй стадии необходимо дополнительно арабской цифрой указывать количество пораженных лимфатических зон (например, стадия II4).
*** Рекомендуется различать стадию III1, с поражением верхних абдоминальных лимфатических узлов (ворота печени, селезенки, чревные л/у), и стадию III2, с поражением забрюшинных лимфузлов.
**** Кожный зуд исключен из симптомов интоксикации.
***** Медиастинально-торакальный индекс – отношение ширины срединной тени в самом широком месте к диаметру грудной клетки в самом широком ее месте – на уровне Th5-6на стандартных прямых рентгенограммах.Приложение 4
Критерии LUGANO для оценки ответа при НХЛ
ПЭТ должно быть проведено с контрастным усилением и КТ (можно провести одновременно или по отдельности).
Ответ Локализация (Вовлечение органов и систем) ПЭТ КТ (метаболический ответ) КТ (радиологический ответ) d Полный ответ Лимфатические узлы и экстралимфатические поражения 1,2 или 3* балла по шкале Deauville, с/без остаточной массой Все критерии из перечисленных: Лимфатические узлы / нодальные массы должны регрессировать к ≤1.5 см
Без экстралимфатического пораженияНе измеряемые очаги Не применяется Отсутствуют Увеличение в размерах внутренних органов Не применяется Уменьшение до нормальных размеров Новые очаги Не обнаружено Не обнаружено Костный мозг Нет данных за накопление фтордезоксиглюкозы в мозге Нормальная по морфологии; при сомнительном результате — проточная цитометрии и негативная ИГХ Частичный ответ Лимфатические узлы и экстралимфатические поражения 4 или 5 баллов по шкале Deauville с меньшим накоплением FDG по сравнению результатом в дебюте. Нет новых очагов поражения или прогрессирования.
В промежуточном рестадировании эти данные свидетельствуют об ответе заболевания на лечение.
В конце лечения эти результаты могут свидетельствовать об остаточной болезни.Все критерии из перечисленных:
-уменьшение размеров лимфатических узлов и экстралимфатических поражений на ≥ 50%;
-когда степень поражения невозможно оценить на КТ из-за малых размеров (ориентировочный размер 5х5 мм);
-полное отсутствие поражения, 0х0 мм;
-для узлов >5 мм х 5 мм, но меньше, чем в норме, (рекомендовано использование фактического измерения для расчета);Неизмеряемые очаги Не применяется Отсутствуют / нормальные, регресиированные, но нет увеличения Увеличение в размерах внутренних органов Не применяется Уменьшение размеров селезенки на 50% в длину (но не достигших размеров нормы) Новые очаги Не обнаружены Не обнаружены Костный мозг Остаточное поглощение FDG выше, чем поглощение в нормальном костном мозге, но снижено по сравнению с исходным уровнем (диффузное поглощение сочетается с реактивными изменениями после проведенной химиотерапии). Если имеются стойкие очаговые изменения в костном мозге на фоне ответа, рассмотреть дальнейшую оценку ответа с биопсией, или интервал сканирования. Не применяется a 3 балла по шкале Deauville у многих пациентов указывает на хороший прогноз при стандартной терапии, особенно при промежуточном рестадировании. Однако, в испытаниях с участием ПЭТ, где исследовались деэскалация доз химиопрепаратов, ответ 3 балла по шкале Deauville расценивался как неадекватный ответ (чтобы избежать недостаточного лечения).
Критерии LUGANO для оценки ответа при НХЛ
ПЭТ должно быть проведено с контрастным усилением и КТ (можно провести одновременно или по отдельности).
Ответ Локализация (Вовлечение органов и систем) ПЭТ КТ (метаболический ответ) КТ (радиологический ответ) d Нет ответа или стабилизация заболевания Целевые узлы и узловые массы
Экстралимфатические поражения- см для поражений >2 см
SPD — сумма произведения перпендикулярных диаметров для множественных повреждений
LDi — самый длинный поперечный диаметр поражения
SDi — короткая ось перпендикулярна к LDI
PPD — крест произведение LDI и перпендикулярного диаметраПриложение 5
Оценка эффективности проведенной терапии по шкале Deauville

Приложение 6
Клинические и технические требования к лучевой терапии
Клинические требования
Оптимальный интервал между окончанием ХТ и началом лучевой терапии – 2-4 недели (но не более 6 недель).
Очень важным для планирования лучевой терапии является качество стадирования заболевания до начала химиотерапии. Описание очагов поражения по данным клинического осмотра, КТ, МРТ должно включать анатомически точную их локализацию, количество, максимальные размеры в сантиметрах, особенно зон массивного поражения, указание 3-х размеров зоны поражения, включая протяжённость. При описании поражения средостения обязательно определение медиастинально-торакального индекса (МТИ) по прямому рентгеновскому снимку. Для атипично расположенных пораженных лимфатических узлов, помимо описания их, необходимо указывать их координаты (расстояние в см по горизонтали и вертикали от легко определяемых анатомических ориентиров). Всю указанную выше информацию рекомендуется изображать графически на анатомической схеме человеческого тела во фронтальной проекции.
До начала ХТ при наличии полной информации об объеме исходного поражения рекомендуется совместная консультация гематологов-онкологов и радиологов. Особо должны быть выделены зоны сомнительного или вероятного поражения, лечебная тактика в отношении которых должна быть предварительно согласована и повторно обсуждена после окончания ХТ.
При всех поддиафрагмальных поражениях в случае планирования облучения селезёнки рекомендуется радиоизотопное исследование функции почек. При наличии единственной левой почки либо при значительном нарушении функции правой почки следует обсудить целесообразность спленэктомии, как альтернативы ее облучению.Технические требования
Для проведения лучевой терапии можно использовать гамма-излучение Со60, фотонное излучение энергией 6 МЭВ и 18 МЭВ (18 МЭВ используется в случае глубокого расположения мишени, при больших значениях передне-задних размеров). Электронное излучение различных энергий может использоваться для лечения поверхностно расположенных лимфатических узлов.
Расчёт дозы ЛТ должен проводиться в соответствии с МКРЕ-50-62, где указаны относительные точки и суммарные дозы. Разовая очаговая доза не должна превышать 1,8-2,0 Гр, лечение проводится ежедневно 5 раз в неделю. Следует избегать начала ЛТ в пятницу и окончания курса ЛТ в понедельник.
В зависимости от технической оснащенности радиологического отделения могут использоваться различные методики лучевой терапии: от лечения несколькими фигурными полями (требующего четкой стыковки смежных полей облучения во избежание пере-или недооблучения) до новейших методик конформной лучевой терапии (IMRT, RAPIDARC), сводящих к минимуму лучевое воздействие на нормальные ткани.
Для точного воспроизведения положения пациента во время лечения необходимо использовать фиксирующие приспособления – подголовники, индивидуальные пластиковые маски, подставки для нижних конечностей. При облучении всех пораженных зон, кроме паховых и бедренных лимфатических узлов, используются встречные передне-задние фигурные поля (они формируются с помощью защитных блоков или многолепестковых коллиматоров диафрагмы ускорителя).
При дополнительном облучении отдельных групп лимфатических узлов возможно любое расположение полей, минимизирующее лучевое повреждение здоровых тканей. При ЛТ остаточных объёмных опухолей рекомендуется объёмное планирование облучения, применение методики облучения тангенциальными полями, использование компенсаторных клиньев, методик конформной лучевой терапии (3D CRT).
При поражении лимфоидной ткани кольца Вальдейера облучение проводится с двух боковых встречных полей (необходима предварительная санация полости рта, использование защитных кап).
Каждое лечебное поле должно подтверждаться рентгеновскими снимками с помощью симулятора или системой контроля изображения на ускорителе.Объёмы облучения
Для выбора адекватного объёма облучения необходимо помнить об определении областей и зон поражения. На V международном симпозиуме по лимфоме Ходжкина в 2001г. было уточнено, что термином «зона» обозначаются анатомические зоны, по которым устанавливается стадия заболевания в соответствии с классификацией Ann Arbor. Термин «область» – более широкое понятие, область может включать в себя одну или более зон. Так в одну область были включены шейные, над- и подключичные лимфатические узлы с одной стороны. Также в одну область объединены медиастинальные лимфатические узлы и лимфатические узлы корней легких, одной областью считаются лимфатические узлы «верхнего этажа» брюшной полости (ворота печени, ворота селезенки и корень брыжейки) и одной областью – лимфатические узлы “нижнего этажа” брюшной полости — парааортальные и мезентериальные (рисунок 1).
Рисунок 1. Области и зоны поражения при лимфомах
Приложение 7
Факторы риска и профилактика тромботических и тромбоэмболических осложнений
Факторы риска и профилактика тромботических и тромбоэмболических осложнений у пациентов, которые получают талидомид или леналидомид
- Ожирение (ИМТ более 30 кг/м 2 );
- Предшествующие тромботические события;
- Центральный венозный катетер или искусственный водитель ритма;
- Ассоциированные заболевания и состояния: заболевания ССС, хроническая болезнь почек, диабет, острые инфекции, иммобилизация;
- Хирургические вмешательства: общая хирургия, травма, любая анестезия;
- Использование эритропоэтина;
- Тромбофилии.
- Нет факторов риска или один фактор риска (индивидуальный или связанный с лимфопролиферативным заболеванием): ацетилсалициловая кислота 80-325 мг 1 раз в сутки;
- 2 и более индивидуальных или связанных с лимфопролиферативным заболеванием факторов риска:
- Само наличие лимфомы, миеломы в особенности при большой инициальной опухолевой массе;
- Повышенная вязкость крови.
- Высокими дозами дексаметазона (более 480 мг в месяц);
- Доксорубицином;
- Полихимиотерапией.
- Низкомолекулярные гепарины (эквивалент эноксапарина натрия 40 мг 1 раз в сутки);
- Полная доза варфарина (целевое значение МНО 2-3).
Прогностическая модель ассоциированных с химиотерапией тромбоэмболических осложнений KhoranaА.А. и соавт.
Характеристики пациента Баллы Верифицированная лимфома 1 Количество тромбцитов до начала химотерапии 350 тыс/мкл и выше 1 Уровень гемоглобина ниже 100 г/л или использование эритропоэтинов 1 Уровень лейкоцитов до начала химиотерапии выше 11 тыс/мкл 1 ИМТ выше 35 кг/м 2 1 Общее количество баллов Категория риска Риск симптомной тромбоэмболии 0 Низкий 0,8-3% 1, 2 Промежуточный 1,8-8,4% 3 и более Высокий 7,1-41% Рекомендации American Society of Clinical Oncology по профилактике и лечению тромбозов вен и тромбоэмболий у онкологических больных*
- некупируемое кровотечение;
- острая стадия внутричерепного кровоизлияния;
- расслаивающая аневризма аорты или аневризма сосудов головного мозга;
- бактериальный эндокардит;
- перикардит;
- обострение язвы желудка или других отделов ЖКТ;
- тяжелая, злокачественная артериальная гипертензия или гипертензия без надлежащего лечения;
- тяжелая травма головы;
- беременность (варфарин);
- гепариновая тромбоцитопения (гепарин, нефракционированный и низкомолекулярный);
- введение эпидурального катетера.
Приложение 8
Синдром лизиса опухоли
При разрушении опухолевых клеток образуется пять основных субстанций, которые выводятся исключительно почками: продукты распада пурина ® ксантин, гипоксантин и мочевая кислота; калий; фосфат.
Аллопуринол тормозит распад ксантина и гипоксантина до мочевой кислоты путем ингибирования ксантиноксидазы, снижая образование уратов в сыворотке крови.
При превышении порога растворимости ксантин, гипоксантин и мочевая кислота могут кристаллизоваться в почечных канальцах и собирательных трубочках. Фосфат, соединяясь с кальцием, образует фосфат кальция и выпадает как в почечных канальцах, так и в концевых капиллярах тканей, следствием чего являются гипокальциемия, олиго/анурия и тканевые некрозы. Растворимость ксантина и мочевой кислоты в щелочной среде намного выше, чем в кислой, но щелочная среда напротив благоприятствует выпадению в осадок фосфата кальция. Кроме того при рh>7,5 может кристаллизоваться гипоксантин. Следовательно перезащелачивание мочи тоже может благоприятствовать выпадению продуктов клеточного распада.
Если перед началом циторедуктивной терапии наблюдается повышение уровня мочевой кислоты и/или калия, и/или фосфатов и/или креатинина, то мероприятия по нормализации этих показателей должны быть проведены до начала циторедуктивной терапии. Однако начало этой терапии не должно откладываться более чем на 24 часа.
Главным мероприятием является инициирование и поддержание высокого диуреза — 100-250 мл/м 2 / час. Если этого удается добиться, то метаболические нарушения бывают редко.
Если адекватного диуреза несмотря на достаточный объём инфузии, применение различных мочегонных средств добиться не удается, должны быть своевременно сделаны все необходимые приготовления к гемодиализу. Причиной олиго/анурии в этом случае является распространённое опухолевое поражение почек и/или обструкция опухолью (лимфомой) нисходящих мочевых путей, либо развитие тяжёлой уратной или кальциево-фосфатной нефропатии, либо комбинация этих патологических состояний.
Гиперкалиемия является наиболее опасным осложнением синдрома острого лизиса опухоли. Если после проведения профилактических/терапевтических мероприятий уровень калия повышается или при предшествующей гиперкалиемии не происходит его быстрого снижения, то угрожающее состояние может развиться в течение нескольких ближайших часов.
Тяжелый синдром острого лизиса опухоли часто осложняется развитием гипокоагуляционной фазы синдрома диссеминированного внутрисосудистого свертывания, требующего массивной заместительной терапии свежезамороженной плазмой (не мене 1000 мл 2 раза в день), концентратами тромбоцитов и нередко – проведения плазмафереза.Лечение лимфомы
Лимфома — это онкологическое заболевание, при котором поражаются лимфоциты (клетки иммунной системы). В некоторых случаях ее могут называть раком лимфатической системы, но это неверный термин, поскольку к раку относят опухоли, происходящие из эпителиальных тканей, а для злокачественных новообразований лимфатической системы применяется термин лимфома. Существует множество видов лимфом, их лечение зависит от типа заболевания, стадии, ответа на предшествующую терапию, если она была, возраста пациента и общего состояния его здоровья. То есть подход может варьироваться от простого наблюдения до высокодозной химиотерапии и трансплантации гемопоэтических стволовых клеток . [1]
Отзыв Елены о лечении лимфомы в клинике «Евроонко»
Посмотрите отзыв одной из пациенток о лечении лимфомы:

Виды лимфом
Все лимфомы делятся на две большие группы — ходжкинские и неходжкинские. Ходжкинские лимфомы характеризуются наличием в опухолевой ткани особых клеток Березовского-Штернберга. Неходжкинские лимфомы представляют собой очень разнородную группу опухолей, которые также делятся на две большие подгруппы — Т-клеточные и В-клеточные. [2,3]
По характеру течения неходжкинские лимфомы делятся на следующие виды:
- Доброкачественные лимфомы, или индолентные. Они очень медленно прогрессируют, но очень плохо поддаются радикальному излечению.
- Агрессивные лимфомы. В этом случае заболевание неминуемо прогрессирует и при отсутствии лечения приводит к гибели больного. При таких лимфомах обязательно назначается химиотерапия.
- Сверхагрессивные формы. При таких опухолях в отсутствии лечения заболевание очень быстро прогрессирует и злокачественные клетки практически молниеносно распространяются по всему организму. Гибель может наступить в течение нескольких месяцев или даже недель после развития заболевания. Чтобы победить болезнь, необходимы радикальные меры, например, высокодозная химиотерапия с трансплантацией стволовых клеток. [4]
Симптомы лимфомы
Признаки лимфомы могут быть самыми разнообразными, но всех их можно объединить в три большие группы:
- Лимфоаденопатия, или увеличение лимфатических узлов. Довольно часть встречаются ситуации, когда первыми симптомами лимфомы является безболезненное увеличение лимфатических узлов. При этом пациент обращается к врачу и диагноз устанавливается довольно быстро. Однако бывают случаи, когда лимфоаденопатия затрагивает внутренние лимфатические узлы, которые не доступны пальпации или осмотру. Их можно обнаружить только с помощью УЗИ, КТ или МРТ и тогда этот признак может и не быть обнаружен.
- В-симптомы — это триада симптомов, которая является наиболее специфическим признаком лимфомы. Сюда относят ночную потливость (потливость может быть выражена очень сильно, вплоть до того, что больной просыпается на мокрой от пота подушке), необъяснимую потерю веса и повышение температуры, не связанное с инфекционным заболеванием.
- Симптомы, которые развиваются, когда лимфома выходит за пределы лимфатической системы и распространяется на внутренние органы. При вовлечении ЦНС, это могут быть головные боли, рвота, изменение зрения. Если вовлечены в процесс легкие — кашель, одышка. Таким образом, симптоматика будет зависеть от того, какие органы или системы поражены. [1,5]
Методы диагностики лимфомы
Скрининговых тестов для диагностики лимфом не существует. Обычно диагноз устанавливают по результатам обследования, которое врач назначает пациенту, после того как тот явился с жалобами на симптомы «вирусной инфекции».
Обнаружить очаги можно с помощью КТ, МРТ, ультразвукового исследования, позитронно-эмиссионной томографии (ПЭТ). [1]
Лечение лимфомы Ходжкина в Москве и Краснодаре
При лимфоме Ходжкина на ранних стадиях лечение проводится по схеме АБВД. Это комбинация химиотерапевтических препаратов:
- адриамицина (доксорубицина),
- блеомицина,
- винбластина
- дакарбазина.
Все они вводятся с помощью капельницы. Каждый курс занимает 4 недели. Пациенту может потребоваться 4–6 курсов, то есть лечение лимфомы будет продолжаться 4–6 месяцев.
Химиотерапия по схеме АБВД приводит к иммунодефициту и подверженности инфекциям, усталости, слабости, множественным синякам, реакции со стороны кожи (покраснение, потемнение и др.), потере волос, бесплодию, чувствительности к свету и др. Кроме химиотерапии, пациентам при лимфоме Ходжкина обязательно нужна лучевая терапия. [5]
Прогноз на ранних стадиях хороший, многим людям удаётся выйти в длительную ремиссию, то есть, по сути, выздороветь. Более точный прогноз сможет дать только врач, который учтёт возраст пациента, уровень гемоглобина, лимфоцитов, альбумина и др.
На III–IV стадиях (их называют поздними) нужна другая схема химиотерапии. Она называется BEACOPP. Это блеомицин, этопозид, доксорубицин, циклофосфамид, винкристин, прокарбазин и преднизолон. Часть из этих препаратов принимается в виде капсул и таблеток, часть вводится с помощью капельницы.
Побочные эффекты от BEACOPP довольно обычные для химиотерапии: снижение иммунитета, усталость, слабость, одышка, потеря волос, множественные синяки, носовое кровотечение, бесплодие и др. Один курс длится 3 недели, пациенту может понадобиться до 8 курсов, что в общей сложности займёт полгода. Лучевая терапия в этом случае нужна не всегда — она проводится, только если не достигнут полный эффект от химиотерапии и есть остаточные образования. Прогноз при лимфоме Ходжкина III–IV стадии зависит от тех же факторов, что и на ранних стадиях. [14]

К сожалению, из-за токсичности используемых препаратов, последствия лечения (злокачественные новообразования, болезни сердца и др.) могут проявиться и через годы.
По статистике, болезнь может вернуться у 10–15 процентов пациентов, имевших изначально лимфому Ходжкина на ранних стадиях, и у 20–40 процентах — на поздних стадиях. Также 10–15 процентов больных будут устойчивы к химиотерапии первой линии (той, которая назначается первой). Во всех этих случаях вполне эффективна химиотерапия второй линии. Она может быть разной:
- GEM-P (гемцитабин, цисплатин, метилпреднизолон);
- GDP (гемцитабин, дексаметазон, цисплатин);
- GVD (гемцитабин, винорелбин, пегилированный липосомальный доксорубицин);
- IGEV (ифосфамид, месна, гемцитабин, винорелбин, преднизолон);
- mini-BEAM (кармустин, этопозид, цитарабин, мелфалан);
- ESHAP (этопозид, стероид, цитарабин, цисплатин);
- ICE (ифосфамид, карбоплатин, этопозид);
- DHAP (дексаметазон, цитарабин, цисплатин). [14]
К сожалению, до сих пор не проводилось достаточно исследований, которые бы ответили на вопрос: какая из этих схем лечения наиболее эффективна. Обычно достаточно двух курсов такой химиотерапии, но некоторым пациентам требуется более длительное лечение.
Если лимфома локализована, то есть зона поражения ограничена, то проводится также лучевая терапия.
После такого курса лечения пациент проходит высокодозную химиотерапию и аутологичную трансплантацию гемопоэтических стволовых клеток (забранных заранее собственных клеток костного мозга, из которых образуются все клетки крови). После этого у 40–60 процентов наступает ремиссия. Шансы выше у тех, у кого был хороший ответ на терапию второй линии.
Если после трансплантации собственных клеток случается рецидив, то есть два варианта:
А) паллиативная помощь, то есть улучшающая качество жизни, но не ведущая к выздоровлению;
Б) высокодозная химиотерапия и трансплантация гемопоэтических стволовых клеток от донора. [5,7]
Беременность и лимфома Ходжкина
Безусловно, во время лечения от лимфомы Ходжкина женщина должна предохраняться, чтобы не забеременеть. Однако если заболевание диагностировали, когда она уже ждала ребёнка, то решение о дальнейшем лечении принимается на основе тяжести её состояния. Если лимфому нашли во время первого триместра, то лечение лучше отложить хотя бы до второго или третьего, так как химиотерапия достаточно токсична, а в первом триместре она особенно плохо может повлиять на развитие плода и вызвать разнообразные пороки. В дальнейшем, на 32–36-й неделях можно стимулировать роды, чтобы быстрее начать лечение.
Если же болезнь прямо сейчас угрожают здоровью и жизни матери, то в любом триместре применяется комбинированная химиотерапия АБВД (доксорубицин, блеомицин, винбластин и дакарбазин). В крайнем случае используется лучевая терапия, но только выше диафрагмы. Чем грозит ребёнку такое лечение во втором и третьем триместрах? Низким весом, задержкой внутриутробного развития, преждевременными родами, мертворождением, умственной отсталостью и плохой обучаемостью. Вместе с химиотерапией могут использоваться стероиды, чтобы снизить токсичность препаратов и ускорить развитие лёгких ребёнка, благодаря чему преждевременные роды будут не такими опасными.
Если лимфома Ходжкина рецидивировала во время беременности, а не была обнаружена впервые, то лучше сделать аборт, а затем провести высокодозную химиотерапию и трансплантацию гемопоэтических стволовых клеток. [8]

Неходжкинская лимфома
Неходжкинские лимфомы можно разделить на три группы: индолентные, агрессивные и высокоагрессивные.
Индолентные лимфомы
Индолентные лимфомы прогрессируют медленно, при этом излечиться от них полностью практически невозможно: они постоянно рецидивируют. К индолентным лимфомам Всемирная организация здравоохранения относит такие заболевания:
- лимфоцитарная лимфома;
- лимфоплазмоцитарная лимфома (макроглобулинемия Вальденстрема);
- плазмоклеточная миелома (плазмоцитома);
- волосатоклеточный лейкоз;
- фолликулярная лимфома (I и II стадий);
- B-клеточная лимфома маргинальной зоны;
- лимфома из клеток мантии (такая лимфома может быть и агрессивной);
- T-клеточный лейкоз из крупных гранулярных лимфоцитов;
- грибовидный микоз;
- T-клеточный пролимфоцитарный лейкоз;
- NK-клеточный лейкоз из крупных гранулярных лимфоцитов. [9]
Если врач сделал биопсию (взял образец ткани) лимфоузла и обнаружил, что лимфома индолентная, то лимфоузел просто удаляется, а пациент периодически приходит к гематологу, рассказывает о своих симптомах, если они есть, проходит осмотр и сдаёт анализы. Такая тактика называется «наблюдай и жди».
Довольно часто без лечения человек долгое время (месяцы или даже годы) может не ощущать себя больным. Поэтому терапию откладывают до тех пор, пока не появятся симптомы, ухудшающие качество жизни.
Начинать химиотерапию сразу не имеет особого смысла, так как это не увеличит продолжительность жизни, но одна линия терапии уже будет использована, а в распоряжении врачей их ограниченное количество. Поэтому, например, если индолентную лимфому диагностировали во время беременности, обычно лечение можно отложить до родов.
Когда человек с индолентной лимфомой выходит в ремиссию, ему могут назначить препарат ритуксимаб в качестве поддерживающей терапии — так рецидив, вероятно, случится позже. [10]
Агрессивные и высокоагрессивные лимфомы
Агрессивные лимфомы — это:
- фолликулярная лимфома (III стадия);
- диффузная крупноклеточная B-клеточная лимфома;
- лимфома из клеток зоны мантии;
- периферическая T-клеточная лимфома;
- анапластическая крупноклеточная лимфома.
- лимфома Бёркитта;
- B-лимфобластный лейкоз/лимфома и предшественников B-клеток;
- T-клеточный лейкоз/лимфома;
- T-лимфобластный лейкоз/лимфома из предшественников T-клеток.
Если лимфома агрессивная или высокоагрессивная, химиотерапию лучше начать сразу же, даже если пациентка — беременная женщина. Схема лечения таких лимфом примерно одинаковая: сначала проводится несколько курсов химиотерапии, нередко с ритуксимабом и достигается ремиссия. Ритуксимаб («Мабтера») — это препарат, который появился в конце 1990-х и сильно улучшил выживаемость при лимфомах. Он относится к группе веществ под названием «моноклональные антитела». Они состоят из иммунных клеток, которые распознают раковые клетки, прикрепляются к ним и блокируют их рост или убивают.
Лучевая терапия при агрессивных лимфомах может применяться, если зона поражения ограничена. Тогда комбинированное лечение даёт лучший результат, чем одна лишь химиотерапия.
Сказать, сколько человек избежит рецидива, невозможно, даже если говорить об одном виде лимфомы. Прогноз может дать только врач, рассчитав всё с учётом особенностей конкретного пациента.
Если ремиссии в итоге не получается добиться или если случается рецидив, то в ход идёт химиотерапия второй линии — теми препаратами, которые ещё не использовались, затем высокодозная химиотерапия и аутологичная трансплантация гемопоэтических стволовых клеток, то есть восстановление убитого препаратами костного мозга за счёт заранее сохранённых собственных клеток. Как таковая аутологичная трансплантация не выполняет лечебную функцию. Она нужна только для того, чтобы у человека восстановилось кроветворение и он выжил после такой терапии. Если и после этого болезнь возвращается, то проводится высокодозная химиотерапия и вслед за ней аллогенная трансплантация гемопоэтических стволовых клеток — от донора. Донором может стать родной брат или родная сестра, если с ними есть тканевая совместимость, или подходящий человек из базы потенциальных доноров. Такая трансплантация играет ещё и лечебную роль. Гемопоэтические стволовые клетки формируют костный мозг человека, который обеспечивает работу иммунной системы. Другими словами, после такой трансплантации иммунитет у пациента уже не свой, а от донора. И новые лимфоциты уничтожают остаточные клетки опухоли. Но при этом клетки, возникшие из донорских гемопоэтических стволовых клеток могут атаковать и другие органы пациента — эта реакция «трансплантат против хозяина» смертельно опасна. Врач должен распознать её максимально быстро и начать лечение гормонами или циклоспорином, то есть иммуносупрессивную терапию — подавляющую иммунитет. Трансплантация донорских гемопоэтических стволовых клеток — крайняя мера, так как смертность от такого лечения составляет 30 процентов.
Если рецидив приходит и после такой трансплантации или если её почему-то нельзя провести (например, из-за тяжёлого физического состояния человека или пожилого возраста — старше 65 лет), то пациент получает поддерживающее лечение — таблетированную химиотерапию. Это стандартные цитостатики (препараты, блокирующие деление опухолевых клеток) в маленькой дозе. Также очень важно, чтобы человек получал паллиативную помощь: лимфома в такой ситуации может ухудшить качество жизни, поэтому врачи борются с симптомами. Например, с болью, тошнотой, потерей аппетита, одышкой и др.

Активное лечение лимфомы может прекратиться и раньше — даже после терапии первой линии. Так бывает, если из-за лечения у человека случился инсульт, инфаркт или другое осложнение. Некоторым пациентам со временем становится всё тяжелее и тяжелее переносить химиотерапию, человек восстанавливается дольше, чем необходимо, и лимфома без лечения в срок растёт. Тогда человеку назначается поддерживающая химиотерапия, которая не избавит от заболевания, но позволит несколько сдерживать рост опухолевых клеток.
Ещё до лечения нужно обсудить с врачом возможное бесплодие, так как химиопрепараты, могут лишить женщину возможности забеременеть, а мужчину стать биологическим отцом своему ребёнку. Поэтому женщинам обычно рекомендуется заморозить свои яйцеклетки, а мужчинам — сперму. Однако в России у женщин с этим возникнут проблемы, так как у репродуктологов обычно нет опыта ведения пациенток с лимфомой, и они не берутся проводить гормональную стимуляцию суперовуляции, что необходимо перед забором большого количества яйцеклеток.
Если после лечения лимфомы вы вышли в ремиссию, доктор захочет вас видеть раз в несколько месяцев, затем всё реже и реже, так как со временем вероятность рецидива уменьшается. [4,11]
Диффузная крупноклеточная B-клеточная лимфома
Этот агрессивный тип лимфомы — самый распространённый среди неходжкинских. Если заболевание обнаружили на ранней стадии, для большинства пациентов лучше пройти сокращённый курс химиотерапии R-CHOP (ритуксимаб, циклофосфамид, доксорубицин, винкристин и преднизон). Также необходима лучевая терапия, однако если она потенциально может ухудшить качество жизни в дальнейшем, то лучше обойтись без неё. Если крупноклеточная лимфома затронула яичко, эпидуральное пространство (снаружи твёрдой оболочки спинного мозга) или околоносовые пазухи, то риск поражения центральной нервной системы вырастает. Поэтому в таких случаях нужно провести интратекальную химиотерапию, то есть ввести препарат в спинномозговую жидкость. Также, если лимфома коснулась яичка, необходимо удалить его и провести облучение этой и соседней области.
В случае рецидива или если лимфома устойчива к терапии первой линии, то рекомендуется использовать схему лечения GDP (гемцитабин, дексаметазон, цисплатин). Альтернативой ей может стать ICE (ифосфамид, карбоплатин, этопозид) или DHAP (дексаметазон, высокая доза цитарабина, цисплатин). Во всех этих случаях нужно также добавить ритуксимаб, если его не применяли в первый раз. После этого сначала проводится высокодозная химиотерапия, а затем аутологичная трансплантация гемопоэтических стволовых клеток (ТКМ). Если болезнь вернулась и после этого, то единственный вариант — аллогенная трансплантация гемопоэтических стволовых клеток, то есть от донора.
Если по каким-то причин проводить ТКМ нельзя или человек не отвечает на терапию второй линии, то ему остаётся лишь борьба с симптомами. [12]
Периферическая T-клеточная лимфома
С этой группой преимущественно агрессивных лимфом борются по стандартной схеме: сначала проводится комбинированная химиотерапия — чаще всего по схеме CHOP (циклофосфамид, доксорубицин, винкристин и преднизон). Если пациент моложе 60 лет, то к этим препаратам добавляют ещё этопозид. Иногда проводится и лучевая терапия. Если в дальнейшем возникает рецидив и человек отвечает на химиотерапию второй линии, то, возможно, ему стоит провести трансплантацию гемопоэтических стволовых клеток. Однако в случае периферической T-клеточной лимфомы такой подход реже приносит хороший результат. Если лечение лимфомы не помогает, врач скорее всего назначит поддерживающую терапию, также в дальнейшем потребуется паллиативная помощь. [4]
Лечение фолликулярной лимфомы
Если заболевание обнаружили на I–II стадии, то такая лимфома относится к индолентным и при необходимости проводится лечение лучевой терапией. Но вероятность возвращения болезни крайне высока.
Если фолликулярную лимфому впервые диагностировали на III–IV стадии, то рекомендуется лечиться ритуксимабом в комбинации с химиотерапией. Например, по схеме R-CVP (ритуксимаб, циклофосфамид, винкристин и преднизон), R-CHOP (ритуксимаб, циклофосфамид, доксорубицин, винкристин и преднизон) или BR (бендамустин и ритуксимаб). В некоторых случаях врач может назначить длительный приём ритуксимаба уже после проведения комплексного лечения.
Но если, несмотря на чувствительность к химиотерапии, случился быстрый рецидив, то человеку, который в состоянии выдержать высокодозную химиотерапию, проводят аутологичную трансплантацию гемопоэтических стволовых клеток. Если она не помогает, прибегают к трансплантации донорских клеток.
Прогноз при фолликулярной лимфоме определяют по специальному индексу FLIPI (Follicular Lymphoma International Prognostic Index). Учитывают такие факторы риска, как возраст пациента старше 60 лет, повышенный уровень ЛДГ, поздняя стадия заболевания (III–IV), снижение уровня гемоглобина менее 120 г/л, более 5 областей нодального поражения. За каждый фактор риска прибавляется 1 балл. Прогноз выживаемости зависит от суммы балов. [6]

Лимфома Бёркитта
После удаления лимфоузла с опухолевыми клетками человек с лимфомой Бёркитта должен пройти 4–6 курсов химиотерапии, чтобы предотвратить прогрессирование заболевания и ранний рецидив (до года). Обычно используются схемы лечения CODOX-M (циклофосфамид, винкристин, доксорубицин, высокая доза метотрексата) в комплексе с IVAC (ифосфамид, цитарабин, этопозид и метотрексат, вводимый в спинномозговую жидкость). Введение препарата в спинномозговую жидкость (интратекальная химиотерапия) очень важно, потому что лимфома Бёркитта чревата осложнениями в центральной нервной системе.
Также иногда применяется протокол CALGB 9251. Это высокотоксичная комбинированная химиотерапия, из-за которой человек надолго оказывается в больнице. Если организм не выдерживает такого агрессивного лечения лимфомы Беркитта, то применяется схема EPOCH (этопозид, преднизон, винкристин, циклофосфамид, доксорубицин) с ритуксимабом.
Во время лечения лимфомы Бёркитта нередко развивается синдром распада (лизиса) опухоли. Это опасное состояние, при котором из-за уничтожения опухолевых клеток в кровь в большом объёме попадают различные вещества, вызывающие метаболические нарушения и приводящие к почечной недостаточности. Чтобы этот синдром не возник, нужен постоянный контроль грамотного специалиста, активное вливание жидкости через вену, а также постоянная корректировка электролитического дисбаланса.
Если лимфома Бёркитта возвращается или оказывается устойчивой к лечению, то вариантов терапии, кроме клинических испытаний, нет — человеку оказывается паллиативная помощь для улучшения качества его жизни. [13]
Лечение лимфоплазмоцитарной лимфомы
Лимфоплазмацитарная лимфома представляет собой необычную разновидность B-клеточной неходжкинской лимфомы. Она получила свое название за то, что под микроскопом ее клетки имеют сходство как с лимфоцитами, так и с плазматическими клетками. Чаще всего она встречается у людей старше 60 лет, растет медленно, но иногда наблюдается быстрый агрессивный рост.
У многих пациентов врачи придерживаются тактики активного наблюдения. При появлении признаков быстрого роста назначают химиопрепараты в сочетании с преднизоном и дексаметазоном, таргетные препараты, иммунотерапию. В редких случаях при экстранодальных поражениях прибегают к лучевой терапии. [4]Лимфобластная лимфома
Основным методом лечения лимфобластных лимфом является химиотерапия. Некоторым пациентам показана лучевая терапия, трансплантация стволовых клеток. При поражении центральной нервной системы химиопрепараты вводят интратекально (под оболочки мозга). [4]
Сопроводительная терапия лимфомы
Безусловно, при лечении лимфомы огромную роль играют те виды терапии, которые направлены непосредственно на борьбу с опухолевыми клетками. Однако очень важно вовремя распознавать осложнения лечения, которые могут привести к тяжёлым последствиям, и применять сопроводительную терапию. Для этого онкогематолог должен, по сути, обладать навыками реаниматолога.
Пациенты с лимфомами, когда болезнь даёт о себе знать, находятся в состоянии иммунодефицита. Химиотерапия окончательно ослабляет способность человека бороться с микробами. В результате может развиться инфекция, которую необходимо лечить грамотно подобранными антибиотиками. Однако они в любом случае уничтожат не только вредные бактерии, но и немалую часть нормальной микрофлоры человека. На это «пустое место» заселяются другие бактерии, грибы, вирусы и простейшие. С ними также нужно уметь справляться: с помощью сильных антибиотиков, противовирусных препаратов и т. д. К сожалению, по-настоящему эффективных противовирусных препаратов очень мало. Это ацикловир, валацикловир, ганцикловир — средства, борющиеся с вирусами герпес-группы (цитомегаловирусом, вирусом Эпштейн — Барра и т. д.). Что касается других вирусов, то в отношении них мы беззащитны (если не брать в расчёт вирусный гепатит и ВИЧ).
Для борьбы с инфекциями могут понадобиться переливания компонентов крови. Назвать этот метод безопасным нельзя, поэтому лечащий врач должен уметь выявить осложнения на раннем этапе.
Некоторые химиотерапевтические препараты способны снижать уровень калия, натрия или кальция в крови. Это чревато осложнениями — такими, как, например, аритмия при гипокалиемии. Поэтому необходимо отслеживать такие побочные эффекты и вовремя их корректировать.
Также есть немало не угрожающих жизни, но крайне неприятных побочных эффектов химиотерапии и лучевой терапии, с которыми врач должен уметь бороться: тошнота, боль, сухость слизистых и многое другое. [1,4,5]
Если у вас диагностировали или заподозрили лимфому, в клиниках «Евроонко» вы получите грамотную медицинскую помощь. У нас работает слаженная команда врачей, в составе которой есть опытные онкогематологи. Мы используем только те современные методы лечения, которые рекомендованы международными врачебными сообществами. Мы применяем препараты, купленные непосредственно у фармкомпаний. Мы отвечаем за качество лечения. Мы оказываем медицинские услуги на уровне ведущих европейских онкологических клиник, при этом цены на лечение лимфомы Ходжкина и других видов лимфом в «Евроонко» существенно ниже, чем за границей.
Источник https://nii-onco.ru/vidy/limfoma-hodzhkina/
Источник https://diseases.medelement.com/disease/%D0%BB%D0%B8%D0%BC%D1%84%D0%BE%D0%BC%D0%B0-%D1%85%D0%BE%D0%B4%D0%B6%D0%BA%D0%B8%D0%BD%D0%B0-%D0%BA%D0%BF-%D1%80%D0%BA-2022/17452
Источник https://www.euroonco.ru/onkogematologiya/limfoma
- 1) Алгоритм диагностики и протоколы лечения заболеваний системы крови, том 2, Под ред. В.Г. Савченко.-М.: Практика, 2016, стр 41. 2) Lymph node pathology for clinicians / Michel R Nasr, Anamarija M. Perry, Pamela Skrabek Springer Nature Switzerland 2019., стр 159-167. 3) Лимфома Ходжкина. Клинические рекомендации. Е.А. Демина, Г.С. Тумян, Т.Н. Моисеева., Современная онкология. 2020; 22 (2): 6–33. 4) Cheson BD, Fisher RI, Barrington SF et al. Recommendations for initial evaluation, staging, and response assessment of Hodgkin and non-Hodgkin lymphoma: the Lugano classification. J Clin Oncol 2014. 5) Hodgkin lymphoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up† D. A. Eichenauer1, B. M. P. Aleman2, M. Andreґ 3,4, M. Federico5, M. Hutchings6, T. Illidge7,8, A. Engert1 & M. Ladetto9, on behalf of the ESMO Guidelines Committee* Annals of Oncology 29 (Supplement 4): iv19–iv29, 2018 doi:10.1093/annonc/mdy080 Published online 23 May 2018. 6) Richard T. Hoppe., et al. Hodgkin lymphoma. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines). Version 3.2021. 7) Общие принципы диагностики лимфом. Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний. Демина Е.А. и др. Под ред. И.В. Поддубной, В.Г. Савченко. 2018; с. 9–27.